
経済学と化学をつなぐ「見えざる手」(前編)
突然だが、この2つの事象にはある共通点がある。何かお分かりだろうか?
企業は長期的には設備を自由に調整できるので、短期より柔軟に生産できる
化学平衡状態に変化を与えると、その変化を打ち消すように化学反応が進む

・・・
・・・・・・
実は、この一見何の関係もなさそうな事象は「ル・シャトリエの原理」という全く同じ原理によって起きている―と言われたら、納得できるだろうか?
私はnoteで経済学関連の連載をしているが、大学院時代の専門は化学であり、ル・シャトリエの原理を初めて知ったのは高校時代である。その後、社会人となりミクロ経済学を学び始めた矢先、生産理論の中に全く同じ法則として現れたの知り、非常に驚いたのを今でも鮮明に覚えている。と同時に、当時はこの2つの一体どこが同じ法則なのか、皆目見当がつかなかった。
この驚くべき事実を解き明かし、経済学と化学という不思議な取り合わせに潜む、天才たちの豊かで奥深い「世界の見方」を垣間見たい、というのがこのテーマを題材に筆を執った動機である。
本編は前後編の2部構成となっており、前半は天才化学者ル・シャトリエが発見した「化学反応の本質」が各界で巻き起こした一大センセーションを取り上げ、後半ではこの原理を経済現象へ応用した画期的理論の核心に迫る。
天才化学者の発見―分子は変化を"嫌がる"―
1884年、当時34歳のフランス人化学者、アンリ・ル・シャトリエは「化学平衡の法則の一般的記述について」と題する論文の中で、次のような経験則が成り立つことを発表した。その主張は一言で言えば、「分子は周りの環境が変化することを"嫌がる"」というものであった。
ルシャトリエの原理
化学平衡にある反応系において、状態変数(温度、圧力、反応に関与する物質の濃度)を変化させると、その変化を打ち消す方向へ平衡は移動する

今日では「ル・シャトリエの原理」として知られる高校や大学初級の化学教科書に必ずとりあげられる有名な原理である。しかしこの原理に潜む非常にあいまいにして神秘的な自然の本質、そしてそれ故にこの原理が化学を超え多くの学問分野に及ぼした影響の大きさは、実はそれほど知られていない。
分子はどのように変化を"嫌がる"のか?
まずこの原理が意味するところを、窒素と水素からアンモニアができる反応を例に考えてみよう。この反応には、大きく次の3つの特徴がある。
【特徴①】窒素と水素からアンモニアができる合成反応と、その逆にアンモニアが窒素と水素に分解される分解反応は、どちらも起きる
【特徴②】窒素1分子と水素3分子からアンモニアが2分子できる。そのため、合成が起きると分子数が4個→2個に減り、分解が起きると逆に増える
【特徴③】アンモニアができると同時に発熱し、周囲の温度を上げる。逆に、アンモニアは周囲の熱を奪って窒素と水素に分解する
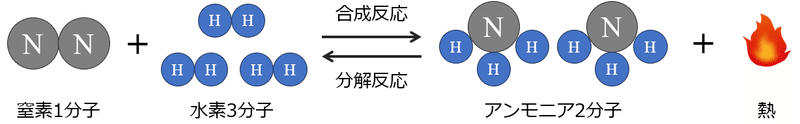
いま、風船の中に窒素と水素を1:3の比率で入れる。するとすぐにアンモニアができ始めるが、風船内の全ての窒素と水素がアンモニアになる訳ではない。なぜなら【特徴①】の通り、アンモニアが窒素と水素に分解される反応も同時に起きるため、時間が経つと容器内には一定割合の窒素、水素、アンモニアが共存し、見た目には全く反応が起きていないような状態になる。しかし、実際は両方向の反応が同時に起きており、そのスピードが同じため変化がないという状態である(これを化学平衡状態という)。この化学平衡状態を初期状態として、次の3つの変化を加えると何が起きるか考えてみよう。
変化A:風船を手でゆっくりと圧縮してみる
この風船を外側からゆっくりと手で圧縮して風船内の圧力を高めたとしよう(圧力とは簡単に言えば風船内の分子が風船内壁にぶつかって手を押し返す力なので、他の条件を一定とすれば風船内の分子数が多いほど圧力は大きくなる)。この後、風船の中では何が起きるだろうか?
ル・シャトリエの原理によれば、次のように予想される。圧縮された風船の中では、分子たちが圧力の上昇を打ち消す方向に化学反応を進行させ、圧力の上昇を和らげようとする。【特徴②】の通り、合成反応が起きると分子の数が減るため、風船内の圧力を高めると、それを和らげるべくアンモニアがより多く合成され、新たな化学平衡状態に至る。
変化B:風船を冷蔵庫に入れてゆっくり冷やしてみる
別のケースとして、この風船を冷蔵庫に入れてゆっくり冷やした場合はどうなるだろうか?気体は冷やすと体積が減るので風船が縮むが、風船内の圧力は初期状態と同じであるとする。今度は風船内の分子たちが温度の低下を打ち消す方向に化学反応を進行させ、温度の低下を和らげようとする。【特徴③】の通り、合成反応に伴い熱が発生するため、風船内の温度が低下すると、それを和らげるべく先ほどと同様にアンモニアがより多く合成され、同時により多くの熱を放出し、こちらもやがて新たな化学平衡状態に至る。
従って逆に、風船の中でなるべく沢山アンモニアを作りたければ、圧力をなるべく高く、温度をなるべく低くせよ、というのが、ル・シャトリエの原理が私たちに教えてくれるメッセージである。
変化C:風船に力を込めて一気にぎゅっと圧縮してみる
ここまでの話を踏まえて、最後にこのような場合を考えよう。風船を手でゆっくりと圧縮するのではなく、力を込めて一気にぎゅっと圧縮した場合、果たして風船内ではどのようなことが起こるだろうか?(ただし風船は十分頑丈で、割れないものとする。)
まず上述の変化Aと同様に圧縮するのだから、分子は圧力の上昇を和らげようとアンモニアが合成する方向に反応が進むはずである、と考えるかもしれない。しかし、今回のケースは実はそれほど単純ではない。通常、気体を圧縮すると温度が上がる(この温度上昇は化学反応で生じる反応熱とは別物である)のだが、変化Aでは「ゆっくりと」圧縮していたため、気体の圧縮熱やアンモニアの合成熱は風船の外に放出され、常に初期状態と同じ温度下で圧縮する、という条件を暗黙に満たしていた(これを等温変化という)。
一方、変化Cの「一気にぎゅっと圧縮」の意味するところは、風船をあまりに急激に圧縮するため、その直後に発生した圧縮熱が風船の外に逃げる時間が無く、風船内の温度を上昇させてしまう、ということである。これはあたかも風船を発泡スチロールのような断熱材で覆いながら圧縮すると生じた圧縮熱が外への逃げ場を失う状況と似ており、断熱変化という。
つまり、「圧力の観点で言えば分子の数を減らす合成方向に反応は進みたくなる」が、「温度の観点で言えば周囲の熱を奪う分解方向に反応は進みたくなる」という状況になる訳である。この状況で実際に反応がどちらに進むかは様々な実験条件に依存するため非常に複雑な問題であるが、ここでは両者の効果が競合した結果、合成方向に進みアンモニアが増えるとしよう。
しかしアンモニアが増えたとしても、変化Cでは温度効果が合成を邪魔する方向に働いたため、その邪魔が入っていない変化Aでアンモニアが増えた量ほどには増えていないだろう、ということが予想できる。つまり各状態におけるアンモニアの量の間には、以下の関係が成り立つと考えられる。
各状態におけるアンモニア量:変化Aの後$${>}$$変化Cの後$${>}$$初期状態
この結果を一般化して考えてみる。変化Aと変化Cの違いは風船の中の熱が外に逃げられるか否かであるが、これを前者が熱の移動になんの制約もかけていない状況、後者は実情としては「熱が逃げる時間が無かった」ということであるが、これを(発泡スチロールなどで覆って)熱の移動に制限をかけた、と解釈すると、「熱の移動に制限をかけたことで、そうでない場合ほどにはアンモニアが増えなかった」ということになる。
この事実を、化学の議論としては甚だ乱暴かつ不正確ながら、後の議論を踏まえ次のような仮説を裏付けるの実験結果の一例が得られた、と考えたい。
化学平衡にある反応系において、ある外部条件を変化させると、その変化を打ち消す方向へ平衡は移動するが、別の条件に制約を課した場合、その制約がない場合ほどには大きく移動しないことがある(※)。
これは分子の「条件の変化を嫌がる」性質による効果が、一方の条件では合成方向に、他方では分解方向にと、互いに逆方向に働くためである
※仮にこの合成反応が吸熱反応だった場合、断熱的に圧縮すると圧縮熱の発生は反応を合成方向に進めるが、今度は合成反応によりやがて周囲が冷やされる。断熱変化では外界との熱移動が遮断されているため、そうでない場合(=外界から熱の供給がある場合)と比較してより多くのアンモニアが合成されるとは一概に言い切れず、従ってこの原理から直ちに反応の向きを予測できる訳ではない、というのがこの議論の難しいところである。
分子はなぜ変化を"嫌がる"のか?
ル・シャトリエの原理は上記の難しさはありながら、今日では化学平衡に限らず、化学変化を伴わない物理平衡(気液平衡や溶解平衡など)にもよく当てはまる普遍的な大法則であると認められている。しかし同時にこの原理の何とも不思議なところは、自然があたかも意志を持っているかのように振舞うと主張している点である。この点について化学史研究の一見解としては、
自然があたかも、外界から課せられた条件の変化に反抗する意志を持つかに想像させる。その意志はまた、自然が何かの形で現れるとき、形を規正するための一般的目標、あるいは目的とも言いうるであろう
とまとめられ、ル・シャトリエの原理を目的論的論理と呼んだ。さらに自然の意志や目的などは直接とりあげることができず、従ってこの原理は証明できない仮想である、と論じている。また同様の性質を持つ先行的な原理を引き合いに出し、以下のようにもまとめている。
最小作用の原理や最小時間の原理には、最高理性としての神の自然における合理性の実現というような価値観が含意されているので、この原理も同じような意味で自然の摂理と見なすことができる
従って「分子はなぜ変化を"嫌がる"のか?」の問いに対しては、「神がそのように分子の振る舞いを規定したと仮想して考えると人間にも理解しやすいから」という、何とも曖昧な答えが返ってきたわけである。
学説史上はこの原理の発表後、その適用範囲を巡る議論が活発になり、一方では化学的に適用が難しい状況や例外などの適用不能例に対する注意喚起の議論が、他方では逆に広く一般的に利用できる形而上学的な原理と見なして、化学系や物理系を超えた心理学、経済学及び社会学の分野への応用可能性に関する議論が巻き起こった。
―そして遂に、この原理の経済動態分析への応用を試みた、一人の天才経済学者が現れたのである。
想像力は、化学を超えて経済学へ―
かくしてル・シャトリエの原理は化学・物理の世界で一大センセーションを巻き起こしたが、その一方で経済学者からは、この原理はやや別の角度から興味・関心を引いたようである。
1884年以来、熱力学の文献にはルシャトリエ原理に関する関心がみられる。通常、この原理は、あいまいにして、しかも神秘的に定式化されており、自己中心的競争が無意識のうちに社会善に導くとするアダム・スミスの慈悲深い「見えざる手」をほうふつとさせるような目的論的言語でもって表現されている。たとえば、次の定式化がその代表例である。「ある熱力学体系の外部条件が変更された場合、体系の均衡は外部条件の変化に対立するような方向に移動する傾向がある。」
この国富論のあまりにも有名な一説である「見えざる手」とル・シャトリエの原理との間に奇妙な一致を見出した経済学者こそ、この原理を経済学に応用したアメリカの天才経済学者ポール・サミュエルソンである。

彼は当時最先端の化学理論から、いかに着想を得て、それらを自身の経済理論にどのように応用していったのか?またそうして打ち立てられた彼の理論は、今日どのように解釈されているのか?後編にてその核心へ迫る。
この記事が気に入ったらサポートをしてみませんか?
