
食生活の変化による脂肪酸代謝の進化:植物性脂肪か動物性脂肪か
健康食事法は1万年前から変わらないのか?
油(脂質)の取り過ぎは体に悪いと思っている人でも、「青魚に含まれるDHAやEPAは健康によさそう」、とか、「油のなかでもエゴマ油や亜麻仁油がいいらしい」と思っている人は結構いるのではないだろうか。そうだとすると、魚を毎日食べている漁師さん、もっと極端にいえば、北極圏で魚をたくさん食べているイヌイットの人たちはより健康なのだろうか?
パレオダイエットという健康食事法がある。人類はホモ・サピエンスへ進化する以前から何百万年にもわたって狩猟採集生活をしてきた。農耕生活が開始されたのが約1万年前で、人類の歴史からみるとわずかな時間である。従って、「人類は狩猟採集生活に適応しており、その時代の食べ物が健康によい」というものだ。しかし、狩猟採集生活をしていた1万年前からヒトの体が食生活に応じて進化していないという根拠はあるのだろうか?
また、近年、「医療データが示す最強の食事」とか、「科学的に証明された究極の食事」といったように、健康によい食事が紹介されているが、健康によい食事は、すべての現代人に共通にいえることなのだろうか?
本稿では、ヒトの食事の中でも特に脂肪に焦点をあて、食生活の変化に伴う体内での脂肪代謝の進化について、最新の研究から考察してみたい。
食事から摂取しなければいけない脂肪酸
人間の生命維持に必要な脂肪の中には、体内で合成できず、食事から摂取する必要がある必須脂肪酸がある。植物からの脂肪であるリノール酸やα-リノレン酸は必須脂肪酸だ。リノール酸はコーン油、綿実油、大豆油などに含まれるオメガ6系脂肪酸で、α-リノレン酸は亜麻仁油、エゴマ油や海藻などに含まれ、オメガ3系脂肪酸である(図1)(1,2)。リノール酸やα-リノレン酸は植物性の食べ物から摂取することになる。DHAやEPAは、サバやイワシあるいはカツオやマグロなどの青魚から摂取することができるが、α-リノレン酸から、FADS2やFADS1という酵素によって変換される(図1)。同様にアラキドン酸という脂肪酸も肉や卵から摂取することができるが、リノール酸からも同じFADS2やFADS1という酵素によって変換される(図1)。しかし、オメガ3系脂肪酸からオメガ6系脂肪酸へ、またその逆の変換はできない。
アラキドン酸は、細胞の生体膜に必要な脂肪酸であるが、そこから変換される生理活性物質は、炎症を促進したり、血管を収縮する働きがある。逆に、EPAから変換される生理活性物質は、炎症を抑えたり、血管を拡張したりする。現代人は、コーン油、ナタネ油や肉・卵などからオメガ6系脂肪酸を過剰に摂取しており、どうもそれが健康によくないらしい。炎症は過剰に生じると様々な疾患につながるが、それが生じること自体は生体の恒常性を維持するための防御機構として必要なことである。つまり、オメガ6系とオメガ3系脂肪酸のバランスが重要であるということである(3)。
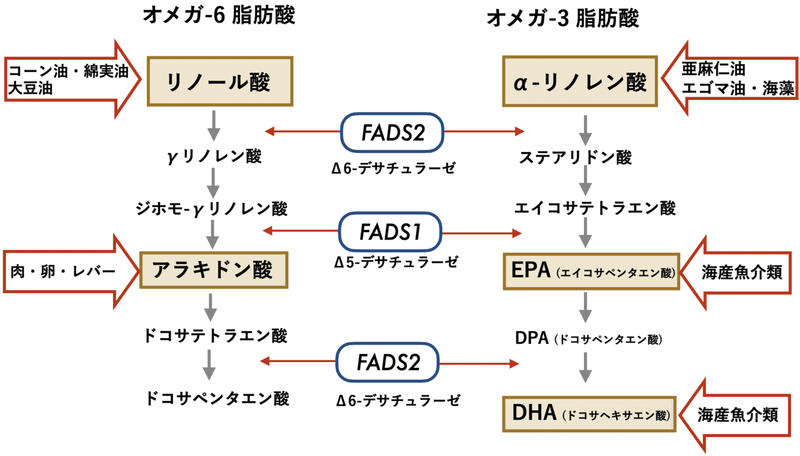
図1. オメガ3系脂肪酸とオメガ6系脂肪酸の代謝経路. Buckley, M. T. et al. (2017)の図1およびKoletzko, B. et al.(2019)の図1を改変(1,2)。
植物性脂肪酸から動物性脂肪酸への変換効率の違い
図1に示してあるように、FADS1(脂肪酸デサチュラーゼ,脂肪酸不飽和化酵素)やFASD2は、リノール酸をアラキドン酸へ、α-リノレン酸をEPAあるいはDHAに変換してくれるわけだが、その変換効率には、個人によって違い(変異)がある(2,4)。この違いは、FADS1とFASD2を体内で作り出す遺伝子の違いであり、効率のよい遺伝子セット(FADS1遺伝子とFASD2遺伝子の2つがいっしょに関与しているが、特にFADS1遺伝子の効率がよい)を持っている人とそうでない人がいる。効率のよい遺伝子セットがD型(派生型)、効率の悪い遺伝子セットがA型(祖先型)である[注1]。A型は祖先型、もともと人類がもっていた型で、D型は派生型、祖先方が変異して生じて、集団中に広がっていた型である。(ここでいう型は、血液型でいうとA型、B型、AB型,O型といった型ではなく、血液型を決めるA, BあるいはOといった対立遺伝子と同じと考えるとよい)
ヨーロッパでの調査では、全体として、D型の人は、脂肪酸(アラキドン酸やEPA)の血中濃度が高い傾向にある(2)。つまり、D型の人はリノール酸からアラキドン酸、α-リノレン酸からEPAへの変換が活発に行われているということらしい。
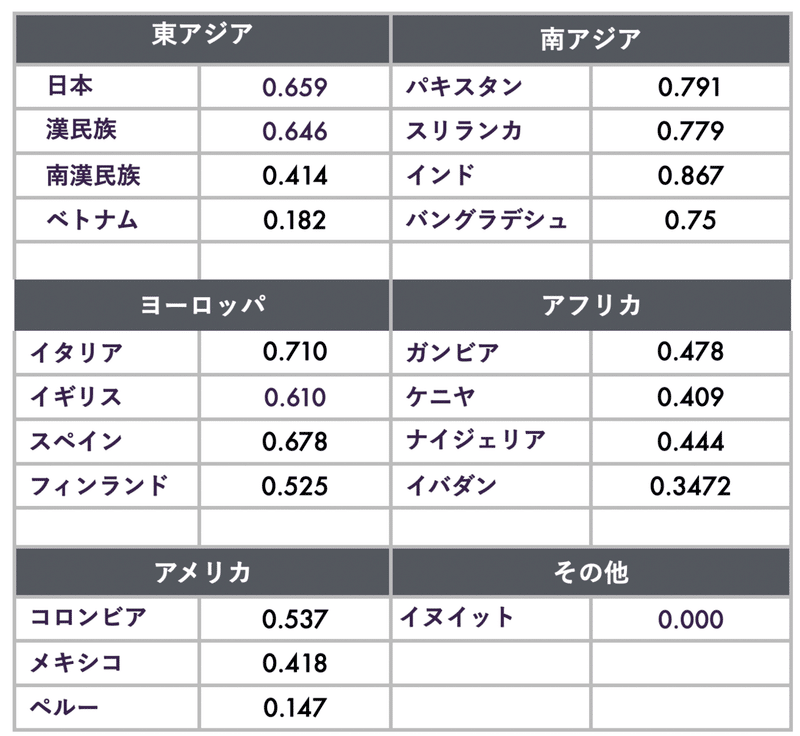
現代人の異なる集団でのD型の頻度を表1に示した[注2]。現代人の多くは、変換効率のよいD型を4割から7割の人がもっている。日本人も2から3割は変換効率の悪い遺伝子セットを持っている。興味深いのは、北極圏で生活するイヌイットの人たちで、D型の頻度はゼロである。イヌイットのヒトたちは、魚やアザラシの肉から動物性の脂肪をとっているので、植物性脂肪から変換する必要がないためだと考えらる。
表1. 異なる集団でのD型FADS遺伝子の頻度。Ye et al. (2017)の表S4の数値を引用(4)。現在のヒトの集団には、D型とA型のほかに他の型(ハプロタイプ)もある。アフリカではD型の頻度が0.4くらいであるが、A型はほぼ0である。
注1. ゲノム間には、一塩基の違い(SNP)や数塩基の挿入や数塩基の挿入・欠失があるかないかの違い(Indel変異)などがある。FADS1とFASD2の酵素をコードしているDNA配列は隣接して存在し、2つの遺伝子の領域を合わせて、多くのSNPやIndel変異が存在している。それらの変異はゲノム配列中の近い位置にあるので、特定の配列の組み合わせをもつ配列(ハプロタイプ)が、セットになって子どもに引き継がれる(2,4,5)。本稿では、派生型のハプロタイプをD型あるいはD型FASD遺伝子, 祖先型A型あるいはA型FASD遺伝子と呼ぶ。
注2. D型FADS遺伝子の頻度とは、人の集団の中で、D型をもっている人の割合である。一人の人は2つの対立遺伝子(ハプロタイプ)をもっているで、たとえば50人の人なら100遺伝子の中にしめるD型の割合いということになる。
食生活の変化がD型FADS遺伝子の頻度を増加させた?
Ye et al. (2017)は、3万年から1万年前のヨーロッパでの古代人のゲノム配列を用いて、D型FADS遺伝子の頻度の推移を調べた(4)。かれらの解析によると約1万年前、つまり人間が農耕生活を開始するまで、ヨーロッパでは、D型の頻度は次第に減少し、その後、農耕生活により食べ物が植物ベースに変わることにより、D型頻度が自然選択を受け、増大していったと推定された(図2の1万年前までと現在での推定)。(D型FADS遺伝子を持ってる人の生存率や繁殖数がA型の人と変わらなくてもD型FADS遺伝子の頻度はランダムに増えたり減ったりするのだが、自然選択を受けるとそれよりも早く頻度が増大する)
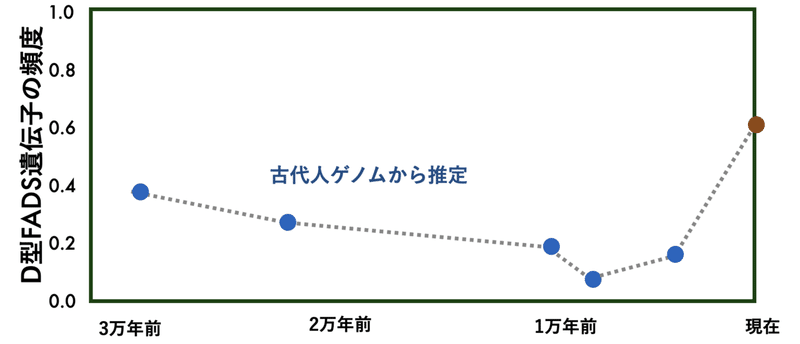
図2. D型FADS遺伝子の頻度変化。古代人ゲノムから推定したD型FADS遺伝子(ハプロタイプD)の約3万年前からの頻度変化、Ye et al. (2013)とMathieson and Mathieson (2018)のデータを用いて描画(4,5)。
ヒト(ホモ・サピエンス)は、アフリカで約2から30万年前に生じ、約5から6万年前に、アフリカを出て世界各地に拡散していった(「ヒトはいつ出現し、どう進化をたどってきたのか」を参照)。Mathieson and Mathieson (2018)は、ヒトにおいてA型FADS遺伝子からD型が生じ、D型が頻度を増大させていったのは、約30万年前からと推定した(5)。つまり、ホモ・サピエンスが生じた頃あるいはそれより前からアフリカでは、もともとの祖先方であったA型に変わってD型が有利になり増加したようだ。
その後、アフリカを出て、ヨーロッパに移動したヒトは、次第にD型FADS遺伝子の頻度を減少させたと考えられている(4,5)。新石器時代以前(約1万年前のより以前)のヨーロッパの大西洋岸、バルト海周辺、ドナウ川沿いの遺跡の調査から、ヨーロッパの狩猟採集民では海洋性または淡水性の水生食物が重要な役割を果たしていたらしい(5)。EPAやDHAは、魚などの水生食物には多く含まれるが、動物の肉や牛乳では少なく、植物ではほとんど含まれていない(4)。ヨーロッパの狩猟採集民では、リノレン酸からEPAやDHAに変換する必要がなく、逆にEPAやDHAを取り過ぎても体に良くなかった可能性がある。実際に、イヌイットの人は、D型の頻度が0であるということは、魚を食べ物からよくとっている人は、変換効率の悪いA型が有利に働いているということを示唆している(4) 。
ヨーロッパでは、農耕と牧畜が8千5百年前に、エーゲ海とバルカン半島に広がり、7千5百万年前にはイベリア半島に広がったとされている(4)。農耕と牧畜は人類の食生活を植物ベースに変化させ、それより食物由来の油脂である(リノレン酸とα-リノレン酸)からアラキドン酸やEPA、DHAの生合成が促進されるD型が自然選択に有利に選択されたと考えられる。
しかし、Mathieson and Mathieson (2018)はデータを増やし、再解析したところ、D型は農耕が開始してからしばらくは頻度の増加がみられず、約4000年前(青銅時代)から急激に頻度を増加させたと推定した(図1)(5)。これは、ヨーロッパでの農業が開始されてすぐにD型が有利になったわけでなく、約4000年前になってより有利さが顕著になったことを示している。初期の農民は、狩猟採集民からの食生活がそれほど大きく変化せず、より時間を経て食生活が変わったか、そのころ、まだ人口が少なく、自然選択の効果が小さかったと推論した(5)(注3)。
注3 .個体数が小さいと生存率の差による自然選択よりも偶然に遺伝子頻度が変動する効果が上回る。
アジアとアメリカでのFADS遺伝子の進化
前述したように、アフリカ大陸では、ホモ・サピエンスが生じる前から、D型FADS遺伝子の頻度が増加した。現在では、祖先方のA型FADS遺伝子はほとんどアフリカではみられない(表1の説明も参照)(5)。現在のアジアの人々のD型FADS遺伝子の頻度もヨーロッパと同じような頻度になっている。アジアの人々の祖先も、アフリカから出た後、D型の頻度は減少し、その後増加したようだ。Mathieson and Mathieson (2018)らの推定では、ヨーロッパよりも早い時期にD型の選択があり増加し始めたらしい(5)。アジアでの農耕の開始はヨーロッパよりも後なので、アジアでも農耕の開始とD型FADS遺伝子が選択をうけ頻度を増加させた時期は一致していないようだ(5)。
アジアで興味深いのは、東南アジアの島々に生息する人たちである。東南アジアの島に住む人は、A型の頻度が高い。インドネシアのフローレス島という大きな島がある。ここには、ピグミー族と呼ばれる身長の低い小柄な人々が生活している。ここの人々はほとんどがA型FADS遺伝子で、A型が有利に自然選択を受けた痕跡がある(6)。おそらく食生活が関係していると指摘されている(6) 。
ところで、フローレス島にはホモ・フローレシエンシス(フローレス人 Homo floresiensis, 「ヒトはいつ出現し、どう進化をたどってきたのか」の図2参照)という身長1mくらいの、身長の低いホモ・サピエンスではない古代人が6万年前くらいまで生息していた(「指輪物語」のホビットの名前が愛称としてつけられた)。現代のホモ・サピエンスであるピグミー族の人々は、このフローレス人の骨が見つかった洞窟の近くで生活しているが、ゲノム解析の結果、フローレス人とピグミーの人たちとの関係は見つからなかった(6)。
アメリカ大陸の先住民の人々はどうであろうか。ヒトは、約2万年から2万五千年前に、地続きだったベーリング海峡からアメリカ大陸に渡った。当時、シベリアや北極圏で生活していた人々は、現在のイヌイットの人々のように魚などの食生活が中心であったと考えられる。イヌイットの人々は、D型を持たずA型のみであることは前述したが、これは現在のイヌイット集団とシベリアの集団の共通祖先の人々は、少なくとも2万年前にEPAやDHAが豊富な北極の食生活に適応したとされている(4)。アメリカ先住民の集団でも同様にA型が有利に選択されていることが報告されたが(7)、アメリカ先住民の祖先であるシベリアの集団のA型をそのまま引き継いだのか、A型が有利になって頻度が増大したのかは不確定であると指摘されている(8)。
D型FADS遺伝子に関わるどんな性質が有利に働いたのか?
ここまでみてきたように、D型FADS遺伝子は、ヒトの食生活が魚など中心から植物ベースになり、植物からの摂取するリノール酸やα-リノレン酸をアラキドン酸やEPA,DHAへの変換効率の高いD型が生存や繁殖に有利になり、近年(約4000年前ごろから)になって頻度を増加させたと考えられる。このD型は、特にFADS1の活性が高いと推定されており, 血清中のアラキドン酸、EPAの濃度が高いことと関連していると考えられている(2,4)。しかし、遺伝子の違いがどのように具体的にヒトの適応度(一生涯に残せるこどもの数)の違いの原因になったのかは確実には特定できていない。
D型とA型として単純に説明したが、その型間には多数のDNA配列の違い(SNPやindel変異)があり、それぞれに影響している要因が異なっている。Ye et al. (2017)らは、多数のヒトのゲノムと疾患の関係を調べたゲノム解析の結果を総合しているデータベース(GWAS catalog)を用いて、D型の変異に関連している疾患を調べた(4)。前述したように、D型の遺伝子は、アラキドン酸やEPAなどの脂肪酸の血清中での増加と関係している。同時に、D型の遺伝子を持つヒトは、総コレステロール量は増加するが、中性脂肪は減少する傾向がある(4)。具体的疾患との関連では、全身性の炎症や心臓死のリスクが低下し、また、炎症性腸疾患(クローン病および潰瘍性大腸炎)および双極性障害のリスクを低下させるようだ(4)。
一方、新石器以前のヨーロッパ、フローレス島のピグミーやイヌイットの人々のように、魚などからDHAやEPAを多く摂取可能な食生活では、ヒトはA型FADS遺伝子を持つように進化している。A型FADS遺伝子は、喘息、アレルギー性鼻炎やアトピー性湿疹の有病率や花粉症リスクが減少しているという報告があり(3)、食生活によっては、A型がD型に比べて有利になっていると考えられる。
オメガ3系とオメガ6系脂肪酸が体内でどのような影響を及ぼすかは複雑で、様々な生理機構と関係しているらしい。DHA、EPA、アラキドン酸をはじめ、様々な形で存在する脂肪酸から生成される生理活性物質は、肥満をはじめとしたエネルギー代謝、炎症などに関わる免疫系や脳での認知機能など複雑に影響している(9)。
私たち現代人がどんな脂肪をどれだけとればよいかは、FADSの遺伝子型によって違ってくるのではないか、ということがこれまでの研究から示唆される。たとえば、D型FADS遺伝子をもつ小児は、A型に比べて1日のマーガリン摂取量が多いと喘息リスクが増大するらしい(2)。逆にA型の乳児は、ミルクにDHAやアラキドン酸が欠乏すると認知機能が低下するという(2)。今後、脂肪の取り方の違いが、FADS遺伝子型によって長期的(一生涯)にどのように影響するのか、といった研究が必要かもしれない。
トゲウオでのFADS2遺伝子の進化
ところで、魚を食べることでDHAやEPAを摂取できるということは、魚にはDHAが多く含まれていることになる。魚はDHAをどこから得ているのだろうか?トゲウオという魚がいる。トゲウオの一種であるニホンイトヨ(Gasterostues nipponicus)は、主に、海で暮らし、産卵のときだけ河川を遡上する。生まれた稚魚は、海に戻って成長を続ける。淡水ではうまく生きていけないのだ。
国立遺伝学研究所の石川麻乃さん(現東京大学)と北野潤さんらは 、北海道から採集してきたニホンイトヨの稚魚がうまく育たないことから、水族館の人に相談した。石川さんらはブラインシュリンプという餌で稚魚を育てていたが、水族館では餌にDHAを付加していることを教わり、DHAがニホンイトヨの稚魚にとって必須だったことを知る。
トゲウオは世界中に分布している。もともとは海水に生息していたトゲウオは数百万年前から、川や湖などの淡水環境へ何度も生息範囲を広げたことが知られている。ニホンイトヨが、淡水で上手く生きられない原因はDHAにあると考えた石川さんたちは、FADS2遺伝子を調べてみた(DHAは、DPAからFADS2によってDHAに変換される、図1) 。その結果、淡水で生活できるイトヨが2個のFADS2遺伝子を持つのに対して、ニホンイトヨはFADS2遺伝子を1個しかもっていなかったのである。同様に、世界中の海水にしか生息できないトゲウオと淡水に生育するトゲウオを比べてみても、淡水に生息できるトゲウオは海水域に生息するトゲウオよりFADS2遺伝子の数が多いことが示されたのである(10)。さらに、トゲウオだけでなく他の魚種でも調べてみたところ、淡水でも生息できる種は海水域でのみ生息する種に比べてFADS2遺伝子の数がやはり多くなっていた(10)。
個体のもつゲノムの間で同じタンパク質をつくる遺伝子の数が異なる違いのことを遺伝子のコピー数変異とよぶ。遺伝子の数が増えたり、減ったりすることで、遺伝子によって作られるタンパク質の量が変化したりすることで、病気の原因になったりもする。しかし、このFADS遺伝子の場合、作られる酵素量が増えて活性が高まり、DHAへの変換効率が良くなったのだと考えられる。海水域には、魚が餌とするプランクトンや藻類にはDHAが多く含まれるが、淡水域のプランクトンには少なく、魚が体内で効率よく合成する必要があったのだろう。
石川さんと北野さんのインタビュー記事。「海から川へ、魚はなぜ進出できたのか - トゲウオが教えてくれた淡水魚の謎 -」

図3.エゾトミヨ。日本の淡水に生息するトゲウオ
食生活の変化は、数千年で人類を進化させる
本稿でみてきたように、人類が約1万年前に、農耕を開始し、穀物などの植物ベースの食べ物が人類にとって主要な食物になったことで、食べ物からとる脂肪が植物性脂肪中心になり、EPA、DHAやアラキドン酸への変換効率の高いFADS遺伝子が進化してきた。その進化は、約4千年前から急速に生じたとことが古代人ゲノムの解析などから示された。
このFADS遺伝子のような進化は他にもみられる。牧畜により牛乳をヒトが飲むようになり、赤ちゃんのときだけでなく、成長してからも乳糖を分解できるようになったラクターゼ遺伝子の進化(11)、エルゴチオネイン(穀物などの栽培植物では含有率が低い)という抗酸化作用のある物質の摂取が低下することで、エルゴチオネインの吸収率を高めるOCTN1という遺伝子(12)なども同様に、約4千年前から急激に進化している(5)。
冒頭で述べた「ヒトは狩猟採集生活に適応しており、農耕が開始して1万年という短い時間では、ヒトは進化できていない」というパレオダイエットの前提は必ずも正しいとはいえない。同様に「ヒトの行動や心の進化が狩猟採集生活に適応している」とする進化心理学の前提(13)も適切ではないことがわかる。もちろん、1万年以上、ヒトが適応的に進化できていない例は多数ある。過去の環境に適応し、現在の環境に適応できていない場合を進化的ミスマッチといい、現代人の様々な病気と関連している。また、いくつかの原因から、環境とは関係なく、病気になるような有害といわれる遺伝子が進化する場合もある(これらについては今後別のnote記事で紹介したい)。
FADS遺伝子は、リノール酸からアラキドン酸(オメガ6系)とα-リノレン酸からEPA、DHA(オメガ3系)への変換の両方に働く。そのため、リノール酸をとりすぎたので、α-リノレン酸からEPAへの変換をより高めるというような進化はおそらく生じていないと思われる。食生活の変化によって変換効率のよいD型FADS遺伝子が進化したといっても、オメガ3系とオメガ6系の脂肪酸のバランスをとってくれるようには進化していないのではないだろうか。つまり、進化的な適応といっても、食生活の変化に応じて、うまく適応できるように進化可能な面もあれば、できない面もあるということだ。
私は、医者でもないし、栄養士でもなく、具体的にどのような脂肪をどの程度摂るべきかをアドバイスすることはできない。進化の研究からいえることは、どのような脂肪をどのような割合いでとるとよいかは、遺伝子の型によって異なるということだろうか。ヒトは、個人の間で様々な違いが存在し、その多くは遺伝子の違いによっている(14)。これからの健康法や医学的治療には、個人の遺伝的な違いを考慮する必要性が高まるかもしれない。
以下の記事では、人間の遺伝的多様性について考察しています。
進化的視点からみる人間の「多様性の意味と尊重」
ビール好きの人は以下の記事も一読ください。
ビール酵母の進化とビールの多様化
引用文献
1. Buckley, M. T. et al. (2017) Selection in Europeans on Fatty Acid Desaturases Associated with Dietary Changes. Molecular Biology and Evolution, 34, 1307–1318
2. Koletzko, B. et al. (2019) FADS1 and FADS2 Polymorphisms Modulate Fatty Acid Metabolism and Dietary Impact on Health. Annual Review of Nutrition 39, 21–44.
3. Simopoulos, A. P. (2011) Evolutionary Aspects of Diet: The Omega-6/Omega-3 Ratio and the Brain. Molecular Neurobiology 44, 203–215.
4. Ye, K., et al. (2017) A. Dietary adaptation of FADS genes in Europe varied across time and geography. Nature Ecology & Evolution 1, 0167.
5. Mathieson, S. & Mathieson, I. (2018) FADS1 and the Timing of Human Adaptation to Agriculture. Molecular Biology and Evolution 35, 2957–2970.
6. Tucci et al. (2018) Evolutionary history and adaptation of a human pygmy population of Flores Island, Indonesia. Science, 361, 511-516.
7. Harris, D. N. et al. (2019) Evolution of Hominin Polyunsaturated Fatty Acid Metabolism: From Africa to the New World. Genome Biology and Evolution 11, 1417–1430.
8. Mathieson, I. (2020) Limited evidence for selection at the FADS locus in Native American populations. Molecular Biology and Evolution 37, 2029–2033.
9. Reynolds, L. M. et al. (2020)FADS genetic and metabolomic analyses identify the ∆5 desaturase (FADS1) step as a critical control point in the formation of biologically important lipids. Scientific Reports 10:15873
10. Ishikawa, A. et al.(2019) A key metabolic gene for recurrent freshwater colonization and radiation in fishes. Science 364, 886–889.
11. Enattah, N. S. et al. (2002) Identification of a variant associated with adult-type hypolactasia. Nature Genetics 30, 233–237.
12. Huff, C. D. et al. (2012) Crohn’s Disease and Genetic Hitchhiking at IBD5. Molecular Biology and Evolution 29, 101–111.
13. アラン・ミラー/サトシ・カナザワ (2019)『進化心理学から考えるホモサピエンス』. パローリング株式会社[伊藤和子訳]
14. 河田雅圭 (2021) 進化的視点からみる人間の「多様性の意味と尊重」『東北大学教養教育院叢書「大学と教養」第4巻 多様性と異文化理解』 pp.3-28, 東北大学教養教育院編/東北大学出版会
この記事が気に入ったらサポートをしてみませんか?
