接種者と未接種者で伝播力には差がない:査読前
連邦刑務所におけるSARS-CoV-2デルタ型に感染したワクチン接種者と非接種者の感染可能性(2021年7月~8月
Phillip P. Salvatore, Christine C. Lee, Sadia Sleweon, David W. McCormick, Lavinia Nicolae, Kristen Knipe, Thomas Dixon, Robert Banta, Isaac Ogle, Cristen Young, Charles Dusseau, Shawn Salmonson, Charles Ogden, Eric Godwin, TeCora Ballom, Tara Ross, Nhien Tran Wynn, Ebenezer David, Theresa K.Bessey, Gimin Kim, Suganthi Suppiah, Azaibi Tamin, Jennifer L. Harcourt, Mili Sheth, Luis Lowe, Hannah Browne, Jacqueline E. Tate, Hannah L. Kirking, Liesl M. Hagan
doi: https://doi.org/10.1101/2021.11.12.21265796
この論文はプレプリントであり、査読を受けていません(これはどういう意味ですか?]この論文は、まだ評価されていない新しい医学研究を報告しているため、臨床診療の参考にすべきではありません。
アブストラクト
背景 SARS-CoV-2に感染したワクチン接種者がどの程度感染に寄与しているかは不明である。連邦刑務所内でワクチン接種率の高い収容者の間でSARS-CoV-2デルタ型が流行した際に,ワクチン接種者と非接種者のウイルス排出量を評価した.
方法 SARS-CoV-2感染が確認された被収容者のうち、同意を得ている者は、10日間連続で毎日、中頸部の鼻腔検体を提供し、質問票で症状データを報告した。これらの鼻腔検体を用いて,リアルタイム逆転写ポリメラーゼ連鎖反応(RT-PCR),ウイルス全ゲノム配列決定,およびウイルス培養を行った.RT-PCRおよびウイルス培養が陽性であった期間は、生存率分析を用いて評価した。
結果 95人の参加者から合計978個の検体が提供され,そのうち78人(82%)が完全にワクチンを接種しており,17人(18%)が完全にワクチンを接種していなかった。完全接種者のRT-PCR陽性期間(中央値:13日)と非接種者のRT-PCR陽性期間(中央値:13日,p=0.50),および培養陽性期間(中央値:5日,5日,p=0.29)には,有意な差は認められなかった。完全にワクチンを接種した人では、培養陽性期間は、モデナ社のワクチン接種者の方が、ファイザー社(p=0.048)およびヤンセン社(p=0.003)のワクチン接種者よりも短かった。
結論 この分野が発展していく中で、臨床医や公衆衛生担当者は、ワクチンを接種した人がSARS-CoV-2に感染しても、ワクチンを接種していない人に比べて感染力が劣ることはないと考えるべきである。これらの知見は、特にウイルス感染が大規模なアウトブレイクにつながる可能性のある集会施設においては、決定的に重要である。
競合する利益に関する声明
著者らは、競合する利益を宣言していない。
資金調達に関する声明
本研究は,米国疾病対策センターからの資金提供を受けて実施した。
作者宣言
私は、関連するすべての倫理指針が遵守され、必要なIRBおよび/または倫理委員会の承認が得られたことを確認します。
はい
記載された研究に対して承認または免除を行ったIRB/監督機関の詳細を以下に示します。
この活動は、米国連邦刑務所局の研究審査委員会により審査・承認されました。この活動は、CDCによって審査され、適用される連邦法およびCDCの方針と一致して実施されました。例えば、45 C.F.R. part 46.102(l)(2)、21 C.F.R. part 56、42 U.S.C. 241(d)、5 U.S.C. 552a、44 U.S.C. 3501 et seq.などを参照。必要なすべての患者/参加者の同意が得られており、適切な機関のフォームが保存されている。
私は、必要な患者/参加者の同意がすべて得られており、適切な機関のフォームが保管されていること、また、含まれている患者/参加者/サンプルの識別子は、研究グループ以外の誰(例えば、病院スタッフ、患者または参加者自身)にも知られていないため、個人を特定するために使用することはできないことを確認します。
はい
私は、すべての臨床試験およびその他の前向き介入研究は、ClinicalTrials.govなどのICMJEが承認した登録機関に登録しなければならないことを理解しています。原稿で報告されたそのような研究が登録されており、試験登録IDが提供されていることを確認します(注:遡及的に登録された前向き研究を掲載する場合は、試験ID欄にその研究が事前に登録されていなかった理由を説明する文章を記載してください)。
はい
私は、適切な研究報告ガイドラインをすべて遵守し、該当する場合は、EQUATOR Networkの研究報告チェックリストやその他の関連資料を補足ファイルとしてアップロードしました。
はい
脚注
免責事項本報告書に記載された知見および結論は、著者個人のものであり、必ずしも米国疾病対策センター(CDC)の公式見解を示すものではありません。
COVID-19 SARS-CoV-2のプレプリントをmedRxivとbioRxivに収録した論文
著作権 このプレプリントの著作権者は、medRxivにプレプリントを永続的に表示するライセンスを付与した著者/出資者です。本論文は米国政府の著作物です。この記事は米国政府の著作物であり、17 USC 105に基づく著作権の対象ではなく、またCC0ライセンスの下で利用可能です。
この記事にリンクしているブログ記事
メテオ・ウェブ、2021年11月19日
SARS-CoV-2に感染したワクチン接種者がウイルスの伝播に寄与しているとされるラ・ミスラは、非...
この記事を参照しているツイート
以下フルテキスト(全文訳)
アブストラクト
背景 SARS-CoV-2に感染したワクチン接種者がどの程度感染に寄与しているかは不明である。連邦刑務所内でワクチン接種率の高い収容者の間でSARS-CoV-2デルタ型が流行した際に,ワクチン接種者と非接種者のウイルス排出量を評価した.
方法 SARS-CoV-2感染が確認された被収容者のうち、同意を得ている者は、10日間連続で毎日、中頸部の鼻腔検体を提供し、質問票で症状データを報告した。これらの鼻腔検体を用いて,リアルタイム逆転写ポリメラーゼ連鎖反応(RT-PCR),ウイルス全ゲノム配列決定,およびウイルス培養を行った.RT-PCRおよびウイルス培養が陽性であった期間は、生存率分析を用いて評価した。
結果 95人の参加者から合計978個の検体が提供され,そのうち78人(82%)が完全にワクチンを接種しており,17人(18%)が完全にワクチンを接種していなかった。完全接種者のRT-PCR陽性期間(中央値:13日)と非接種者のRT-PCR陽性期間(中央値:13日,p=0.50),および培養陽性期間(中央値:5日,5日,p=0.29)には,有意な差は認められなかった。完全にワクチンを接種した人では、培養陽性期間は、モデナ社のワクチン接種者の方が、ファイザー社(p=0.048)およびヤンセン社(p=0.003)のワクチン接種者よりも短かった。
結論 この分野が発展していく中で、臨床医や公衆衛生担当者は、ワクチンを接種した人がSARS-CoV-2に感染しても、ワクチンを接種していない人に比べて感染力が劣ることはないと考えるべきである。これらの知見は、特にウイルス感染が大規模なアウトブレイクにつながる可能性のある集会施設においては、決定的に重要である。
はじめに
COVID-19ワクチンは、SARS-CoV-2(COVID-19の原因ウイルス)による重症化や死亡を防ぐのに非常に有効である。しかし、COVID-19ワクチンの感染予防効果は100%ではないため、ワクチンを接種した人の中にも感染者が出ることが予想される。世界的なワクチン接種率の上昇に伴い、ワクチン接種者が感染に果たす役割は、パンデミックの将来の軌道を決定する重要な要素となるだろう1。ワクチン接種者が感染した場合に、B.1.617.2(Delta)変異体を含むSARS-CoV-2の感染にどの程度貢献するかは、まだよくわかっていない。ワクチン接種の有無にかかわらず、同等の感染力を示す指標が報告されているプレプリント原稿もあれば2、ワクチン接種者から分離されたウイルスの生存率が低下しているという報告もある3。
4-6 これらの知見は、SARS-CoV-2が急速に伝播する可能性があり、重篤なCOVID-19に関連する基礎的な健康状態の有病率が高いことから、矯正施設や拘置所、長期介護施設などの集団生活環境では特に懸念されます7-9。
最近、テキサス州の連邦刑務所で発生したデルタウイルスの集団感染では、感染した2つの収容施設での累積感染率は74%で、ワクチン未接種者とワクチン接種者ではそれぞれ93%と70%でした6。本報告書では,この集団発生時に感染した収監者の一部から採取した正中鼻腔検体を用いて,ワクチンを完全に接種した人とそうでない人の間での感染の可能性を示す代理指標として,逆転写ポリメラーゼ連鎖反応(RT-PCR)とウイルス培養の特性を経時的に評価している.本報告は、ワクチン接種者のDelta型感染者からのウイルス排出に関する初の縦断的調査の一つであり、様々な環境下での感染予防と制御手順を導くエビデンスベースに貢献するものである。
メソッド
治験の設定
2021年7月12日、テキサス州の連邦刑務所において、ワクチン接種者と未接種者の間でSARS-CoV-2の集団感染が発生した。この集団発生の調査の一環として、一部の収監者から中鼻甲介連続標本を提供してもらい、これを分析して、SARS-CoV-2の感染におけるワクチン接種者と未接種者の潜在的な役割を評価しました。この活動は、BOP Research Review BoardおよびCDCによって審査・承認され、適用される連邦法およびCDCの方針に沿って実施された。
参加者の登録と連続した検体の収集
COVID-19の症例が確認された4つの住戸に住む被収容者が、連続スワッブ検査への参加を呼びかけられた。参加者は、アウトブレイクが発生した7月12日から2021年8月4日までの間にSARS-CoV-2の検査で陽性となった人が対象となった。CDCとBOPのスタッフが説明会を開催し、プロジェクトの目的を説明するとともに、プライバシー保護や研究結果の参加者への提供方法などの質問に答えました。参加希望者は全員、英語とスペイン語で作成されたインフォームド・コンセント・フォームに署名した。
検体の採取は、2021年7月18日から8月9日の間に行われた。CDCとBOPのスタッフは、陽性反応が出た参加者から、7月19日から10日間連続して、毎日鼻腔内中隔膜の検体を1つずつ採取し、7月19日以降に確認された症例については、参加者の最初の陽性反応が出た日から採取した。症例が確認された住宅に住むすべての収監者は、検疫措置がとられました。症例の発見を支援するために、隔離された同意者は、7月19日または隔離された最初の丸1日から1日おきに検査を受け、隔離中に陽性となった人は、連続した10日間の検体採取に参加するよう招待されました。すべての参加者は、ウイルス排出に関する追加データを提供するために、8月6日に検体を提出するよう求められましたが、これはほとんどの参加者の感染後期の時点に相当します(図1)。
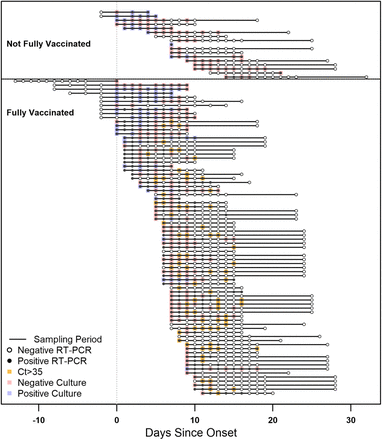
図 1.
2021年7月12日~8月9日にテキサス州の連邦刑務所で行われた、登録参加者から採取した鼻中隔標本のタイムラインと結果
95名の登録参加者の検体採取と検査結果のタイムラインを、発症日を指標にして図式化した。発症日は、a)COVID-19の症例定義に合致する自己申告の症状が初めて発現した日、またはb)SARS-CoV-2診断薬が初めて陽性となった日のいずれか早い方とした。各参加者は、病気のタイムコースにおける調査サンプリング期間に対応する水平線で表されている。完全なワクチン接種を受けていない参加者(COVID-19ワクチン2回シリーズの1回目のみを接種した2名を含む)は図の上部に、完全なワクチン接種を受けた参加者は下部に描かれている。RT-PCRの結果は、実線の円(陽性結果)または開いた円(陰性結果)で表されている。RT-PCR結果が陽性で,ウイルス培養が行われた検体については,培養結果を青枠(培養陽性)または赤枠(培養陰性)で重ねて示した。RT-PCRが陽性でCt値が35以上の検体でウイルス培養が行われなかったものは、オレンジ色のボックスを重ねて表示した(ウイルス培養結果が推定陰性であることを示す)。参加者の中には、隔離中に症例検索テストで検体を提供した人もおり、発症前にRT-PCR陰性の検体を採取していた可能性がある。
検体採取の10日目に、参加者に紙ベースの質問票を記入してもらい、病気の経過中にCOVID-19に似た症状があったことを報告してもらいました(症状の発症日と症状の持続時間を含む)。人口統計学的特性、COVID-19ワクチン接種歴、過去のSARS-CoV-2診断検査陽性歴、基礎疾患に関する情報は、参加者全員のBOP電子医療記録から抽出した。
検査方法
検体は、ナイロン製のミニチップスワブで採取し、ユニバーサル・ウイルス・トランスポート・メディア(VTM)(Becton Dickinson, Franklin Lakes, NJ)に移して2~8℃で直ちに保存し、72時間以内に-20℃以下で凍結させた後、CDCに送付し、CDCインフルエンザSARS-CoV-2マルチプレックスアッセイを用いてRT-PCR検査を行った。残りのアリコートは、ウイルス培養のために-70℃以下で保存した。処理能力に限界があるため、ウイルス培養は採取した検体の一部に対して行われた。発症後0日、3日、5日、7日、9日目に採取された検体で、サイクル閾値(Ct)値が35未満のRT-PCR検査が陽性であったものをウイルス培養の対象とした。培養可能なウイルスを含む検体を除外しないことを確認するために、102検体のうちCt>35の25検体についてウイルス培養を行った。(また、感染のタイムコースをより詳細に把握するために、他の日に採取した検体の一部についてもウイルス培養を行った(ウイルス培養の対象となった検体の詳細については補足図1-2を参照)。
TMPRSS2を発現させたVero CCL-81細胞を限界希釈法で接種し,細胞障害性を示す培養液をRT-PCRでSARS-CoV-2 RNAの存在を確認した.全ゲノム配列決定(WGS)は、参加者1名につきRT-PCR陽性でCtが30未満の検体1名に対して実施した(配列決定機関の標準プロトコルによる)。
統計的手法
発症(以下の縦断的分析では0時点とする)は、a)COVID-19の症例定義に合致する自己申告の症状が最初に発症した日11、またはb)SARS-CoV-2診断薬が最初に陽性となった日、のいずれか早い方とした。症状のない参加者が最初に陽性反応を示した後、少なくとも3回の陰性反応を経て、その後に陽性反応を示した2つの例では、2回目の陽性反応の日付を使用した。
参加者は、アウトブレイク開始前にCOVID-19一次ワクチンシリーズの推奨用量をすべて完了してから14日以上経過していれば、完全にワクチンを接種したとみなされた。(アウトブレイクの14日未満に一次ワクチンシリーズを完了した参加者はいなかった。)ワクチンを1回も接種していない場合、または一連のワクチンの全接種を完了していない場合は、完全なワクチン接種を受けていないとみなされた。ワクチン接種状況によって層別された参加者の人口統計学的特性は,フィッシャーの正確検定を用いて評価した.
感染の可能性を評価するための3つの代替マーカーを主要アウトカムとして分析した。RT-PCR陽性(現在/最近の感染の指標)、RT-PCR Ct値(ウイルス核酸の相対的なレベルの半定量的指標)、ウイルス培養陽性(生存/感染可能なウイルスの指標)。検査結果の二分法(RT-PCR陽性、ウイルス培養陽性)は、発症日を0時とし、主要評価項目を参加者の最後の陽性反応で定義し、縦断的に分析した。ウイルス培養が行われなかった検体は、付随するRT-PCR検査が陰性またはCt>35で陽性の場合、培養陰性と推定された。発症から登録までの期間にばらつきがあることや,検体採取に断続的に参加している参加者がいること(間隔打ち切りや右打ち切りになる可能性がある)を考慮して,Rの「interval」パッケージ実装によるTurnbull推定を用いて生存分析を行った12. 生存関数の仮説検定は,間隔打ち切りデータに対して一般化Wilcoxon-Mann-Whitney法を用いて行った.
ワクチン接種の有無と既知の SARS-CoV-2 感染歴との間の相互作用の可能性についての事後評価として,フィッシャーの正確検定を用いた層別分析を行い,ウイルス培養が完全に行われた日(発症から 0,3,5,7,9 日目)に採取された検体の RT-PCR とウイルス培養の結果をこれら 2 つの変数で比較した.
二分法ではない検査結果(RT-PCRのCt値)は、中央値と四分位範囲(IQR)を用いて発症からの日数で特徴づけた。RT-PCRのCt値はセミパラメトリックであるため、同値のMann-Whitney U検定(二分法変数の場合)またはKruskal-Wallis検定(2水準以上のカテゴリー変数の場合)を用いてノンパラメトリックに分布を比較し、RT-PCRの陰性結果は、RT-PCRの陽性結果のCt値よりも高いランクを割り当てた。日をまたいだ複数の仮説検定を考慮して、Bonferroni補正を用いてα閾値を調整した。実施したすべての仮説検定の詳細は,補足表1および2に示した。すべての統計解析は,R version 4.0.2 (R Core Team, Vienna, Austria)を用いて行った.
結果
集団の特徴
登録可能なSARS-CoV-2感染者189名のうち、96名が連続した検体採取に同意した。1名は診断テストが1回だけ陽性(Ct=36.2)で、その後7回の診断テストが陰性であったが、症状を訴えなかったため、非症例として除外した。対象となった95人のうち、78人(82%)はSARS-CoV-2に対する完全なワクチン接種を受けていると記録され、15人(16%)はワクチン未接種、2人(2%)は部分的にワクチン接種を受けており、以降の分析では完全なワクチン接種を受けていないと分類された(表1)。完全接種者のうち,大多数(57/78,73%)がファイザー社製ワクチンを接種しており,Moderna社製ワクチン(14/78,18%)やJanssen社製ワクチン(7/78,9%)を接種した者はそれよりも少なかった.完全にワクチンを接種した参加者の過半数(47/78、60%)が、流行開始の120日以上前に一連のワクチン接種を完了していた(IQR:81~140日前)。ファイザー社製ワクチンの接種者は、モデナ社製ワクチン(IQR:開始前81~82日)やヤンセン社製ワクチン(IQR:開始前46~70日)の接種者よりも早く(IQR:131~131日)、一連の接種を完了していました(p<0.001)。少数の被験者(完全にワクチンを接種した2/78人、3%、完全にワクチンを接種しなかった2/17人、12%、p=0.10)に、SARS-CoV-2の感染歴が記録されていた。サンプリング終了時の症状の自己申告に基づき、参加者の76%がCOVID-19の症例定義[CSTE 2021]にある症状を少なくとも1つ報告していました。最も多く報告された症状は、鼻水または鼻づまり(58%)、嗅覚または味覚の喪失(54%)、および咳(45%)であった。配列決定が試みられた95人の検体のうち、64人が配列決定に成功し、品質評価基準に合格しました。64人全員(100%)がB.1.617.2(Delta)系統およびAY.3サブ系統に属していました。
インラインで見る
表1.
SARS-CoV-2陽性と判定された登録者の特徴(テキサス州連邦刑務所、2021年7月12日~8月9日
RT-PCR陽性率
対象となった95人の参加者から、RT-PCR検査のために978個の検体が採取された(825/978、84%が完全にワクチンを接種した参加者)。検体が採取された期間は、発症の13日前(診断前の検疫期間中に検査を受けた参加者)から発症の32日後までであった。参加者からRT-PCR検体を採取した様子を図1に示し、発症からの日数ごとの検体採取の詳細を補足図1に示した(ワクチン接種の有無で層別)。完全にワクチンを接種した参加者では、発症から登録までの期間は中央値で6日であったのに対し、完全にワクチンを接種していない参加者では中央値で7日であった(p=0.33)。全体では,978 個の検体のうち 499 個(51%)が RT-PCR で陽性と判定された.
最後にRT-PCRで陽性と判定されるまでの期間に、有意な差は認められなかった。RT-PCR陽性期間の中央値は,完全にワクチンを接種した参加者では13日,完全にワクチンを接種していない参加者では13日であった(p=0.50,図2).また,SARS-CoV-2の既往歴がある参加者(ワクチン接種の有無にかかわらず)では10日,既往歴のない参加者では13日であった(p=0.12).完全にワクチンを接種した参加者では,陽性期間の中央値は,Moderna社のワクチン接種者では10日であったのに対し,Pfizer社のワクチン接種者では13日,Janssen社のワクチン接種者では13日であった(p=0.39).また,発生の120日以上前に完全にワクチンを接種した参加者では13日であったのに対し,発生の120日以下にワクチンを接種した参加者では11日であった(p=0.32).

図2.
登録された参加者のSARS-CoV-2 RT-PCR検査陽性生存曲線(テキサス州連邦刑務所、2021年7月12日~8月9日
パネルは、逆転写ポリメラーゼ連鎖反応(RT-PCR)検査の最終陽性結果を主要評価項目とするTurnbull推定生存関数の結果を示している。実線はノンパラメトリックな最尤推定値を示し、斜線部分は修正ブートストラップにより推定された95%信頼区間に対応する。生存関数はTurnbull区間の中間点でプロットした。発症は,a)COVID-19の症例定義に合致する自己申告の症状が最初に発現した日,またはb)SARS-CoV-2診断薬が最初に陽性となった日,のいずれか早い方とした.パネルAは、RT-PCR陽性率をワクチン接種状況別に表している(完全にはワクチンを接種していない参加者には、COVID-19ワクチン2回シリーズの1回目のみを接種した参加者2名を含む)。パネルBは、完全にワクチンを接種した参加者におけるワクチン製品別の陽性率を示している。パネルCは、COVID-19ワクチン/シリーズの接種完了から発症までの期間に応じた陽性率を示している。パネルDは、SARS-CoV-2の既往歴に応じた陽性率を示している。
Ct値
RT-PCR法で陽性と判定された検体のCt値は,発症からの日数が長くなるにつれて上昇した(図3).完全にワクチンを接種した参加者のCt値は、発症当日の中央値26.4(IQR:23.5-28.4)から10日目の中央値32.9(IQR:30.5-34.6)まで上昇した。一方、完全にワクチンを接種していない参加者のCt値は、発症当日の中央値28.5(IQR:24.8-31.8)から10日目の中央値34.5(IQR:29.4-35.2)まで上昇した。感染のタイムコース全体において、ボンフェローニ補正後のいずれの日においても、ワクチン接種の有無によるCt値の統計的な有意差は認められなかった(すべてp>0.0026、ボンフェローニ補正後のα閾値)。また,ワクチン製品,接種後の時間,SARS-CoV-2感染歴の有無で層別化しても,Ct値に有意差は認められなかった。統計的には有意ではなかったが,ヤンセン社製ワクチンの接種者(3日目の中央値:17.9;IQR:17.6-19.4)は,モデナ社製(3日目の中央値:27.4;IQR:23.7-28.1)やファイザー社製(3日目の中央値:24.8;IQR:23.1-26.8;p=0.016,ボンフェローニ補正α=0.0026)に比べて,感染のタイムコースの早い段階でCt値の低下が認められた.

図 3.
SARS-CoV-2感染が確認された登録者のRT-PCRサイクル閾値の分布(テキサス州連邦刑務所、2021年7月12日~8月9日
パネルには、RT-PCR結果が陽性の検体のうち、逆転写ポリメラーゼ連鎖反応(RT-PCR)サイクル閾値(Ct)値の日ごとの中央値と四分位範囲(IQR)が示されている。実線はCt値の中央値、陰影のある部分はIQRを示す。各パネル上部の割合は、RT-PCRが陰性だった検体の割合を示している。発症は、a)COVID-19の症例定義に合致する自己申告の症状が最初に発症した日、またはb)診断用SARS-CoV-2検査が最初に陽性となった日、のいずれか早い方とした。パネルAは、RT-PCR陽性率をワクチン接種状況別に表している(完全にはワクチンを接種していない参加者には、COVID-19ワクチン2回シリーズの1回目のみを接種した参加者2名を含む)。パネルBは、完全にワクチンを接種した参加者におけるワクチン製品別の陽性率を示している。パネルCは、COVID-19ワクチン/シリーズを完了してから発症するまでの期間に応じた陽性率を示している。パネルDは、SARS-CoV-2の既往歴に応じた陽性率を示している。
ウイルス培養陽性率
採取された978検体のうち、286検体(29%)に対してウイルス培養が行われた。さらに556検体(57%)は、RT-PCR検査が陰性であった(n=479)、またはRT-PCR検査が陽性でCt値が35以上であった(n=77)ことから、ウイルス培養結果が推定陰性とされた。ワクチン接種の有無で層別された発症からの日数別のウイルス培養捕捉率を補足図2に詳細に示した。ウイルス培養結果が得られた842検体のうち、75検体(9%)がウイルス培養陽性であった。完全にワクチンを接種した参加者の検体では57/690(8%)からウイルスが回収されたのに対し、完全にワクチンを接種していない参加者の検体では18/152(12%)から回収された(p=0.16)。
ウイルス培養結果(図4)の陽性期間については、完全接種者(中央値:5日)と非接種者(中央値:5日、p=0.29)では、統計的に有意な差は認められませんでした。(ウィルス培養の結果は、発症からの日数の関数として図示され、RT-PCRの結果によってグループ化されている(補足図4)。累積ハザード関数は、Modernaワクチンを接種した完全接種者の培養陽性期間は、Pfizerワクチン(p=0.048)またはJanssenワクチン(p=0.003)を接種した者よりも全体的に短いことを示していますが、PfizerワクチンとJanssenワクチンの接種者の間には有意な差はありませんでした(p=0.12)。ワクチン接種後の期間(p=0.79)や既知の過去の感染(p=0.99)によって層別化しても、培養陽性の期間には統計的に有意な差は認められなかった。

図4.
登録された参加者のSARS-CoV-2ウイルス培養検査陽性生存曲線(テキサス州連邦刑務所、2021年7月12日~8月9日
パネルは、最後のウイルス培養検査陽性結果を主要評価項目としたTurnbull推定生存関数の結果を示している。培養は行われなかったが、RT-PCR結果が陰性、またはCt>35のRT-PCR結果が陽性であった場合、検体は推定陰性結果として含まれる。実線はノンパラメトリックな最尤推定値を示し,斜線部分は修正ブートストラップ法で推定した95%信頼区間に対応する.生存関数はTurnbull区間の中間点でプロットした。ターンブル区間が正の無限大で囲まれている場合(サブグループでの右打ち切りの結果)、生存関数は右端の非無限大の区間で開いた点で切り捨てられている。発症は、a)COVID-19の症例定義に合致する自己申告の症状が最初に発症した日、またはb)SARS-CoV-2診断薬が最初に陽性となった日、のいずれか早い方とした。パネルAは、RT-PCR陽性率をワクチン接種状況別に表している(完全にはワクチンを接種していない参加者には、COVID-19ワクチン2回シリーズの1回目のみを接種した参加者2名を含む)。パネルBは、完全にワクチンを接種した参加者におけるワクチン製品別の陽性率を示している。パネルCは、COVID-19ワクチン/シリーズの接種完了から発症までの期間に応じた陽性率を示している。パネルDは,SARS-CoV-2感染の既往歴に応じた陽性率を示している。
要因による層別化。ワクチン接種の有無と過去の感染歴
図5は、RT-PCRとウイルス培養の結果を、ワクチン接種の有無とSARS-CoV-2の過去の感染歴によって事後的に層別化したものである。RT-PCRおよびウイルス培養の陽性率には、いずれの日も統計的に有意な差は認められなかった。しかし、二分法による層別化を行った結果、一部のグループでは母集団の大きさが小さく(完全にワクチンを接種しているが既知の過去の感染歴がある者と、完全にワクチンを接種していないが既知の過去の感染歴がある者とで、それぞれn=2)、これらのグループに関する結論を導き出すことは困難であると考えられる。

図5.
SARS-CoV-2のRT-PCR検査の陽性率(A)とウイルス培養検査の陽性率(B)を、ワクチン接種の有無と既往感染の有無で層別化した登録参加者の例(2021年7月12日~8月9日、テキサス州の連邦刑務所
パネルは、RT-PCR検査結果(パネルA)またはウイルス培養検査結果(パネルB)が陽性であった検体の割合を、ワクチン接種の有無とSARS-CoV-2の既往感染の有無の両方で層別して示している。実線のバーは、過去の感染歴がない参加者の結果を示し、ストライプのバーは、過去の感染歴が記録されている参加者の結果を示す。培養を行わず、RT-PCR結果が陰性、またはRT-PCR結果が陽性でCt>35であった検体は、推定陰性とした。発症は,a)COVID-19の症例定義に合致する自己申告の症状が最初に発現した日,またはb)SARS-CoV-2診断薬が最初に陽性となった日,のいずれか早い方とした。結果は、発症から0日目、3日目、5日目、7日目、9日目についてのみ記載されており、これは対象となる検体の100%がウイルス培養を行った日を表している。棒グラフは、各日に各グループの参加者から採取した検体の数を示す。P値は各日ごとのグループの上部に記載されており、4つのグループ間の比率に対するフィッシャーの正確検定に対応している。
考察
刑務所内で発生したSARS-CoV-2デルタウイルスの大規模感染では、ワクチン接種者と非接種者との間で、RT-PCR陽性期間、Ct値、ウイルス培養陽性期間の違いは認められなかった。しかし、Modernaのワクチンを接種した人は、PfizerやJanssenのワクチンを接種した人に比べて、培養陽性期間が短かった。(しかし、Modernaワクチンを接種した人は、Pfizerワクチンを接種した人よりも、より最近にワクチンを接種した人であった。)これらの結果を総合すると、この発展途上の分野で証拠が続々と出てきているので、ワクチンを接種した人が感染しても、公衆衛生活動の目的上、ワクチンを接種していない人に比べて感染力が著しく低いわけではないと考えるべきであることを示唆している。
ワクチン接種者のウイルス感染は、最初のワクチン接種後に防御的な免疫反応が得られなかった場合や、最初はしっかりとした防御が得られた後に免疫的な防御が徐々に弱まった場合のいずれかに起因する可能性があるため、ワクチン接種者の感染力は変動する可能性があります。今回の調査では、ワクチンを接種したにもかかわらず感染した参加者の中には、ワクチンによる保護作用が弱い、または弱まっている人がいたため、評価した感染可能性のマーカーにおいて、ワクチンを接種していない人と同様の結果になったという可能性があります。
本報告は、ワクチン接種者におけるSARS-CoV-2感染の感染可能性を評価した限られた科学的文献に追加するものである。ワクチン接種者の感染についての報告は、感染可能性のマーカーを用いて様々な結果が得られており、デルタ感染したワクチン接種者のウイルス培養特性に関する縦断的な研究は発表されていない。アルファ(B.1.1.7)とガンマ(P.1)の感染を対象とした複数施設での連続試験の調査では、ワクチン接種者はワクチン未接種者に比べて培養陽性の期間が短いことが分かっています13, 14。サーベイランスデータを用いた1つの報告では、ワクチン未接種者の方がCt値が低いことが分かっていますが、この差は3つのRT-PCRプローブのうち2つでしか観察されず、また3ヶ月のうち1ヶ月でしか観察されませんでした15。しかし、クロスセクショナルデータやサーベイランスデータから外挿するには、感染過程における検体採取のタイミングを考慮したデータがないと難しいかもしれません。しかし、この知見は、ワクチン接種がCt値に影響を与えず、α型ウイルスの回収率を低下させたが、Δ型ウイルスの回収率は低下させなかったという臨床的なコンビニエンスサンプルの分析結果からも裏付けられています16。また、同様の知見は、2つのレトロスペクティブなヘルスシステムコホートでも示されています17, 18。19 デルタ感染症の家庭内感染に関する研究では、ワクチン接種の有無にかかわらず、ウイルス量のピーク値は同程度であったが、ワクチン接種者の方がウイルス量の減少が早いことがわかった20。今回の報告は、ワクチン接種者のデルタ型感染者のウイルス培養特性を縦断的に調査した初めての報告であり、ワクチン接種者がSARS-CoV-2の感染に寄与する可能性があることを示している。
今回の調査では、ワクチン接種者からの感染の可能性が減少したという証拠は得られませんでしたが、ワクチン接種は感染のリスクを減少させることが知られており6, 21、それによって二次感染を防ぐことができます。また,ワクチン接種は,SARS-CoV-2による罹患率と死亡率に対する強力な防御因子である22。感染,罹患,死亡を防ぐためには,ワクチン接種率を最大限に高めることが重要であり,特に,感染が発生した場合に物理的な距離を置くことが困難な環境では,迅速かつ広範な感染が発生する可能性があることを示している。
ワクチン接種を受けた人がSARS-CoV-2を他人に感染させる可能性があるという証拠から、ワクチン接種率が高い場合でも、人が集まる環境にウイルスが持ち込まれた場合には、大規模な感染症が発生する危険性があると考えられます。特に、投獄されている人々は急速に感染する可能性があり、基礎的な健康状態の有病率が高いことから、7, 8 矯正施設で生活または仕事をしている人は、ワクチン接種の有無にかかわらず、SARS-CoV-2に暴露した後は隔離する必要があります。曝露後の隔離は、感染のリスクが高い場合(例えば、寮形式の住居で、職員や被収容者が住居を越えて頻繁に交流する場合)や、COVID-19による重篤な転帰のリスクが高い人々がいる場合に特に重要です。施設では、可能な限り屋内でのマスキングを徹底し、推奨される消毒、清掃、換気を継続し、定期的な検査ベースのスクリーニングプログラムを維持することで、検疫の必要性を最小限に抑えることができます。これにより、患者を早期に発見し、他の人への曝露を制限するためのタイムリーな処置(隔離を含む)を行うことができます。検査ベースの定期的なスクリーニングを実施している施設では、ワクチン接種を受けた人を引き続きフレームに含めるべきです。
本報告書にはいくつかの制限があります。完全にワクチンを接種していない参加者の割合が少なかったため(19%)、ワクチン接種の有無による統計的比較が十分にできず、今回報告された否定的な結果は慎重に解釈する必要がある。このグループのサンプルサイズを大きくするために、部分的にワクチンを接種した2人の参加者を加えたが、これはワクチン未接種の参加者の特徴を薄めてしまう可能性がある。しかし,この2名を除いて解析を行っても,結論は変わらなかった。同様に、既知の過去の感染があったのは4人だけで、そのうち完全にワクチンを接種していない参加者の割合が高かったため、これらの参加者は過去の感染がない参加者に比べて免疫学的な保護がわずかに高いように見えるかもしれません。平均して、ワクチン未接種者はワクチン接種者に比べて発生時期が早く、感染経過が遅かった。この集団では間隔打ち切りの可能性を考慮して、生存分析にターンブル推定を用いた。症状に関するデータはすべて自己申告で、検体採取期間の最後に採取されたため、症状の発症日に関する参加者の記憶の正確さに影響を与えている可能性がある。Ct値は、ウイルスRNA量の半定量的な指標であり、ウイルス量や感染力の定量的な指標として解釈することはできません。今回の調査では、Ct値から定量的な結論を導くことを避けるために、ノンパラメトリック順位統計(Mann-WhitneyおよびKruskal-Wallis)とボンフェローニ補正を保守的に用いた。SARS-CoV-2の過去の感染に関する情報は医療記録から得た。初期の感染者が診断されていなかったり、投獄前に診断されていてもBOPの医療システムに記録されていなかったりした場合は、正しい特徴が得られていない可能性がある。最後に、Ct>35の561検体については、ウイルス培養を行わず、推定陰性とした。この判断は、今回の調査でウイルス培養を実施したCt>35の検体25/25がウイルス培養陰性であったことと、RT-PCR陰性の検体から生菌を回収できないことを示す既報の結果に基づいている23。
今回の調査では、ワクチン接種者と非接種者との間で、感染可能性に統計的に有意な差は認められませんでした。したがって、今回の調査結果は、リスクの高い環境にいる人や重大な曝露を受けた人に対しては、ワクチン接種の有無にかかわらず、予防と緩和策を適用すべきであることを示している。人が集まる環境、特に矯正施設や拘置所では、推奨される他の予防措置に加えて、感染者が確認された場合に感染を制限するための曝露後検査と検疫が引き続き重要な手段となります24。今後、ワクチン接種を受けた感染者からの感染の可能性について、実験室ベースのマーカーや二次攻撃率、ネットワーク分析による感染の証拠を取り入れた研究を行うことで、パンデミックの進展や新たな亜種の出現に伴う感染の連鎖におけるワクチン接種を受けた人の貢献度をより明確にすることができるかもしれません。
データ提供
今回の分析で使用した非識別化データは、合理的な要求があれば、著者に提供することができます。
利害の衝突に関する声明
著者には報告すべき利益相反はない。すべての著者は,ICMJE利益相反宣言を完了している。
脚注
謝辞
Mario Cordova, Torrey Haskins, Jennifer Jackson, Joshua Jett, Barbara Swopes, Tammy Winbush, Federal Bureau of Prisons.
脚注
免責事項本報告書に記載された知見および結論は、著者個人のものであり、必ずしも米国疾病対策センター(CDC)の公式見解を示すものではありません。
↵* 45 C.F.R. part 46, 21 C.F.R. part 56; 42 U.S.C. Sect.241(d); 5 U.S.C. Sect.552a; 44 U.S.C. Sect. 3501 et seq.3501 et seq.
参考文献
1.↵Mancuso M, Eikenberry SE, Gumel AB.ワクチン由来の防御免疫は米国におけるCOVID-19亜種を抑制するか?Infect Dis Model.2021; 6: 1110-34. doi:10.1016/j.idm.2021.08.008.CrossRefGoogle Scholar
2.↵Riemersma KK, Grogan BE, Kita-Yarbro A, Halfmann PJ, Segaloff HE, Kocharian A, et al. Shedding of Infectious SARS-CoV-2 Despite Vaccination. medRxiv. 2021: 2021.07.31.21261387. doi:10.1101/2021.07.31.21261387.Abstract/FREE Full TextGoogle Scholar
3.↵Shamier MC, Tostmann A, Bogers S, de Wilde J, IJpelaar J, van der Kleij WA, et al.Virological Characteristics of SARS-CoV-2 vaccine breakthrough infections in health care workers.medRxiv.2021: 2021.08.20.21262158.doi:10.1101/2021.08.20.21262158.Abstract/FREE Full TextGoogle Scholar
↵ブラウンCM、ボストークJ、ジョンソンH、バーンズM、ガーピュアーR、サミS、他。 大規模な公共の集まりに関連したCOVID-19ワクチンによる画期的な感染を含むSARS-CoV-2感染症の発生-マサチューセッツ州バーンズタブル郡、2021年7月。MMWR Morb Mortal Wkly Rep. 2021; 70(31): 1059-62. doi:10.15585/mmwr.mm7031e2.CrossRefPubMedGoogle Scholar
5.Centers for Disease Control and Prevention.COVID Data Tracker.ジョージア州アトランタ。US Department of Health and Human Services.Accessed October 16, 2021.[Available from: https://covid.cdc.gov/covid-data-tracker/#trends_dailycases.Google Scholar
6.↵Hagan LM, McCormick DW, Lee C, Sleweon S, Nicolae L, Dixon T, et al. Outbreak of SARS-CoV-2 B.1.617.2 (Delta) Variant Infections Among Incarcerated Persons in a Federal Prison - Texas, July-August 2021.MMWR Morb Mortal Wkly Rep. 2021; 70(38): 1349-54. doi:10.15585/mmwr.mm7038e3.CrossRefPubMedGoogle Scholar
7.↵Hagan LM, Williams SP, Spaulding AC, Toblin RL, Figlenski J, Ocampo J, et al.16の刑務所と拘置所におけるSARS-CoV-2の集団検査-6つの管轄区域、米国、2020年4月から5月。MMWR Morb Mortal Wkly Rep. 2020; 69(33): 1139-43. doi:10.15585/mmwr.mm6933a3.CrossRefGoogle Scholar
8.↵Maruschak L, Bronson J, Alper M. Medical problems reported by prisoners, survey of prison inmates, 2016.ワシントン、DC。US Department of Justice, Bureau of Justice Statistics(米国司法省司法統計局)。2021.Available from: https://bjs.ojp.gov/sites/g/files/xyckuh236/files/media/document/mprpspi16st.pdf.Google Scholar
9.↵McMichael TM, Clark S, Pogosjans S, Kay M, Lewis J, Baer A, et al.長期療養施設におけるCOVID-19-ワシントン州キング郡、2020年2月27日~3月9日。MMWR Morb Mortal Wkly Rep. 2020; 69(12): 339-42. doi:10.15585/mmwr.mm6912e1.CrossRefPubMedGoogle Scholar
10.↵Harcourt J, Tamin A, Lu X, Kamili S, Sakthivel SK, Murray J, et al.米国のコロナウイルス病患者からの重症急性呼吸器症候群コロナウイルス2。Emerg Infect Dis.2020; 26(6): 1266-73. doi:10.3201/eid2606.200516.CrossRefubMedGoogle Scholar
11.↵Council of State and Territorial Epidemiologists.2019年新型コロナウイルス感染症(COVID-19)の標準化されたサーベイランス症例定義および国家通知の更新。Accessed October 15, 2021.[Available from: https://cdn.ymaws.com/www.cste.org/resource/resmgr/21-ID-01_COVID-19_updated_Au.pdf.Google Scholar
12.↵Fay MP, Shaw PA.インターバル打ち切りデータに対する正確かつ漸近的な重み付きログランク検定。インターバルRパッケージ.J Stat Softw.2010; 36(2). doi:10.18637/jss.v036.i02.CrossRefPubMedGoogle Scholar
↵Ke R, Martinez PP, Smith RL, Gibson LL, Achenbach CJ, McFall S, et al.Longitudinal analysis of SARS-CoV-2 vaccine breakthrough infections reveal limited infectious virus shedding and restricted tissue distribution. medRxiv. 2021. doi:10.1101/2021.08.30.21262701.Abstract/FREE Full TextGoogle Scholar
14.↵Ke R, Martinez PP, Smith RL, Gibson LL, Mirza A, Conte M, et al.Daily sampling of early SARS-CoV-2 infection reveals substantial heterogeneity in infectiousness. medRxiv. 2021. doi:10.1101/2021.07.12.21260208.Abstract/FREE Full TextGoogle Scholar
↵Griffin JB, Haddix M, Danza P, Fisher R, Koo TH, Traub E, et al. 16歳以上の人におけるSARS-CoV-2感染と入院、ワクチン接種状況別-カリフォルニア州ロサンゼルス郡、2021年5月1日から7月25日まで。2021; 70(34): 1170-6. doi:10.15585/mmwr.mm7034e5.CrossRefGoogle Scholar
16.↵Luo CH, Morris CP, Sachithanandham J, Amadi A, Gaston D, Li M, et al. Infection with the SARS-CoV-2 Delta Variant is Associated with Higher Infectious Virus Loads Compared to the Alpha Variant in both Unvaccinated and Vaccinated Individuals. medRxiv.
17.↵Christensen PA, Olsen RJ, Long SW, Subedi S, Davis JJ, Hodjat P, et al.Delta variants of SARS-CoV-2 cause significantly increased vaccine breakthrough COVID-19 cases in Houston, Texas. medRxiv. 2021: 2021.07.19.21260808. doi:10.1101/2021.07.19.21260808.Abstract/FREE Full TextGoogle Scholar
18.↵Eyre DW, Taylor D, Purver M, Chapman D, Fowler T, Pouwels KB, et al.SARS-CoV-2ワクチン接種がα・δ変種感染に与える影響。
19.↵Chia PY, Xiang Ong SW, Chiew CJ, Ang LW, Chavatte J-M, Mak T-M, et al. SARS-CoV-2 Delta variant ワクチンによるブレークスルー感染のウイルス学的および血清学的動態:多施設コホート研究. medRxiv. 2021: 2021.07.28.21261295.
20.↵Singanayagam A, Hakki S, Dunning J, Madon KJ, Crone M, Koycheva A, et al.ワクチンを接種した人としていない人におけるSARS-CoV-2 Delta (B.1.617.2) variantの地域伝播とウイルス量の動態。Preprint Available at SSRN: https://ssrncom/abstract=3918287 or http://dxdoiorg/102139/ssrn3918287.2021.Google Scholar
↵Pouwels KB, Pritchard E, Matthews PC, Stoesser N, Eyre DW, Vihta KD, et al.イギリスにおける Delta 変異体のウイルス負荷と SARS-CoV-2 の新規感染に対するワクチン効果に対する影響。Nat Med.2021. doi:10.1038/s41591-021-01548-7.CrossRefGoogle Scholar
22.↵Tenforde MW, Patel MM, Ginde AA, Douin DJ, Talbot HK, Casey JD, et al.Effectiveness of SARS-CoV-2 mRNA Vaccines for Preventing Covid-19 Hospitalizations in the United States.Clin Infect Dis.2021. doi:10.1093/cid/ciab687.CrossRefGoogle Scholar
23.↵Ford L, Lee C, Pray IW, Cole D, Bigouette JP, Abedi GR, et al. 大学で行われたSevere Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) 抗原ベースのテスト結果、リアルタイム逆転写ポリメラーゼ連鎖反応(rRT-PCR)サイクル閾値、サブゲノムRNA、およびウイルス培養結果に関連する疫学的特徴。Clin Infect Dis.2021; 73(6): e1348-e55. doi:10.1093/cid/ciab303.CrossRefGoogle Scholar
24.↵Centers for Disease Control and Prevention.矯正・拘禁施設におけるコロナウイルス感染症2019(COVID-19)の管理に関する暫定ガイダンス。ジョージア州アトランタ。US Department of Health and Human Services.Accessed October 29, 2021.[Available from: https://www.cdc.gov/coronavirus/2019-ncov/community/correction-detention/guidance-correctional-detention.html.Google Scholar
この記事が気に入ったらサポートをしてみませんか?
