
「出したいデータ」と「出さない理由」
企業は、自社商品に関する有益なデータ、そうではないデータも含めて、多様なデータを持っています。自社の商品を売り込むためには、その中からどのデータを使うかが重要です。もし、有益ではない、むしろマイナスになるデータを持っていたら、それを使うでしょうか?
厚生労働省発健0531第3号
厚労省のサイトに、下記の資料が公開されています。
厚生労働省発健0531第3号
令 和 3 年5月31日
「新型コロナウイルス感染症に係る予防接種の実施について(指示)」の一部改正について
今般、厚生科学審議会において、新型コロナウイルス感染症に係る予防接種の対象者について、現在は市町村(特別区を含む。以下同じ。)の区域内に居住する16歳以上の者としているところ、市町村の区域内に居住する12歳以上の者とするものとすることについて妥当との結論が得られたことから、「新型コロナウイルス感染症に係る予防接種の実施について(指示)」(令和3年2月16日付け厚生労働省発健0216第1号厚生労働大臣通知)の一部を別紙のとおり改正し、令和3年6月1日から適用する。
上記を検討する際に、何を見て「妥当」と判断したのでしょうか? 「新型コロナワクチンの接種について(ファイザー社ワクチン)」という資料がありました。
厚生労働省サイト ホーム> 政策について> 審議会・研究会等> 厚生科学審議会(予防接種・ワクチン分科会)> 第22回厚生科学審議会予防接種・ワクチン分科会 >第22回 2021年5月31日 資料
安全性については、ファイザー社が出しているデータをもとに検討したようですが、すでに国内で報告されている副反応疑いについては触れられていません。「疑い」は放置され、「これまで接種対象となっている16歳以上の者に接種した場合と同様の有効性・安全性が期待できる」と言っています。

国内の感染状況として、10代の陽性者のうち死亡者数は、「0」です。(8ページ)

「10代において、10万人当たりの陽性者は60代、70代よりも多く」と書かれています(12ページ)。問題にしているのが「陽性者」であるなら、ワクチン接種による感染予防効果は実証が難しいと、16ページにある資料(下記)に書かれていることと矛盾を感じます。ファイザー社のデータでは、発症についての有効性が報告されていて、感染しないというデータではないはずです。
※厳密にいうと、PCR陽性者=感染者ではありませんが、テレビではPCR陽性者=感染者のように扱われています。
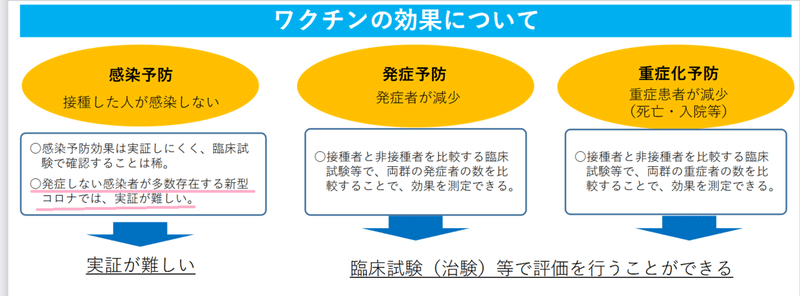
モデルナ社の件でも、同じような矛盾があります。(Vol.8参照)
ファイザー社のリリース
Pfizer-BioNTech Announce Positive Topline Results of Pivotal COVID-19 Vaccine Study in Adolescents (Wednesday, March 31, 2021 - 06:45am)
3月31日に出されたこのリリースでは、「12 ~ 15 歳の青少年を対象とした第 3 相試験で、Pfizer-BioNTech COVID-19 ワクチン BNT162b2 が 100% の有効性としっかりとした抗体反応を示した」と発表しています。 厚労省はこれと、その前に行った試験のデータをもとに検討したようです。
In participants aged 12-15 years old, BNT162b2 demonstrated 100% efficacy and robust antibody responses, exceeding those reported in trial of vaccinated 16-25 year old participants in an earlier analysis, and was well tolerated
The trial enrolled 2,260 adolescents 12 to 15 years of age in the United States. In the trial, 18 cases of COVID-19 were observed in the placebo group (n=1,129) versus none in the vaccinated group (n=1,131).
「12 歳から 15 歳までの 2,260 人の青年が参加し、プラセボ群 (n=1,129) で 18 例の COVID-19症例 が観察されたのに対し、ワクチン接種群では COVID-19症例が観察されなかった (n=1,131)」とあります。モデルナ社のリリースに書かれていたような、症例の定義は書かれていないようですが、1,129人中18人に症状が確認されたなら、症状が出たのは約1.6%ということになると思います。接種しなくても、98.4%に症状が出ていないのです。
重要な安全情報
リリースには、IMPORTANT SAFETY INFORMATION FROM U.S. FDA EMERGENCY USE AUTHORIZATION PRESCRIBING INFORMATION:(米国 FDA の緊急使用許可申請書からの重要な安全情報:)が、箇条書きで挙げられています。その中に、気になるものがありました。
・Do not administer Pfizer-BioNTech COVID-19 Vaccine to individuals with known history of a severe allergic reaction (e.g., anaphylaxis) to any component of the Pfizer-BioNTech COVID-19 Vaccine
(Pfizer-BioNTech COVID-19 ワクチンの成分に対する重度のアレルギー反応の既往歴のある個人には、Pfizer-BioNTech COVID-19 ワクチンを投与しないでください)
成分については、厚労省のサイトで下記のように書かれています。公開されいている場所はVol.9に書いてあります。
▷有効成分
・トジナメラン(ヒトの細胞膜に結合する働きを持つスパイクタンパク質の全長体をコードするmRNA
▷添加物
・ALC-0315:[(4-ヒドロキシブチル)アザンジイル]ビス(ヘキサン-6,1-ジイル)ビス(2-ヘキシルデカン酸エステル)
・ALC-0159:2-[(ポリエチレングリコール)-2000]-N,N-ジテトラデシルアセトアミド
・DSPC:1,2-ジステアロイル-sn-グリセロ-3-ホスホコリン
・コレステロール
・塩化カリウム
・リン酸二水素カリウム
・塩化ナトリウム
・リン酸水素ナトリウム二水和物
・精製白糖

使用前例のない添加物が入っているのに、「Pfizer-BioNTech COVID-19 ワクチンの成分に対する重度のアレルギー反応 (アナフィラキシーなど) の既往歴のある個人には、Pfizer-BioNTech COVID-19 ワクチンを投与しないでください」と書かれています。使用前例のないものに対して既往症というのは、とてもおかしな表現です。しかも、厚労省のサイトには、「予防接種を受けることに注意が必要な人」となっていますが、リリースには「投与しないでください」と書いてあります。これは伝言ゲームのように、表現が変わってきてしまったのでしょうか。
※黒塗りはこちらでつけたのではなく、公開されている資料がこのようになっています。
・Immunocompromised persons, including individuals receiving immunosuppressant therapy, may have a diminished immune response to the Pfizer-BioNTech COVID-19 Vaccine
(免疫抑制剤治療を受けている人を含む免疫不全の人は、 COVID-19ワクチンに対する免疫応答が低下する可能性があります)
免疫抑制の治療を受けている人は、効果よりリスクの方が高くなる可能性もあるのではないでしょうか。ベネフィットとリスクを天秤にかけるなら、これらの情報も必要だと思います。
・The Pfizer-BioNTech COVID-19 Vaccine may not protect all vaccine recipients
(Pfizer-BioNTech COVID-19 ワクチンは、すべてのワクチン接種者を守れない可能性があります)
この「protect」は、何から守るという意味なのでしょうか。この次の行に副反応が書かれているので、副反応から守れないという意味なのでしょうか。
・Available data on Pfizer-BioNTech COVID-19 Vaccine administered to pregnant women are insufficient to inform vaccine-associated risks in pregnancy (妊娠中の女性に投与されたPfizer-BioNTech COVID-19 に関する入手可能なデータでは、妊娠中のワクチン関連リスクを通知するには不十分です)
WHOと同じで「入手可能なデータ」と、わざわざ書いてあります。
・Data are not available to assess the effects of Pfizer-BioNTech COVID-19 Vaccine on the breastfed infant or on milk production/excretion (母乳で育てられた乳児、または乳汁の生産/排泄に、Pfizer-BioNTech COVID-19 ワクチンが及ぼす影響を評価するためのデータはありません)
こちらについては、「not available」と言っています。データを集めている途中なのか、入手していないのかはわかりません。
妊婦や授乳中の接種について、医師や専門家が「メカニズム的に安全と考えられる」「理論上は安全」などと書いているのをよく目にします。
ですが人間の体は、そんなに理論通りにいくものなのでしょうか? 例えば、Vol.10で取り上げた死亡報告では、ワクチン接種が精神障害の誘因になった可能性が示唆されています。ワクチン接種が強いストレスとなって、母体や胎児、母乳に影響を与える可能性はないのでしょうか?
そういった、理論上は「ないはず」のリスクについては、まだわからないので、「入手可能なデータ」「データはない」などと書いてあるように思えます。
長い長い文章の意図
リリースには「Pfizer Disclosure Notice」 として、ものすごく長い、どこで区切られているのかわからないような文章が下の方にあります。前半の「100%の有効性が示された」という部分の文章はとてもスッキリして読みやすいのに、ここは改行もなく、わざと読む気が失せるように書いているとしか思えません。もし日本語だったとしても、こんなにダラダラとつながっていたら、結局何がいいたいのか伝わらないでしょう。
The information contained in this release is as of March 31, 2021. Pfizer assumes no obligation to update forward-looking statements contained in this release as the result of new information or future events or developments.
このリリースに含まれる情報は、2021 年 3 月 31 日現在のものであり、「将来の見通しに関する記述」を更新する義務を負わない、と書かれていることは読み取れます。モデルナ社のリリースにも、似たようなことが書かれていました。
この先に、長い長い文章が続いています。読んでも読んでも、ピリオドが見つかりません。このリリースに書かれていることは、変わる可能性があると思っているから、「ちゃんと書いてありましたよ」と言うためにダラダラと書いているように思えます。
何かを契約するときに、多くの場合、小さな字で書かれた「規約」を渡されます。それに目を通したうえで、契約書にサインをします。とても小さい字なので読む気が起きませんが、サインしたということは読んだということになるのです。
ファイザー社のリリースの長文を見て、それを思い出しました。接種するときに出す予診票には、「接種の効果や副反応などについて理解した上で、接種を希望しますか」という項目があり、「接種を希望します」にチェックした人は接種することができます。使用前例のない成分が含まれたワクチンを体の中に入れるなら、どんなに長い文章でも読んでおくべきだと思います。
では、高齢者など、自力でその情報にたどり着くことができない人は、どうすればよいのでしょうか? 本来なら、国や自治体がその情報を提供し、接種するかしないかを判断できるようにサポートするべきではないでしょうか。その情報を得た上で、医師に相談して最終的な判断をするというのが、本来の流れだと思います。そこまでやっている自治体は、どれくらいあるのでしょうか。
