CDC:5~11歳におけるワクチンの安全性(?)
コメント:コレ見て「安全だね!」と
言える人の氣がしれない。
COVID-19 5~11歳児におけるワクチンの安全性-米国、2021年11月3日~12月19日
Anne M. Hause, PhD1、James Baggs, PhD1、Paige Marquez, MSPH1、Tanya R. Myers, PhD1、Julianne Gee, MPH1、John R. Su, MD, PhD1、Bicheng Zhang, MS1, Deborah Thompson, MD2, Tom T. Shimabukuro, MD1; David K. Shay, MD1
2021年10月29日、米国食品医薬品局(FDA)は、ファイザー・バイオテック社のCOVID-19(BNT162b2)mRNAワクチンの緊急使用承認(EUA)を改正し、5~11歳の小児に使用を拡大し、3週間間隔で2回投与(10μg、各0.2mL)することとしました(1)。2021年12月19日現在、5~17歳の小児への投与が許可されているのは、ファイザー・バイオテック社のCOVID-19ワクチンのみです(2,3)。承認前の臨床試験では、5~11歳の小児3,109人にファイザー・バイオンテックCOVID-19ワクチンを投与しましたが、ほとんどの有害事象は軽度から中等度であり、ワクチン接種に関連する重篤な有害事象は報告されていません(4)。5~11歳の小児における本ワクチンの安全性をさらに特徴付けるため、CDCは、CDCとFDAが共同管理する受動的ワクチン安全性監視システムであるワクチン有害事象報告システム(VAERS)に報告されたファイザー・バイオNTech COVID-19ワクチン受領後の有害事象と、COVID-19接種後の有害事象に関する任意のスマートフォンを用いた安全監視システム(v-safe)に報告された有害事象および健康影響評価(※)の審査を2021年の11月3~12月の間、行いました。この期間に5~11歳の小児に約870万回分のファイザー・バイオンテックCOVID-19ワクチンが接種されました†。VAERSには、この年齢層におけるファイザー・バイオンテックCOVID-19ワクチン接種後の有害事象の報告が4249件あり、そのうち4149件(97.6%)が深刻なものではなかったといいます。5~11歳の小児約42,504人がファイザー・バイオンテックCOVID-19ワクチン接種後にv-safeに登録され、投与2回目以降、合計17,180件(57.5%)の局所反応および12,223件(40.9%)の全身反応(注射部位痛、疲労、頭痛など)が報告されました。安全性に関する予備的知見は
は、承認前臨床試験の結果と同様である(4,5)。予防接種実施諮問委員会(ACIP)は、COVID-19の予防のために、5~11歳の小児にファイザー・バイオンテック社のCOVID-19ワクチンを推奨しています(6)。ファイザー・バイオテック社のCOVID-19ワクチンを接種する5~11歳の小児の保護者には、接種後に局所的および全身的な反応が予想されることを伝えておく必要があります。ワクチン接種はCOVID-19の予防に最も効果的な方法です。CDCとFDAは
は、ワクチンの安全性を継続的に監視し、COVID-19の接種勧奨の指針とするため、必要に応じて最新情報を提供する予定です。VAERSは、CDCとFDAが共同で運営するワクチン安全性監視システムで、ワクチン接種後の有害事象を監視しています(7)。VAERSは、医療従事者、ワクチン製造業者、一般市民など、あらゆる人からの報告を受け付けています。VAERSの報告に含まれる症状、徴候、診断所見には、VAERSスタッフによってMedDRA(Medical Dictionary for Regulatory Activities)の優先用語が割り当てられます。¶ VAERS報告は、入院、入院期間の延長、生命にかかわる病気、永久障害、先天異常または出生異常、死亡**のいずれかが報告された場合に重大と分類されます。死亡の報告については、入手可能であれば、死亡診断書および剖検報告書を入手します。CDC の医師は、死因に関する印象を形成するために、各死者について入手可能なすべての情報を検討した。COVID-19ワクチン接種後の心筋炎および心膜炎の報告は、以下の検索により確認されました。
CDCのスタッフは,心筋炎と心膜炎に関する臨床経過と回復に関する情報を患者や医療従事者から収集することを試みた.††
CDCは、COVID-19ワクチン接種後の有害事象を特に監視するために、スマートフォンを用いた自主的なアクティブセーフティサーベイランスシステムであるv-safeを設立しました。保護者は、1回目または2回目のワクチン接種後にv-safeに登録することができます。ワクチン接種後の最初の1週間に送信される健康調査には、注射部位の局所反応と全身反応(軽度、中等度、重度)¶、健康への影響(新しい症状や状態のために通常の日常生活ができなくなったか、学校を休んだか、医療従事者の治療を受けたかなど)に関する質問項目が含まれています。CDCのv-safeコールセンターは、報告書に以下のような記載があった場合、親または保護者に連絡しました。
は、症状の新規または悪化に対して医療を受け、指示された場合はVAERSレポートの記入を奨励しました。2021年11月3日から12月19日の間に、ファイザー・バイオテックCOVID-19ワクチンを接種した5歳から11歳の小児のVAERSおよびv-safeデータを収集し、全体および性別、年齢層、人種・民族別に分析・記述しました。ファイザー・バイオンテック COVID-19 ワクチンを接種した 5 ~ 11 歳の小児について受け取った 5,277 件の VAERS レポートのうち、この年齢層での使用が承認される前に接種が行われたか、接種日が不明だったため 1,028 件 (19.5%) を分析から除外しました。すべての解析にSASソフトウェア(バージョン9.4;SAS Institute)を使用した。これらの活動はCDCの審査を受け、一貫して実施された。
適用される連邦法およびCDCの方針。
VAERSデータのレビュー
2021年11月3日から12月19日の間、VAERSはファイザー・バイオテック社製COVID-19ワクチン††を接種した5歳から11歳の小児に関する有害事象報告4,249件(表1)を受領・処理し、年齢の中央値は8歳、1,896件
(44.6%)の報告は男性であった。ほとんどの小児(4,143人、97.5%)はファイザー・バイオテック社のCOVID-19ワクチンを単独で接種し、同時に接種したワクチンとしては季節性インフルエンザワクチンが最も多く(91人、2.1%)であった。
全体として、4,149件(97.6%)のVAERS報告は非重篤事象であり、100件(2.4%)は重篤事象であることがわかりました。非重篤事象の報告があった小児の年齢の中央値は8歳で、そのうちの1,835人(44.2%)は男性であった。非重症事象のうち最も多く報告されたのはワクチン投与に関するもので、有害事象なし(1,157件、27.9%)、製剤上の問題(925件、22.3%)、誤投与(675件、16.3%)などであった(表2)。重篤な事象が報告された小児の年齢の中央値は9歳で、61件(61.0%)は男性からの報告であった。100例中、最も多く報告された症状および診断名は、発熱(29例、29.0%)、嘔吐(21例、21.0%)、トロポニン§§の上昇(15例、15.0%)であった。発作に関する重篤な報告12件の内訳は、失神(発作ではない)1件、失神の可能性のある小児1件、熱性けいれん2件、けいれん歴のある小児1件、けいれん性疾患2件、新規けいれん発生5件でした。分析期間中に確認された 15 件の心筋炎の予備報告のうち、11 件が(医療機関の面接または医療記録の調査により)検証され、心筋炎の症例定義に合致しました¶¶;これらの 11 人の子供のうち、7 人が回復し、4 人が報告時に回復中でした。VAERSは、分析期間中に2件の死亡報告を受けましたが、いずれも現在調査中です。これらの死亡例は5歳と6歳の女性2名で発生し、2名とも複雑な病歴を持ち、接種前の健康状態は脆弱であった。いずれのデータも、死亡とワクチン接種の因果関係を示唆するものではありませんでした。
v-safeデータのレビュー
2021年11月3日から12月19日の間に、v-safeにはファイザー・バイオテック社のCOVID-19ワクチンを接種した5歳から11歳の子ども42,504人が登録され(表3)、これらの子どものうち29,899人(70.3%)について2回目の接種情報が入手可能である。1回目の接種後の1週間で、局所反応(23,290人、54.8%)と全身反応(14,734人、34.7%)が頻繁に報告され、全身反応については、1回目の接種後の1週間で、局所反応と全身反応の両方が報告された。
は、投与後1週間に報告されることが投与1よりも多かった(12,223人、40.9%)。また,いずれの用量においても,接種翌日の反応が最も多く報告された.接種後,最も多く報告された反応は,注射部位の痛み,疲労,頭痛であった.発熱は,投与1(3,350人,7.9%)よりも投与2(4,001人,13.4%)でより頻繁に報告された.
服用1回目の翌日に通常の日常生活ができなくなったと回答した保護者は約5.1%、服用2回目の翌日には約7.4%であった。接種後1週間に医療機関にかかったと回答した保護者は約1%であり,ほとんどの医療機関は診療所の予約で受診していた(441人,0.6%).14人(0.02%)が病院で治療を受けたと報告した。入院の理由に関する情報は5人にあり、虫垂炎(2人)、嘔吐と脱水(1人)、呼吸器感染(1人)、後咽頭蜂巣炎(1人)であった。入院したすべての子どもの両親と保護者に連絡し、2人の保護者がVAERSレポートを作成し、1人は入院の報告が誤りであったことを明らかにした。
考察
本報告書は、5歳から11歳の小児に約800万回接種されたファイザー・バイオテック社のCOVID-19ワクチンの投与期間中に収集されたVAERSおよびv-safeのデータから得られた安全性に関する予備的知見を提供するものです。本報告書に要約された所見は、5~11歳の小児に投与されたファイザー・バイオンテックCOVID-19ワクチンの承認前トライアルから得られた安全性データと同様である。
Pfizer-BioNTech COVID-19ワクチンを接種した試験参加者からは、軽度(通常の日常生活に支障がない程度)または中等度(通常の日常生活に支障がある程度)の局所反応(86.2%)および全身反応(66.6%)が多く報告され、ワクチン接種と関連があると判断された重篤な有害事象は報告されませんでした(3)。
ファイザー・バイオテック社製COVID-19ワクチンを接種した5~11歳の小児に対するVAERS報告のうち、約97%が非重篤な有害事象であった。この年齢層でVAERSに報告された最も一般的な有害事象は、投与ミスに関連するものでした。この年齢層は、12歳以上に推奨されるmRNAの投与量(30μg)よりも少ない量(10μg)を初めて受ける年齢であり、投与ミスは予期されないことではありません。投与ミスの報告の多くは、誤った用量の受領に関連する有害事象はなかったと述べていることが多い。
心筋炎は,mRNAベースのCOVID-19ワクチンに関連するまれで重篤な有害事象であり,ワクチン関連心筋炎の報告率は,12~29歳の男性で最も高いとされている(8).現在までのところ、5~11歳の小児における心筋炎はまれであると思われます。また、ワクチン安全性サーベイランスシステムにおいて、同年齢の小児に333,000回接種後1-21日および1-42日に心筋炎が確認された症例はありませんでした(6)。これらの症例は、症状発現までの時間や軽度の臨床経過に関するmRNA COVID-19接種後の心筋炎の他の報告とも一致していると思われます(9)。複数の慢性疾患を有する小児において,ファイザーバイオテック社製COVID-19ワクチン接種後の死亡例が2例報告されているが,最初の検討では,死亡とワクチン接種との因果関係を示唆するデータは得られなかった.
5~11歳のv-safe登録者におけるPfizer-BioNTech COVID-19ワクチン2回接種後の局所反応(57.5%)および全身反応(40.9%)は,12~15歳の児童および青年における反応(局所 62.4%; 全身 63.4%)よりも報告頻度が低かった(9)。5~11歳のv-safe登録者のうち14名がワクチン接種後に入院したことが報告されている。V-safeでは入院に関連する診断を直接記録していないが、保護者は健康診断のたびに補足テキストを記載することができる。入院がワクチン接種の結果かどうかは判断できないが、入院を報告したすべての保護者に連絡を取り、VAERSレポートを作成するように促した。2人の保護者が、VSafeに入院したと報告された子どもの代わりにVAERSレポートを作成した。
本報告で得られた知見は、少なくとも4つの制限を受けることになる。第一に、VAERSは受動的サーベイランス報告システムであり、特に非重篤な事象については報告バイアスや過少報告の可能性がある(8)。第二に、VAERS報告の40%以上において、人種・民族に関するデータが提供されていないことである。第三に、V-safeは任意のプログラムであり、その結果、V-safeのデータはワクチン接種者の代表的なものではないかもしれない。最後に、これらのデータは短い監視期間によって制限されており、安全性監視が継続され、5~11歳の小児に投与される回数が増えるにつれて変化する可能性がある。
COVID-19の感染を防ぐには、ワクチン接種が最も効果的な方法です。ACIPは、COVID-19の予防のために、5〜11歳の小児にファイザー・バイオテック社のCOVID-19ワクチンを推奨しています(10)。安全性に関する予備的な知見は,臨床試験で報告されたものと同様である.ファイザー・バイオンテックCOVID-19ワクチンを接種した5~11歳の小児の保護者には、接種後に局所的および全身的な反応が予想されることを伝えておく必要があります。CDCとFDAは、ワクチンの安全性を引き続き監視し、COVID-19ワクチン接種の推奨を導くために、必要に応じて最新情報を提供する予定です。

表1.5-11歳の小児における有害事象報告
Pfizer-BioNTech COVID-19 ワクチンを接種した人(選択された項目別
人口統計学的特徴と報告された症状(N = 4,249)-。
ワクチン有害事象報告システム(米国、11月3日~)について
2021年12月19日
総計, % 重篤でない, % 重篤である, %*.
特徴 (N = 4,249) (n = 4,149) (n =100)
女性 45.0 45.1 39.0
男性 44.6 44.2 61.0
不明 10.4 10.7 0
年齢範囲、年(中央値)
5-11 (8) 5-11 (8) 5-11 (9)
エスニシティ
ヒスパニック系またはラテン系
11.0 10.9 16.0
ノン・ヒスパニックまたはラティーノ
40.0 39.7 56.0
民族不明
48.9 49.4 28.0
人種
アメリカンインディアンまたは
アラスカ先住民
0.6 0.6 0
アジア 4.0 4.0 7.0
黒 4.1 4.2 2.0
ネイティブハワイアンまたは
その他の太平洋出身者
0.2 0.2 0
白色 39.5 39.2 52.0
多人種 2.2 2.1 9.0
その他 7.1 7.1 4.0
人種不明42.3 42.7 26.0
略語:VAERS=Vaccine Adverse Event Reporting System(ワクチン有害事象報告システム)。
* VAERSの報告は、以下のいずれかが報告された場合、深刻なものとして分類されます。
入院または入院の延長、生命を脅かす病気。
後遺症、先天性異常または出生時障害、死亡。
性別

表2.最も頻度の高い症状、徴候、診断結果、および
ワクチンで報告されたMedDRA優先用語*による状態
5歳から11歳の小児における有害事象報告システム(Adverse Event Reporting System
ファイザー・バイオテック社製COVID-19ワクチン受領後(N = 4,249)-。
米国、2021年11月3日~12月19日
症状、徴候、診断結果、または
状態(MedDRA PT) 報告数 % 報告
非重篤な報告 (n = 4,149)
有害事象なし 1,157 27.9
製品準備の問題 925 22.3
誤った用量の投与 675 16.3
過少投与 324 7.8
嘔吐 316 7.6
発熱 291 7.0
頭痛 255 6.2
シンコープ 255 6.2
めまい 244 5.9
疲労感 201 4.8
吐き気 192 4.6
蕁麻疹 186 4.5
発疹 166 4.0
顔面蒼白 151 3.6
製品の保管ミス 146 3.5
重大な報告(n = 100)
発熱 29 29.0
嘔吐 21 21.0
トロポニン増加 15 15.0
胸痛 12 12.0
心エコー図正常 12 12.0
血液検査 11 11.0
C反応性タンパク質の増加11 11.0
SARS-CoV-2検査陰性 11 11.0
虫垂炎 10 10.0
心電図正常 10 10.0
頭痛 10 10.0
発疹 10 10.0
発作 10 10.0
集中治療 9 9.0
全血球数正常 8 8.0
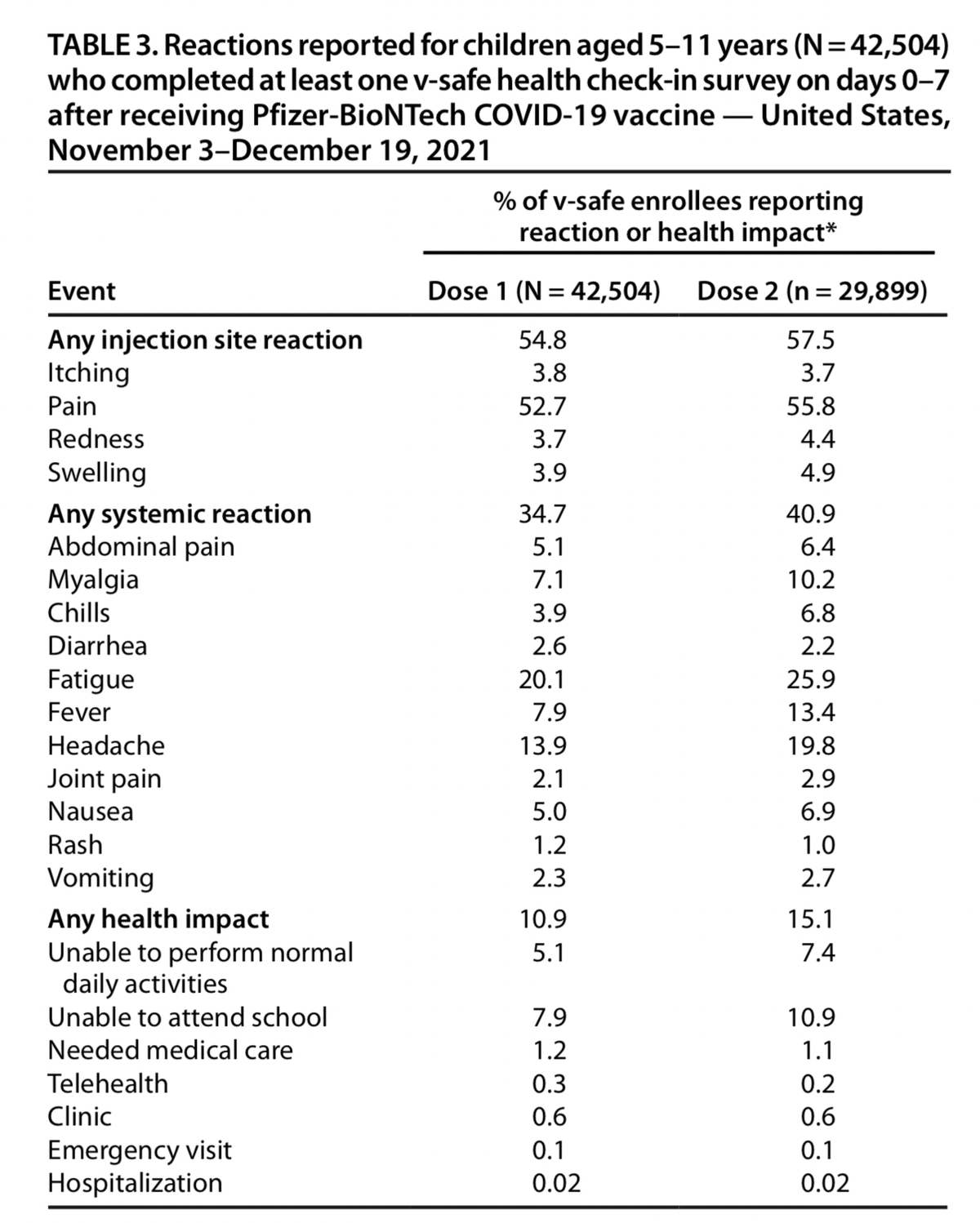
表3.5~11歳の子ども(N=42,504)で報告された反応
0-7日目に少なくとも1回のV-Safe Health Check-in調査を完了した人
Pfizer-BioNTech COVID-19ワクチン接種後-米国。
2021年11月3日~12月19日
報告したV-Safe登録者の割合
イベント反応または健康への影響
投与量1 投与量2
(N = 42,504) (n = 29,899)
あらゆる注射部位反応
54.8 57.5
かゆみ 3.8 3.7
痛み 52.7 55.8
赤み 3.7 4.4
腫れ 3.9 4.9
あらゆる全身反応 34.7 40.9
腹痛 5.1 6.4
筋肉痛 7.1 10.2
悪寒 3.9 6.8
下痢 2.6 2.2
疲労感 20.1 25.9
発熱 7.9 13.4
頭痛 13.9 19.8
関節痛 2.1 2.9
吐き気 5.0 6.9
発疹 1.2 1.0
嘔吐 2.3 2.7
健康への影響 10.9 15.1
通常の日常生活 5.1 7.4
学校に行けない 7.9 10.9
医療が必要な場合 1.2 1.1
テレヘルス 0.3 0.2
クリニック 0.6 0.6
緊急訪問 0.1 0.1
入院 0.02 0.02

概要
このトピックについて既に知られていることは何ですか?
ファイザーバイオテック(BNT162b2)COVID-19ワクチンの承認前試験において、接種した5~11歳の小児は軽度から中等度の重度の局所および全身性の反応を報告しましたが、重篤なワクチン接種関連事象は認められませんでした。
この報告によって何が追加されたのでしょうか?
2021年10月中に5~11歳の小児用としてファイザー・バイオンテック社製COVID-19ワクチンが承認され、約800万回接種された後、5~11歳の接種した小児では、接種後の局所および全身反応がVAERSおよびv-safeによく報告されています。重篤な有害事象はほとんど報告されていません。
公衆衛生の実践にどのような影響があるか?
5~11歳の小児の保護者は、ファイザー・バイオテック社のCOVID-19ワクチン接種後に局所的および全身的な反応が予想され、2回目の接種後に多く見られることを通知する必要があります。

インサイド
1761 ワクチン効果の中間推定値
BNT162b2(Pfizer-BioNTech)ワクチンによる予防効果
青少年におけるSARS-CoV-2感染について
12~17歳 - アリゾナ州、20201年7月~12月
1766 小児の特徴と臨床転帰
と入院した18歳未満の青少年
COVID-19- 6つの病院(米国、7月~)。
2021年8月
1773 移行期におけるテスト・トゥ・ステイ戦略の評価
幼稚園から12年生までの学校 -Los
カリフォルニア州アンジェルス郡、8月16日~10月31日。
2021
1778 二次災害に対するTest to Stay戦略の評価
におけるSARS-CoV-2の三次感染について
K-12 Schools - Lake County, Illinois, August 9-.
2021年10月29日
1782 SARS-CoV-2 B.1.1.529(オミクロン)の調査
バリアントクラスター - ネブラスカ州、11月~12月
2021
1785年版QuickStats

MMWR シリーズは、米国疾病対策予防センター(CDC)の監視・疫学・検査サービスセンターが発行している出版物です。
U.S. Department of Health and Human Services, Atlanta, GA 30329-4027.
引用を推奨する。[著者名;最初の 3 名、6 名以上の場合は et al) [報告書名].MMWR Morb Mortal Wkly Rep 2021;70:linclusive ページ番号].
米国疾病対策予防センター(Centers for Disease Control and Prevention
ロッシェル・P・ワレンスキー(MD, MPH)、ディレクター
Debra Houry, MD, MPH, 主席副所長代理
Daniel B. Jernigan, MD, MPH, 公衆衛生科学・サーベイランス担当副所長
レベッカ・ブンネル博士(科学部門ディレクター
Jennifer Layden, MD, PhD, Deputy Director, Office of Science
Michael F. Iademarco, MD, MPH, センター・オブ・サーベイランス、疫学、ラボラトリー・サービス担当ディレクター
MMWR編集・制作スタッフ(週刊誌)
編集長 シャーロット・K・ケント(PhD)MPH
マーサ・F・ボイド、リード・ビジュアル・インフォメーション・スペシャリスト
ジャクリーン・ギンドラー(医学博士)、編集者
アレクサンダー・J・ゴターディ モーリン・A・リーヒー
Brian A. King, PhD, MPH, ゲストサイエンス編集者
ジュリア・C・マーティンロー スティーブン・R・スプリッグス トン・ヤン
Paul Z. Siegel, MD, MPH, アソシエイト・エディター
視覚情報スペシャリスト
オンラインエディター Mary Dott, MD, MPH
クアン・M・ドアン(MBA)、フィリス・H・キング
テリサ・F.ラトレッジ 常務編集委員
テレー・M・スター、モウア・ヤン
Teresa M. Hood, MS, リードテクニカルライター/エディター
情報技術スペシャリスト
リー・バードン、グレン・デーモン、スーミヤ・ダンワース博士
ティアナ・ギャレット-チェリー(PhD、MPH)、スリラ・セン(MA)。
ステイシー・サイモン(MA)、モーガン・トンプソン
テクニカルライター-エディター
イアン・ブラナム(MA,
ヘルスコミュニケーション・スペシャリスト代理
シェルトン・バートリーMPH レスリー・ハムリン
ローリー・ジョンソン、アマンダ・レイ
ヘルスコミュニケーションスペシャリスト
ウィル・ヤン(MA,
視覚情報スペシャリスト
マシュー・L・ボールトン(MD、MPH
キャロライン・ブルックス(ScD, MA
ジェイ・C・バトラー医学博士
バージニア・A・ケイン医学博士
ジョナサン・E・フィールディング医学博士、MPH、MBA
デビッド・W・フレミング医学博士
MMWR編集委員会
ティモシー・F・ジョーンズ(医学博士)、会長
ウィリアム・E・ハルペリン(MD、DrPH、MPH
ジュエル・ミューレン医学博士、MPH、MPA
ジェフ・ニーダーデッペ(PhD)
セレステ・フィリップ医学博士、MPH
パトリシア・クインリスク医学博士,MPH
パトリック・L・レミントン医学博士、MPH
カルロス・ロイグ(MS, MA
ウィリアム・シャフナー医学博士
ナサニエル・スミス医学博士、MPH
モーガン・ボブ・スワンソン(BS)
アビゲイル・タンペイ(MPH
併せて↓
この記事が気に入ったらサポートをしてみませんか?
