スパコンで薬剤の効果を探る
2020年度 COVID-19対応HPCI臨時公募採択課題紹介
計算科学が解明するCOVID-19の理解と対策
採択課題
新型コロナウイルスの主要プロテアーゼに関するフラグメント分子軌道計算
スパコンで薬剤の効果を探る

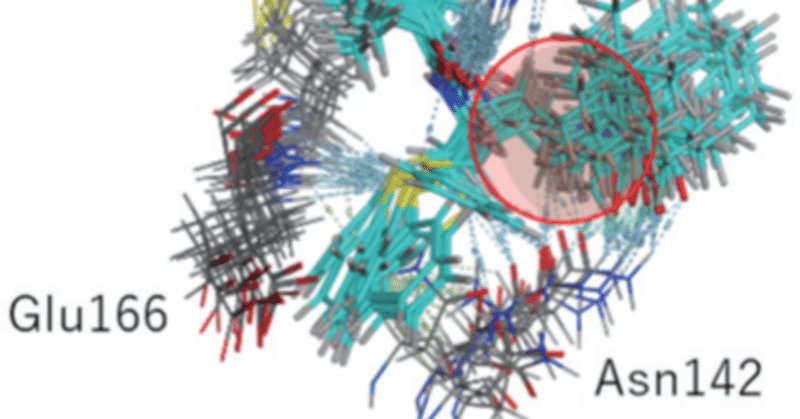
2020年度の特別課題で、JCAHPC※1のOakforest-PACSを使い、新型コロナウイルスの主要(メイン)プロテアーゼと薬剤候補分子の複合体のシミュレーションを行いました。計算は、FMO(フラグメント分子軌道)法に拠ります。FMO法は量子力学な近似の1つで、タンパク質のアミノ酸残基と薬剤分子との相互作用を定量的に評価できますが、大型のタンパク質を計算したり、複数のサンプル構造を効率よく処理するためにはスーパーコンピュータが必要になります。主要プロテアーゼのFMO計算では、薬剤候補として既存のネルフィナビルとロピナビルを取りあげ、 MD(分子動力学)計算によって生成された多数のサンプル構造を扱って統計的に相互作用を解析しました。その結果、ネルフィナビルの方がプロテアーゼとの安定化が有意に大きく、実験の活性値(LC50)の傾向と符合しました。図は、ネルフィナビルと周囲のアミノ酸残基の MD構造を重ねあわせたもので、相互作用の評価に揺らぎを取り込む重要性を示唆しています。「富岳」では 2020年度から続けて、新型コロナウイルスのスパイクタンパク質の FMO計算を続けており、変異株も扱っています。実は、 FMOによるこうした解析は、今から 10年以上前に、インフルエンザウイルスに関して行ったことがありました。その頃は鳥インフルエンザウイルスのパンデミックが懸念されており、計算分子科学の立場からの貢献を考えてのことでした。ただ、当時のスーパーコンピュータは現在に比べて計算力が小さかったため、再考すると不十分なところあります。実際、「富岳」では新型コロナウイルス関係に併せて、インフルエンザウイルス関係の FMO計算も進めています。こうした試みが、「次のパンデミック」に対する基礎的な備えの 1つになれば幸いです。

※1[Joint Center for Advanced High Performance Computing(最先端HPC基盤施設)]当センターと筑波大学計算科学研究センターの教職員が中心となって設計した『Oakforest-PACS』(当センター設置)を運営する組織。
望月祐志/専門は計算化学・量子化学。北海道大学理学研究科博士後期課程修了。理学博士。日本電気、 JST研究員などを経て、 2006年度より立教大学在職。
深く学ぶには
理化学研究所計算科学研究センター研究成果ピックアップ
東京大学情報基盤センター nodes vol.1 CONTENTS
創刊にあたって
[特集] いま、スーパーコンピュータでCOVID-19に立ち向かう
スパコンで薬剤の効果を探る
見えない飛沫を可視化する
[連載] nodesの光明
全学授業オンライン化で「ユーザー目線の大切さ」を痛感
[連載] 飛翔するnodes
30秒ごとに更新する「ゲリラ豪雨予測システム」を開発
「冬眠するブラックホール」の実態を解明
nodesのひろがり
動物の鳴き声の変化を可視化
真の教育とは何か
野生動物にセンサーを装着
センターの研究をバズらせるために
編集後記
全文一気読みバージョンはこちら
この記事が気に入ったらサポートをしてみませんか?
