
「期待」という言葉のウラ側
「期待できる」と表現された商品に、どのような印象を持ちますか? 例えばコスメの紹介記事で、「肌のトーンが明るくなることが期待できます」といった表現が使われていることがあります。コスメやサプリメントなどの商品説明を書く際には、景品表示法や薬機法に抵触しないように、言葉を選ばなければなりません。美白コスメでも、「シミが消える」「肌の色が白くなる」などはNGです。
ですから、「期待できる」には、効果効能をはっきり言えないときに使う「弱気なコトバ」というイメージがあります。つまり、「期待できる」としか言えない状況なのだと思うのです。
特例承認に係る報告書
厚労省が「コミナティ筋注」を審議した結果が、PDFで公開されています。73ページもあり、専門的なところはよくわかりませんが、わかるところだけでも読もうと頑張りました。まず、前半は黒塗りが多いことに驚きます。

例えば3ページに、「2020年●月より開発が進められた」とあります。なぜ個人情報でもないのに、こんなところを黒塗りにするのでしょうか? その後ろに「同年4月より海外臨床試験が開始された」とあるので、開発が始まったのはそれより前の1月~3月のどれかでしょう。なんとなく、1月っぽい感じ。そして、4月から臨床試験を行っていたことも驚きです。
![]()
2ページに、武漢市で発生した肺炎が新型コロナウイルスによるものだとWHOが発表したのが2020年1月12日と書かれているので、4月から臨床試験開始は異常な早さではないでしょうか。
もう1か所、ものすごく気になる黒塗りがあります。

4ページにある、原材料作製に関する「健康な●●●●に由来し」という部分。健康な何?「健康」ってわざわざ書くなんて、健康じゃないものを使うこともあるからとしか思えません。4文字ぐらいと思われますが、一体何か気になります。
黒塗り多すぎて意味不明

9ページ、黒塗りが多すぎて、DSPCというものが何を目的にしているか、まったくわかりません!

19ページには「表8のとおり」と書いてあるのに、
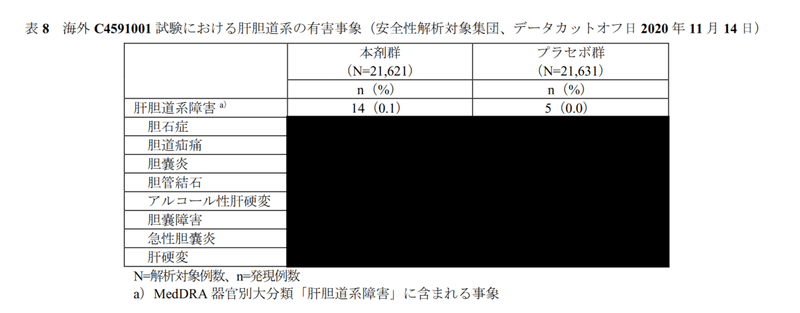
20ページ、表8は真っ黒!
散りばめられた「期待」

有効性については、29ページに「同様の有効性が期待できると判断した」と書かれています。「日本人にも同様の有効性が確認できた」ではなく、「期待」です。

50ページは「期待」の連発で、「発症予防効果が期待できる」「発症予防効果が期待」「発症者の低減につながることが期待できる」。期待できるから「接種可能とすることに意義がある」けど、「接種後の長期の有効性及び安全性や重症化抑制効果は現時点では不明」。

56ページ、「可能性は期待できる」って、どんだけ弱気。

一方で、57ページにはハッキリと、「感染予防効果は、臨床試験では評価されていない」とありますね。厚労省が公開している「ワクチンの副反応に対する考え方及び評価について」という別の資料によると、「感染予防効果は実証しにくく、臨床試験で確認することは稀」なのだそうです。
この資料にも、気になる個所がありました。
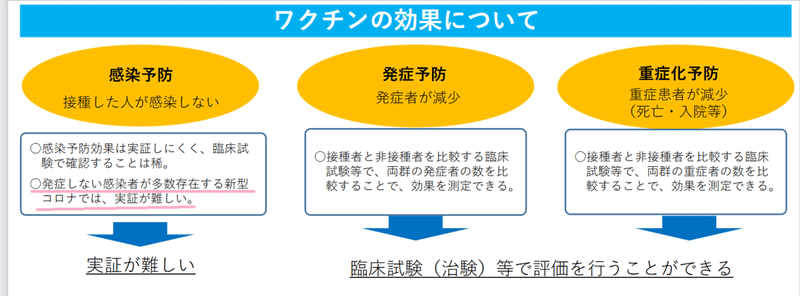
感染予防について、「発症しない感染者が多数存在する新型コロナでは、実証が難しい」と書いてあります。発症しない感染者が多いなら、発症予防の効果も評価が難しいのではないでしょうか?
メディアでは「有効性95%」という数字が大きく取り上げられていますが、2回目接種後7日以降のワクチン群は21,669例中 9例が発症、 プラセボ群は21,686例中172例が発症という結果から算出されたものです。確かに9人と172人を比較すると効果があるように思えますが、接種していなくても99.2%の人は発症していない、とは考えないのでしょうか。
安全性<期待

この報告書の中で、もっとも気になったのがこの部分。フレイルとは、「加齢とともに筋力や認知機能などが低下し、生活機能障害・要介護状態、死亡などの危険性が高くなった状態」のことなので、今まさに接種対象になっている高齢者に多い状態です。
「接種することは可能である」という表現は、積極的に勧めているように思えませんが予約殺到。医師はちゃんと、ここに書かれているベネフィットとリスクを説明しているのでしょうか。73ページもあったら、ベネフィットとリスクを探すのがたいへんなので、最後にまとめページを作ってほしかったですね。

安全性については、37ページに書かれています。とても重要な3つなのに、「製造販売後に情報収集を行う」とのこと。

疾患増強とは、「本剤接種による免疫応答により、SARS-CoV-2感染時の症状が非接種時よりも増強するリスク」と15ページに書かれています。接種した方が感染時の症状が増強する可能性があるということは、「接種しない方がよかった」ということになるかもしれないのです。リスクが低くなる可能性もあるけれど、「リスクがない」とは言っていません。

45ページには、基礎疾患を有する場合の安全性についても「現時点では十分な情報は得られていない」と書かれています。

53ページには、「安全性を検討することを目的とした使用成績調査(医療従事者を対象とした先行接種者健康状況調査)」を実施するとあります。

基礎疾患を有する人に対しても、53ページに「安全性の検討を目的として」調査を行うと書かれています。
![]()
こちらも53ページ。承認後に、販売しながら「長期の安全性」を検討するのです。
国内C4591005試験は、20歳以上85歳以下の日本人健康成人を対象に行った治験です。つまり、国内の治験では、健康な人のデータしか得られていないということになります。
「ベネフィット」と「リスク」の天秤
接種券に同封されている説明書だけでは、これらのことはわかりません。でも、予診票の「接種を希望します」にチェックしたら、同意したことになります。何が起きても、自分で選んだことになるのです。同封された説明書1枚では、あまりにも不親切だと思います。ベネフィットとリスク、両方の情報がなければ天秤にはかけられませんね。
〇ベネフィット
・発症予防効果への期待
〇リスク
・接種後短期間で消失する副反応が報告されている
・因果関係は不明だが死亡を含む有害事象が報告されている
・長期の安全性についてはわからない
・基礎疾患を有する人の安全性については十分なデータがない
・疾患増強リスク*の有無はわからない
(*SARS-CoV-2感染時の症状が非接種時よりも増強するリスク)
先に接種した人のデータを集めて、これらを調査しています。
まだ情報収集中です。
このことに同意した人は接種できます。
私は医師でも感染症の専門家でもありませんが、報告書から読み取った内容を書き出しました。気になった人は、ぜひ報告書を読んでみてください。
厚生労働省サイト ホーム > 政策について > 審議会・研究会等 > 厚生科学審議会 (予防接種・ワクチン分科会)> 第19回 2021年2月15日 資料> 11【参考資料2】新型コロナワクチン「コロナウイルス修飾ウリジンRNA ワクチン(SARS-CoV-2)(コミナティ筋注)」(ファイザー社)審査報告書(特例承認に係る報告書).pdf
