
原子の構造と電子配置について
物質はどのようなもので構成されているのでしょうか?
その根幹となっているものは原子です。
その原子の構造について、今回語っていきます。
原子とは何か
原子は、物質を構成する粒子を分割したとき、その根幹をなす粒子です。
その原子は、プラスの電荷を持つ粒子である原子核と、マイナスの電荷を持つ粒子である電子のよって構成されています。
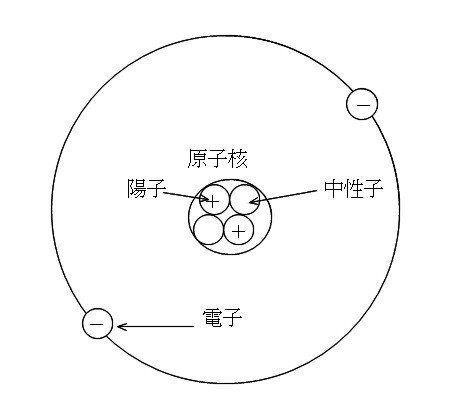
また原子核はプラスの電荷を持つ陽子と、電荷をもたない中性子によって構成させています。
ここで、陽子の数のことを原子番号といい、陽子と中性子の数のことを質量数といいます。
一番簡単な原子構造をもつのは、水素原子であり、陽子と電子のみで成り立つ粒子であります。
原子番号と電子の数は、原子単体の場合は同じです。
このことを考慮して、原子構造について紹介します。
水素原子の原子構造について
水素原子の場合、シュレディンガー方程式を変形させて導いたこの式を用いて原子構造を把握することができます。

この式を解析していくと、水素原子の結合エネルギーE(電子が原子核と結びつこうとするエネルギー)は以下のようにできます。

ここで、nは主量子数と言われ、
n = l+1,l+2,…
で表されます。ここで、lを方位量子数と言われます。また、方位量子数lは
l = 0,1,2,…n-1
と表されます。
また、結合エネルギーを計算する中で、磁気量子数mも以下のように表すこともできます。
m = -l , -l+1,…l
まとめると、以下のようになります。
n:主量子数
・軌道の大きさとエネルギーを決める
・値:1,2,3,…
l:方位量子数
・軌道の形をきめる
・値:0,1,2,3,…,n-1
m:磁気量子数
・軌道の空間での配向を決める
・値:0, ±1, ±2,….,±l
ms:スピン磁気量子数
・2つの値(+1/2 と -1/2)をとり、前者は右回りの自転に対応しαスピン、後者は左回りの自転に対応しβスピンとよばれる。
ここで、主量子数に関して、n=1のときはK殻、n=2のときはL殻、n=3のときはM殻といい、以下、N殻、O殻、P殻・・・と呼びます。
また、方位量子数に関して、l=0のときはs軌道(球形)、l=1のときはp軌道(亜鈴形)、l=2のときはd軌道…といいます。




以上のことから、主量子数nをアルファベットの前につけて,n = 1の場合は 1s,n = 2 の場合は 2s と 2p,n = 3の場合は 3s,3p,3d,などと表します。
すると、電子軌道に関するエネルギー(Eエネルギー準位)について、以下のように表を作れます。

多電子原子の場合の原子構造
ここまでは水素原子のみで成り立つ話しです。
しかし、原子番号が2以上の原子(多電子原子)の場合は電子間の相互作用を考慮しなければなりません。
そのことを考慮して、シュレディンガー方程式にあるハミルトニアンを考える必要があります。
すると、
1s < 2s< 2p<3s<3p < 4s <3d<4p …
の順に電子が配置されることを導くことができます。
この規則をマーデルングの規則といいます。

また、同じエネルギーの電子の状態がある場合は、スピンの向きが同じ方向を向ければいいという事実があり、これをフントの規則と言います。
マーデルングの規則とフントの規則より、原子番号が15のリン(P)の場合は以下のようになります。

なお、原子番号が18までの電子配列は以下のようになります。(Zは原子番号です)

以上をまとめると、K殻からM殻までの電子軌道と電子殻の関係は、下図のようになります。

こうして、原子構造が決定されます。
参考文献
原 康夫「量子力学 (岩波基礎物理シリーズ (5))」岩波書店 (1994/6/6)
矢口裕之「初歩から学ぶ固体物理学 」講談社 (2017/5/1)
この記事が気に入ったらサポートをしてみませんか?
