接種者も未接種者も感染させるのに変わりはない:ランセット
英国におけるワクチン接種者と非接種者におけるSARS-CoV-2 delta(B.1.617.2)亜種の地域感染とウイルス量の動態:前向き縦断的コホート研究
Anika Singanayagam, PhD(アニカ・シンガナヤガム、博士
セラン・ハッキ博士
ジェイク・ダニング(博士) *
Kieran J Madon, MSc
Michael A Crone, MBBCh
Aleksandra Koycheva, BSc
などです。
すべての著者を表示
脚注を表示Open AccessPublished:October 29, 2021DOI:https://doi.org/10.1016/S1473-3099(21)00648-4
概要
背景
SARS-CoV-2デルタ型(B.1.617.2)は感染力が強く、ワクチン接種率の高い地域を含めて世界的に広がっている。我々は、ワクチン接種を受けた人と受けていない人の、地域社会での軽度のデルタバリアント感染における感染とウイルス量の動態を調査することを目的とした。
方法
2020年9月13日から2021年9月15日の間に、471人の英国COVID-19指標症例のコミュニティ接触者602人(英国のコントラクトトレーシングシステムで特定)を、Assessment of Transmission and Contagiousness of COVID-19 in Contactsコホート研究にリクルートし、最大20日間の毎日のサンプリングで8145個の上気道サンプルを提供した。5歳以上の家庭内接触者および非家庭内接触者は、インフォームド・コンセントを提供し、上気道の自己採取に同意できる場合に、募集の対象とした。疫学的につながりのあるデルタバリアント感染の指標となる162例の接触者231人を対象に、ワクチン接種の有無による感染リスクを分析した。完全にワクチンを接種したデルタ感染者(n=29)と、ワクチンを接種していないデルタ感染者(n=16)、アルファ感染者(B.1.1.7;n=39)、アルファ感染前の感染者(n=49)のウイルス量の推移を比較した。疫学解析の主要な結果は、接触者のワクチン接種状況と指標症例のワクチン接種状況で層別された家庭内接触者の二次攻撃率(SAR)を評価することであった。ウイルス負荷動態解析の主要評価項目は,SARS-CoV-2の変異型とワクチン接種状況に応じて,参加者間のピークウイルス負荷,ウイルス増殖率,ウイルス減少率の違いを検出することであった.
調査結果
デルタバリアントに曝露された家庭内接触者のSARは、完全にワクチンを接種した人では25%(95%CI 18~33)であったのに対し、ワクチンを接種していない人では38%(24~53)であった。完全にワクチンを接種した家庭内接触者の2回目のワクチン接種から研究参加までの期間(中央値)は、感染者(中央値101日[IQR 74-120])の方が非感染者(64日[32-97]、p=0-001)よりも長かった。完全にワクチンを接種した指標症例に接した家庭内接触者のSARは,ワクチンを接種していない指標症例に接した家庭内接触者と同程度であった(ワクチン接種者では25%[95%CI 15~35],ワクチン未接種者では23%[15~31]).完全にワクチンを接種した家庭内接触者31人のうち12人(39%)は、疫学的にリンクした完全にワクチンを接種したインデックスケースからの感染であり、さらにインデックスケースと接触者の3組のゲノムおよびウイルス学的解析によって確認された。ピーク時のウイルス量は,ワクチン接種の有無や変異型によって差はなかったが,年齢とともにわずかに増加した(10歳から50歳までの間で,1mL当たりのピーク時log10ウイルス量の差は0-39[95%信頼区間-0-03~0-79]).完全にワクチンを接種したデルタバリアント感染者は,ワクチンを接種していないプレアルファ(0-69),アルファ(0-82),デルタ(0-79)バリアント感染者に比べて,ウイルス量の平均減少速度(1日あたり1mLあたり0-95 log10コピー)が速かった(事後確率>0-84).個人内では、ウイルス量の増加が速いほど、ピーク時のウイルス量が多く(相関0-42[95%信頼区間0-13~0-65])、減少が遅い(-0-44[-0-67~-0-18])という相関関係が認められた。
解釈の仕方
ワクチン接種は、デルタバリアントの感染リスクを低減し、ウイルスのクリアランスを促進する。それにもかかわらず、完全にワクチンを接種した感染者は、ワクチンを接種していない場合と同様のウイルス量のピーク値を示し、完全にワクチンを接種した接触者を含めて、家庭内で効率的に感染を伝播することができる。感染初期の宿主とウイルスの相互作用が、ウイルスの全軌跡を形成すると考えられる。
資金調達
米国国立衛生研究所(National Institute for Health Research)。
はじめに
ワクチン接種の主な目的は、重篤なCOVID-19感染症とその影響から個人を守ることであるが、SARS-CoV-2の感染をどれだけ減らせるかが、パンデミックを抑える鍵となる。この結果は、ワクチンの感染防御能力と、ワクチン接種が突破口となる感染をどの程度減少させるかにかかっている。
研究の背景
本研究以前のエビデンス
SARS-CoV-2 のデルタ型は、ワクチン接種率の高い集団を含め、世界的に広がっている。ワクチン接種は、病気の重症度を軽減し、死亡を予防する上で高い効果を維持しているが、デルタ型では感染に対するワクチンの効果が低下している。ワクチンを接種したデルタ感染者から、ワクチンを接種した人への感染の程度を明らかにすることは、公衆衛生上の優先事項です。デルタ感染の上気道(URT)ウイルス負荷動態を他の変異型のものと比較することで,デルタの感染性増加の潜在的なメカニズムを知ることができる.データベース開設から2021年9月20日までに発表された論文を,"SARS-CoV-2, delta variant, viral load, and transmission "という検索語を用いてPubMedとmedRxivで検索した.2件の研究では、ワクチン接種を受けた人と受けていないデルタバリアント感染者のURTを縦断的に採取し、ウイルス負荷の動態を比較した。シンガポールの入院患者コホートを対象としたレトロスペクティブ研究では、ワクチン接種を受けた人の方が、ワクチンを受けていない症例よりも、より急速なウイルス量の減少が認められました。しかし、この研究では、ワクチン未接種者は中等度から重度の感染症であり、これは長期にわたる排出と関連することが知られています。2つ目の研究は、米国のプロスポーツ選手を対象とした縦断的な研究です。この研究でも、ワクチンを接種した症例のデルタウイルスRNAのクリアランスは、ワクチンを接種していない症例よりも早かったのですが、ワクチンを接種していない症例のうちデルタバリアント感染をしていたのは8%のみで、解釈が複雑になっています。最後に、ベトナムの医療従事者で発生したデルタ亜系の単一感染源による院内感染の報告では、ウイルス量の動態をプロットし(ワクチン未接種のデルタ感染とは比較していません)、院内で完全にワクチンを接種した医療従事者の間で感染が発生したことを示しています。そのため、本研究で得られた知見は、特定の環境や調査した明確なウイルス亜系統を超えて一般化できるものではないかもしれません。
本研究の付加価値
SARS-CoV-2の感染の大部分は家庭内で起こるが,このような環境下での完全なワクチン接種者間の感染はこれまでに示されていない.二次感染を高感度で確認するために,SARS-CoV-2のデルタバリアントに曝露された後,早期に地域社会にいるインデックス症例とその接触者(症状の有無は問わない)を縦断的に追跡し,14~20日間,URTサンプルで毎日定量的RT-PCRを行った.その結果、完全にワクチンを接種した家庭内接触者の二次攻撃率は25%と高かったが、この値はワクチンを接種していない接触者のそれ(38%)よりも低かった。感染リスクは、ワクチンの2回目の接種から2~3カ月の間、時間の経過とともに上昇した。感染した接触者の割合は、指標となる症例のワクチン接種の有無にかかわらず同様であった。ワクチンを完全に接種した指標症例とその接触者の間で,デルタバリアントの伝播が数世帯で認められ,全ゲノム配列解析で確認された.ピーク時のウイルス量は,ワクチン接種の有無や変異型の種類によって差はなかったが,年齢とともにわずかに増加した.ワクチンを接種したデルタ型の症例は、ワクチンを接種していないアルファ型やデルタ型の症例よりもウイルス量の減少が早かった。このことは、感染初期の宿主とウイルスの相互作用が、ウイルスの軌跡全体を形成していることを示唆している。今回の結果は、現実の生活環境における地域の家庭内接触者から得られたものであるため、おそらく一般の人々にも一般化できるものと思われます。
入手可能なすべての証拠の意味するところ
COVID-19による重症化や死亡を防ぐためには、ワクチンは依然として非常に有効であるが、今回得られた知見は、長期にわたる曝露が行われる家庭環境では、ワクチン接種だけではdelta変異体の感染を防ぐのに十分ではないことを示唆している。今回の結果は、高度にワクチン接種された集団における新しいSARS-CoV-2亜種の疫学的表現型を明らかにするための地域研究の重要性を強調するものである。ワクチン接種者であっても,デルタ型の感染を抑制するための継続的な公衆衛生・社会的対策が重要である.
ワクチンを接種することで、α変異体(B.1.1.7)の家庭内感染を40~50%減少させる効果があることがわかっています1。また、ワクチンを接種した人の感染者は、ワクチンを接種していない人の感染者に比べて、上気道(URT)のウイルス量が少なく、感染力が低下していることがわかっています2。しかし、α変異体よりも感染力の高いデルタ変異体(B.1.617.2)が、現在、世界的に主流となっています5, 6。インドで大流行した後、英国はデルタ型の感染が急増していることを最初に報告した国の一つです。現在のワクチンは、デルタ型の感染による入院や死亡を防ぐのに高い効果を発揮しています7。しかし、デルタ型の感染に対するワクチンの効果は、アルファ型に比べて低下しており8,9、ワクチン接種率が高い国でもデルタ型の感染は依然として高い負担となっています。ワクチンを接種した軽度の感染者からデルタ型が市中に伝播するリスクについてのデータは少ない。
この研究では、COVID-19感染が確認された患者の外来患者である近親者が、毎日、縦断的なURTサンプリングを受け、関連する臨床データおよび疫学データを収集した。本研究では、delta変異体の家庭内感染を定量化し、ワクチン接種の有無が接触者の感染リスクおよび指標となる症例の感染力に及ぼす影響を評価することを目的とし、(1)ワクチン未接種の接触者と指標となる症例がいる家庭、(2)完全にワクチンを接種した接触者と完全にワクチンを接種した指標となる症例がいる家庭を対象とした。また、重症ではないデルタ、アルファ、プレアルファのSARS-CoV-2感染者から順次採取したURTウイルスRNAの軌跡を比較し、SARS-CoV-2の変異型の状態、デルタ感染の場合はワクチン接種の状態が感染力に与える影響を推測した。
メソッド
研究デザインと参加者
ATACCCは、SARS-CoV-2感染者の地域社会での接触者を対象とした観察的縦断的コホート研究である。英国の接触者追跡システム(National Health Service Test and Trace)に通知されたPCRで症状が確認された指標症例の接触者に、Public Health Englandから本研究への参加について連絡を受ける意思があるかどうかを尋ねた。指標となる症例の症状が出てから5日以内に通知されたすべての接触者を、我々の募集定員内で連絡を取るように選択した。5歳以上の家庭および非家庭の接触者は、書面によるインフォームド・コンセントを提供し、URTの自己スワビングに同意することができれば、募集の対象となった。URTのサンプリングに関する詳細は、付録(p13)に記載されています。
ATACCC研究は、ATACCC1とATACCC2の2つの研究群に分かれており、SARS-CoV-2パンデミックの異なる波を捉えるように設計されています。ATACCC1では、グレーターロンドンにおけるアルファバリアントおよびプレアルファ症例を調査し、2020年9月13日から2021年3月13日の間に接触者のみを募集した。ATACCC1では、プレアルファ波(2020年9月~11月)とアルファ波(2020年12月~2021年3月)が実施されました。ATACCC2では、グレーターロンドンとボルトンにおけるデルタバリアント症例を調査するために特別に研究を再開し、インデックス症例とコンタクトの両方を2021年5月25日から9月15日の間にリクルートしました。早期に西ロンドンとボルトンに焦点を当てたのは、これらの地域でデルタ・バリアントの英国での発生率が最も高かったからである10。国と地域のサーベイランスデータに基づくと、今回の募集期間のほとんどにおいて、地域社会での感染は中程度から高程度であった。
この研究は,保健研究局の承認を得て実施されました。登録前にすべての参加者から書面によるインフォームド・コンセントを得た。子どもについては,両親と介護者が同意した。
データ収集
人口統計情報は、登録時に研究チームが収集した。世帯主以外の接触者の被爆日はPublic Health Englandから入手した。COVID-19の接種歴は、英国のNational Immunisation Management System、一般開業医の記録、および研究参加者の自己申告から決定した。参加者は、登録日の少なくとも7日前にCOVID-19ワクチンを1回も接種していない場合は未接種、登録日の少なくとも7日前にワクチンを1回接種している場合は部分接種、登録日の少なくとも7日前にCOVID-19ワクチンを2回接種している場合は完全接種と定義した。ワクチン接種の状態を定義するための7日間の閾値は、過去の文献を参考にして決定しました。ワクチン接種から試験参加までの期間を算出した。WHO基準14 を用いて,試験参加日までの症状を定義した.インシデント症例(登録時にPCR陰性で、その後陽性となった参加者)の症状は、最初のPCR陽性結果が出た日から定義した。
検査手順
SARS-CoV-2の定量的RT-PCR、ORF1abとエンベロープ(E-gene)のサイクル閾値のウイルスゲノムコピーへの換算、全ゲノム配列の決定、および系統の割り当てについては、付録(p13-14)に記載した。
成果
疫学解析の主要項目は、接触者のワクチン接種状況と指標症例のワクチン接種状況で層別した家庭内接触者の二次感染率(SAR)の評価であった。ウイルス負荷動態解析では,α前型とα型とδ型に感染した参加者,ワクチンを接種していないδ型感染者とワクチンを接種したδ型感染者の間で,ピーク時のウイルス負荷,ウイルス増殖率,ウイルス減少率の違いを検出することを目的とした.
探索的解析として,ワクチンの有効性と,2回目のワクチン接種からの経過時間で層別したSARS-CoV-2の感染しやすさを評価した。
統計解析
ウイルスの動態をモデル化するために,疾患の発症過程におけるウイルスの力価15 の単純な現象論的モデルを用いた.ウイルスの動態パラメータは,ベイジアン階層モデルを用いて参加者ごとに推定し,このモデルを全参加者について測定された周期的な閾値の全データセットに適合させた.指標となる症例の家庭内接触者ではなく、曝露日が特定されている19名の参加者については、曝露日の疑似無症候性データポイント(すなわち、ウイルスが検出されなかった)によってサイクル閾値データを補完した。検査の精度とモデルの不完全性については,(正規)誤差分布から観察結果が得られる確率をp,真の分布から得られる確率を1-pと仮定し,混合モデルを用いてモデル化した.
階層構造は、感染した変異体とワクチン接種状況に基づいて参加者をグループ分けすることで表現した。このモデルでは、ウイルスの動力学的パラメータは個人によって異なり、変異体やワクチン接種の有無によっては変化しないことを暗黙的に仮定しています。また、4群モデルも検討した。ここでは、1群、2群、3群、4群が、それぞれpre-alpha、alpha、未接種のdelta、完全接種のdeltaを表す。参加者固有の動態パラメータ間の相関行列を当てはめ、ピークウイルス力価、ウイルス増殖率、ウイルス減少率にグループ内の相関があるかどうかを調べた。最初のモデル選択では,リーブワンアウト・クロスバリデーション法を用いて,ピークウイルス量を決定する個人レベルのパラメータと,ウイルス量の増加率および減少率との間の相関係数が適合する4群の階層モデルを選択した(付録P5).しかし、探索的分析の結果、参加者固有のピークウイルス量の推定値(増加率と減少率ではない)は、年齢と顕著かつ有意な相関を示したため、平均ピークウイルス量が年齢に応じて変化するモデルを検討することになった。最も予測性の高いモデルは、平均ウイルス量の増加率と減少率を4群間で変化させ、平均ピークウイルス量は全群共通だが、年齢の対数に対して線形に変化すると仮定した(付録P5)。基準年齢である50歳のピークウイルス量を、95%信頼区間(95%CrI)とともに示した。基準年齢として50歳を選んだのは、全データセットの症例の年齢に典型的なものであり、基準年齢の選択によってモデルの適合性や群間の差の判定に違いはなかった。
グループレベルの母集団の平均値と,log peak viral titre,viral growth rate,viral decline rateのグループ内の平均値を計算した.これらの変数の事後推定値はグループ間で相関しているため,あるグループの推定値と別のグループの推定値の信頼区間が重なっても,必ずしもこれらのグループ間に有意差がないことを示すものではない.そこで我々は,これらの変数があるグループで他のグループよりも大きいという事後確率ppを計算した。我々のモデルでは、ベイズ係数はpp/(1-pp)として計算される。我々は,差の少なくとも中程度の証拠を示すものとして,0-75より大きい(ベイズ係数3以上に対応する)集団(群レベル)事後確率のみを報告する.
ワクチンの効果については,症状の有無にかかわらず感染を予防する効果の推定値を定義し,家庭でのデルタを1-SAR(完全接種)/SAR(非接種)とした.
資金源の役割
本研究の資金提供者は,研究デザイン,データ収集,データ分析,データ解釈,および報告書の作成には一切関与していない。
結果
2020年9月13日から2021年9月15日の間に、471件のインデックス通知から生じた621人のコミュニティベースの参加者(602人の接触者と19人のインデックス症例)が、ATACCC1およびATACCC2研究に前向きに登録され、8145個のURTサンプルを提供した。このうち、ATACCC1では369人の接触者(308件のインデックス通知から生じた)、ATACCC2では233人の接触者(163件のインデックス通知から生じた)と19人のインデックス症例が登録された。621名のうち163名(26%)からSARS-CoV-2のRNAが検出された。PCR陽性例の全ゲノム配列を解析した結果、71人がデルタバリアントに感染しており(インデックスケース18人、接触者53人)、42人がアルファバリアントに感染しており(インデックスケース1人、接触者41人)、50人がアルファバリアント以前に感染していることが確認された(接触者全員、図1A)。

図1ATACCC研究参加者のリクルート、SARS-CoV-2感染、変異状態、およびワクチン接種歴
(A) 研究の募集と全ゲノム配列決定により確認された変異体の状態(ATACCC1とATACCC2を合わせたもの)。(B)ATACCC2:二次攻撃率の計算(表1)および伝播評価(表2)に含まれるデルタ暴露された接触者。NHS=National Health Serviceの略。*すべての指標症例はATACCC2のもの。† すべての接触者。‡ ATACCC2コホートからの最も早いPCR陽性症例2例(指標症例1例と接触者1例)は、全ゲノム配列解析でαバリアントを有することが確認された(2021年5月28日に募集)。このαバリアントが露出したPCR陽性の接触者は、図1Bから除外されている。§PCR陰性の1人の接触者はワクチン接種状況のデータが入手できず、PCR陰性の1人の接触者のインデックスケースはワクチン接種のデータが入手できなかった。¶¶163人のうち138人の指標症例のワクチン接種データが入手できた。||これら15人の指標症例の接触者は、232人の総接触者の中に含まれている。**これらの接触者のいない3人のインデックスケースは、ウイルス負荷動態解析(図3)にのみ含まれており、表1および表2には含まれていない。
表1ATACCC2試験に募集されたdelta露出の指標症例の連絡先におけるSAR

完全にワクチンを接種した症例とワクチンを接種していない症例とのSARの違いについては、χ2検定を用いてp値を算出した。ワクチン接種状況の情報を持たずに調査を辞退したPCR陰性の接触者1名を除外した。NA=該当なし。SAR=二次攻撃率。
デルタバリアントに曝された204人の家庭内接触者のうち,疫学的に結びついた138人の指標症例のワクチン接種状況がわかった(図1B,表2).完全にワクチンを接種した指標症例に接した家庭内接触者のSARは25%(95%CI 15-35;69人中17人)であり、ワクチンを接種していない指標症例に接した家庭内接触者のSAR(23%[15-31];100人中23人;表2)と同様であった。PCR陽性の53人の接触者は、PCR陽性の39人の指標症例に家庭内で接触したことが原因であった。二次感染の原因となったこれらの指標症例のうち、完全にワクチンを接種していた人の割合(39人中15人[38%])は、ワクチンを接種していなかった人の割合(39人中16人[41%])とほぼ同じであった。指標症例が2回目のワクチンを接種してから、それぞれの接触者の募集日までの日数の中央値は73日(IQR 38~116)であった。接触者に感染させたインデックスケースとそうでないインデックスケースでは,時間間隔に差はなかった(それぞれ94日[IQR 62-112],63日[35-117],p=0-43).
表2デルタバリアントに感染した家庭内接触者204名に対するPCR陽性の指標症例138名のワクチン接種状況の比較

家庭内被爆者以外の接触者(n=24,すべてPCR陰性)は除外した。PCR陰性の家庭内接触者のうち、ワクチン接種状況の情報を持たずに調査を中止した1名を除外した。PCR陰性の家庭内接触者のうち、指標となる症例との関連付けができなかった1名も除外された。
* 以下の行は、各カテゴリーのインデックスケースに曝露された接触者の数を示している。
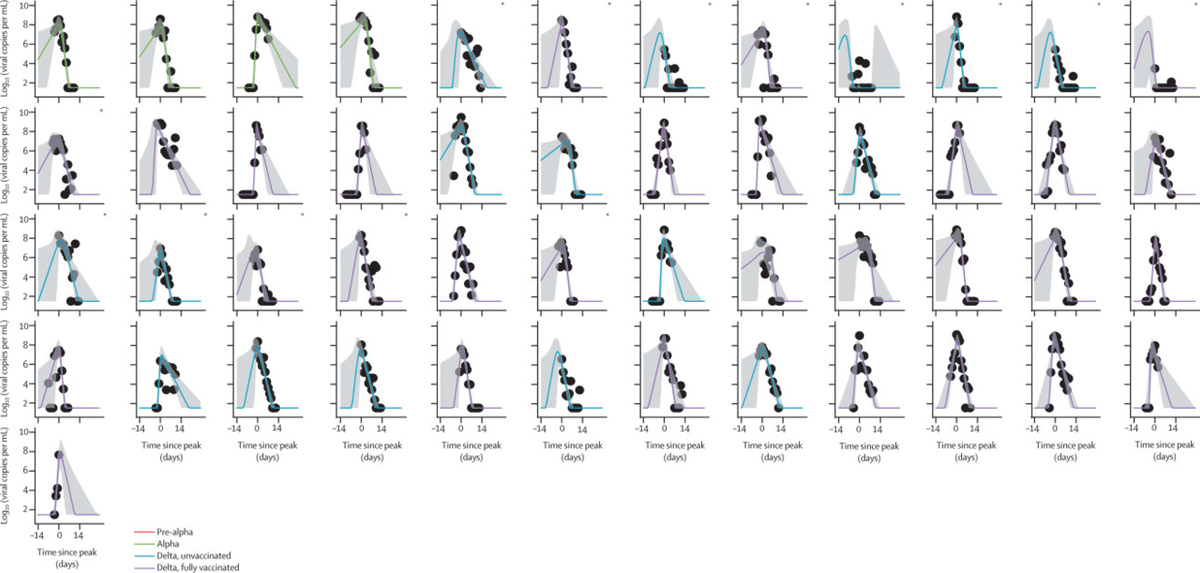
図3 プレアルファ、アルファバリアント(ワクチン未接種)、デルタバリアント(ワクチン接種およびワクチン未接種)に感染した133名のピーク前14日目から28日目までのORF1abウイルス量の推移
PCR陽性者163名のうち、89名(55%)が女性で、133名(82%)が白人であった。年齢の中央値は36歳(IQR 26-50)でした。性別、年齢、民族、BMI(body-mass index)分布、併存疾患の頻度は、年齢と性別を除いて、デルタ、アルファ、アルファ以前の感染者、ワクチン接種者とワクチン未接種のデルタ感染者で同様であった(付録pp2-3)。ワクチン未接種の女性は男性よりも少なく(p=0-04)、英国でのワクチン展開の年齢優先から予想されるように、デルタ型に感染したワクチン未接種者は有意に若かった(p<0-001;付録p3)。指標となる症例に感染してから研究に参加するまでの期間の中央値は4日(IQR 4~5)でした。参加者は全員、重度ではない外来患者か、無症候性であった。無症状の症例の割合は、完全にワクチンを接種した群、部分的にワクチンを接種した群、ワクチンを接種していないデルタ群で差はなかった(付録P3)。
試験登録前にCOVID-19ワクチンを接種していたプレアルファ感染者はおらず、アルファ感染者は1名のみであった。71名のデルタ感染者(うち18名がインデックスケース)のうち、23名(32%)がワクチン未接種、10名(14%)が部分接種、38名(54%)が完全接種であった(図1A;付録P3)。完全にワクチンを接種したデルタ感染者38名のうち、14名がBNT162b2 mRNAワクチン(Pfizer-BioNTech社)、23名がChAdOx1 nCoV-19アデノウイルスベクターワクチン(Oxford-AstraZeneca社)、1名がCoronaVac不活化全ウイルスワクチン(Sinovac社)を接種していた。
233人のATACCC2接触者のうち、1人を除いて全員がdeltaバリアントに曝露されていた可能性が高い。なぜなら、彼らはdeltaの地域有病率が少なくとも90%、ほとんどが95~99%の時に募集されていたからである(図1B)10。年齢、民族、BMI、喫煙状況、併存疾患の分布は、PCR陽性の接触者とPCR陰性の接触者で同様であった(付録P4)。完全にワクチンを接種したデルタバリアント感染者の2回目のワクチン接種から試験参加までの期間の中央値は74日(IQR 35-105、範囲16-201)で、PCR陽性の接触者はPCR陰性の接触者に比べて有意に長かった(それぞれ101日[IQR 74-120]対64日[32-97]、p=0-001、付録p4)。PCR陽性の接触者53人全員が家庭環境で曝露されており、デルタバリアントに曝露された家庭環境の接触者全員のSARは26%(95%CI 20~32)であった。ワクチン未接種者(38%,95%CI 24~53)は,ワクチン接種済みの家庭内接触者(25%,18~33)に比べてSARは有意に高くなかった(表1).家庭内でのデルタの感染(症状に関わらず)を予防するワクチンの効果は34%と推定された(ブートストラップ95%CI -15~60)。2回目のワクチン接種から試験参加までの期間を14日とし,完全接種とみなして感度分析を行ったが,ワクチンの有効性やSARの推定値に大きな影響はなかった(データは示されていない).サンプル数が少ないため精度には限界がありますが,この推定値は,より大規模なデータセットに基づくデルタバリアント感染に対するワクチン効果の推定値とほぼ一致しています9, 16, 17。
接触者登録のきっかけとなった163人のデルタバリアント感染者のうち18人は、自らATACCC2に採用され、連続したURTサンプルが採取されたため、より詳細なウイルス学的・ゲノム学的解析が可能となりました。このうち15人については、その連絡先も募集した(家庭内連絡先13人、家庭外連絡先2人)。これら15人の指標症例のうち4人について、対応するPCR陽性の家庭内接触者が同定された(図1B)。ゲノム解析の結果、これらの事例では、1つの例外を除き、指標となる接触者のペアは同じデルタバリアントのサブ系統に感染していた(図2A)。1世帯(番号4)では、ワクチンを接種していない指標症例が、ワクチンを接種していない接触者にデルタバリアントを感染させたが、部分的にワクチンを接種した別の接触者は、異なるデルタ亜系統に感染していた(これはおそらく世帯外で感染したものと思われる)。他の3世帯(番号1~3)では、完全にワクチンを接種した指標症例が、完全にワクチンを接種した家庭の接触者にデルタ亜型を感染させており、すべての症例でウイルス量が多く、ウイルス量の動態の時間的関係は指標症例からそれぞれの接触者への感染と一致していた(図2B)。

図2 SARS-CoV-2デルタ型(B.1.617.2)の家庭内感染を示すウイルス学的、疫学的、ゲノム学的証拠
A) delta18の系統を決定する変異を持つ4つの世帯のゲノム解析と、世帯内の個人からの株が近縁であるかどうかを知るために表示されたORF内の追加変異。AY.4系統とAY.9系統はデルタの亜系統である。(B) 疫学的につながりのある家庭内接触者から感染が検出されたデルタ型に感染した4人のインデックスケースのウイルス軌跡とワクチン接種状況。すべての患者は重症ではなかった。各プロットは指標症例とその家庭内接触者を示している。検出不可能なウイルス量の測定値は、検出限界(101-49)でプロットされている。C=接触者。I=インデックスケース。FV=完全に予防接種を受けた人。ORF=オープンリーディングフレーム。PV=部分的にワクチンを接種した人。U=ワクチン未接種。
モデリング解析の対象基準としては、PCR陽性の参加者163名(プレアルファバリアント49名、アルファ39名、デルタ45名:付録P14)のウイルス負荷RNA軌跡を選択した。デルタ45例のうち、29例は完全にワクチンを接種しており、16例はワクチンを接種しておらず、部分的にワクチンを接種した例は除外した。対象となった133例のうち、29例(22%)が偶発症例(すなわち、登録時にPCR陰性であったが、その後PCR陽性となった症例)、104例(78%)が有病症例(すなわち、登録時にすでにPCR陽性であった症例)であった。有病者のうち15名は、明らかに解決可能なピークウイルス量を有していました。図3は、モデル化されたウイルスRNA(ORF1ab)の軌跡と、個々の参加者について測定されたウイルスRNAコピー数を示しています。また、E-geneに相当するものを付録(p2)に示した。E-geneのサイクル閾値データ(付録p5、7、9、11)から得られた推定値は、ORF1abの推定値と同様であった。

図3 プレアルファ、アルファバリアント(ワクチン未接種)、デルタバリアント(ワクチン接種およびワクチン未接種)に感染した133名のピーク前14日目から28日目までのORF1abウイルス量の推移
黒丸は測定値で、各参加者の最初のデータポイントは登録日としている。プロットは、各参加者のウイルス量がピークに達した日を基準にしており、X軸では0日目としている。曲線はモデルの事後中央推定値を示し、95%信頼区間の陰影をつけた。133人の感染者は、114人の接触者と19人のインデックスケースからなる。*インデックス症例。
ウイルスの動態は,4つのグループのすべての症例で視覚的には類似しているように見えるが,推定されるウイルス増殖率と減少率には定量的な違いがあることがわかった(表3,表4).ORF1abサイクルのしきい値データに基づく平均ウイルス量減少率の母集団(グループレベル)推定値は、1mLあたり0-69-0-95log10ユニット/daxes 4; appendix p 10)の範囲で変化しており、ウイルス量がピークから検出不能まで減少するには、典型的な10日間の期間が必要であることを示していた。α群(pp=0-93)、未接種のδ群(pp=0-79)、完全接種のδ群(pp=0-99)では、α前の群に比べて早い減少が見られた。また、完全接種のdelta群の平均ウイルス量減少率は、α群(pp=0-84)および未接種のdelta群(pp=0-85)よりも速かった。これらの減少率の違いは、ワクチン接種前のα群とワクチン接種したδ群の減少期の平均期間に約3日の差をもたらした。
表3ORF1abサイクル閾値データから得られたプレアルファ、アルファ、デルタ(未接種および完全接種)の各症例のVL成長率の推定値

VL成長率は、サンプル内事後平均推定値として示されている。残りの列は、その行の推定値が別のグループの推定値よりも小さいという母集団(グループレベル)の事後確率を示している。事後確率は20,000個の事後サンプルから得られ、サンプリング誤差は0-01未満である。VL=viral load。CrI=信頼できる区間。
表4ORF1abサイクル閾値データから得られたプレアルファ、アルファ、デルタ(未接種および完全接種)症例のVL減少率の推定値

VL減少率は、サンプル内事後平均推定値として示されている。残りの列は、その行の推定値が別のグループの推定値よりも小さくなる母集団(グループレベル)の事後確率を示す。事後確率は20,000個の事後サンプルから得られ、サンプリング誤差は0-01未満である。VL=viral load。CrI=信頼できる区間。
ウイルス量の増加率は減少率よりも大幅に速く、グループ間で1日あたり2-69-3-24 log10 units/mLの範囲で変化し、ウイルス量が検出されない状態からピークに達するまでには典型的な3日間が必要であることが示された。グループ間の増殖率の違いを推論する力は,ウイルス減少の場合よりも制限されていたが,ワクチン接種を受けたdeltaグループの増殖率がpre-alphaグループよりも低いことを示す中程度の証拠(pp=0-79)があった.
50 歳の成人の平均ピークウイルス量は,1 mL あたり 8~14(95% CrI 7~95~8~32) log10 コピーと推定されたが,ピークウイルス量には変異やワクチン接種の有無による差はなかった.しかし、ピークウイルス量は年齢とともに増加すると推定され(log[年齢]に対するピークウイルス量の傾きが0以上であることをpp=0-96とした)、log[年齢]の単位変化あたり0-24(95% CrI -0-02~0-49) log10 copies per mLの傾きがあると推定された。この推定値は、10歳と50歳の間のピーク時の平均log10コピー/mLの差が0-39(-0-03~0-79)であることに相当する。
グループ内の各被験者のウイルス量増加率の推定値は、ピーク時のウイルス量と正の相関があり、相関係数の推定値は0-42(95%CrI 0-13~0-65、付録P8)でした。したがって、ウイルス量の増加速度が速い人は、ピーク時のウイルス量が高い傾向にある。また、ウイルス量の減少率は、ウイルス量の増加率と負の相関があり、相関係数は-0-44(95% CrI -0-67〜-0-18)と推定され、ウイルス量の増加が早い人ほど、ウイルス量の減少が遅い傾向にあることが示された。
ディスカッション
19 デルタウイルスに感染した家庭内接触者のコホートでは、ワクチン未接種者のSARは38%、ワクチン接種済み者のSARは25%であった。この所見は,COVID-19ワクチン接種による感染防御効果が知られていることと一致している8, 9.しかしながら,これらの所見は,ワクチン接種にもかかわらず家庭内接触者の感染リスクが継続していることを示している.ワクチン接種から研究参加までの期間は、PCR陽性の接触者がPCR陰性の接触者よりも有意に長かったことから、ワクチン接種後2~3カ月で感染しやすくなることが示唆され、これは防御免疫の減退と一致する。この重要な観察結果は,最近の大規模データと一致しており,さらなる調査が必要である17. デルタ感染の世帯SARは,ワクチン接種の有無にかかわらず26%(95%CI 20-32)であり,英国の全国サーベイランスデータの推定値(10-8%[10-7-10-9])よりも高かった10.しかし,本研究では,症状にかかわらず毎日接触者をサンプリングし,高感度で積極的に感染を確認した.対照的に,症状に基づく単一のタイムポイントでのサーベイランス検査は,おそらく真のSARを過小評価し,感染に対するワクチンの効果も過大評価する可能性がある.
完全にワクチンを接種したインデックスケースの家庭内接触者のSAR(25%)は、ワクチンを接種していないインデックスケースの家庭内接触者のSAR(23%)と同程度であった。この結果は、完全にワクチンを接種した人のブレイクスルー感染が、家庭内で効率的に感染を伝播することを示している。完全にワクチンを接種した指標症例と接触者の間で12件の家庭内感染が確認されたが、このうち3件については、指標症例と接触者が同じデルタバリアント亜系統に感染していたことがゲノムシークエンスによって確認されたため、疫学データやウイルス量動態の時間的関係を裏付けることができ、二次感染の決定的な証拠となった。我々の知る限り、完全にワクチンを接種した人の間でデルタ型ウイルスが伝播したことを報告した研究は他に1件あり、ベトナムで特定のデルタ型ウイルス亜系統に感染した1人の医療従事者による点源院内感染であった22。
曝露後早期(中央値4日)から最大20日間にわたって症例を毎日縦断的にサンプリングすることで、感染過程におけるURTウイルス量の高解像度の軌跡を得ることができました。現在までに、軽度のSARS-CoV-2感染症例を地域住民から連続的に抽出した研究は2件あるが、これらは無症状のスクリーニングプログラムによって特定された極めて特殊な集団から得られたものである(例:大学職員・学生23、プロスポーツ選手24)。
ウイルス負荷動態の最も予測的なモデルでは、50歳の成人の1mLあたりの平均ピークlog10ウイルス負荷は8~14(95%CrI 7-95-8-32)と推定され、これは日常的な監視データを用いた2021年の研究による推定値と非常によく似ている25。これまでに行われた小児と成人のウイルス量に関する研究4, 25, 26では、このような密度の高い連続したウイルス量のサンプリングは行われていないため、年齢に関連した差を明らかにする力は制限されていました。そのような研究の中で最も規模の大きい25件の研究では、小児と成人の間に今回推定した差と同様の差が報告されています。ウイルス量の減少速度は、ワクチンを接種したデルタ感染者が他のすべてのグループよりも速く、アルファ感染者とワクチンを接種していないデルタグループの人はアルファ感染前の人よりも速いことがわかりました。
すべてのワクチン接種群において、ウイルス負荷動態パラメータの推定値の参加者間のばらつきは、グループ間で推定された平均パラメータのばらつきよりもかなり大きかった。完全にワクチンを接種した人とワクチンを接種していないデルタ感染者との間のウイルス動態の違いがそれほど大きくないことが、今回の研究でワクチンを接種したデルタインデックスケースからの感染率が比較的高いことの説明になるかもしれません。完全にワクチンを接種したデルタのインデックスケースのSARが、ワクチンを接種していないケースのSARよりも低いという証拠は見つかりませんでした。しかし、指標となる症例が日常的な症候性サーベイランスによって同定されたことを考えると、典型的な症候性を持たないワクチンブレークスルーの指標症例を同定するという選択バイアスがあったのかもしれません。
プレアルファ、アルファ、デルタの各変異体グループ間で見られたウイルス動態の違いは、SARS-CoV-2の進化に伴うウイルス動態の変化が、より迅速なウイルス除去に向けて少しずつ、しかし潜在的には適応的に変化していることを示唆している。本研究では、各変異型やワクチン接種群において、ウイルス増殖速度はピークウイルス量と正の相関があるが、ウイルス減少速度とは負の相関があるという初めての証拠を得た。この結果は、ウイルスの複製が最初に最も速い個人感染では、ピークウイルス量が最も高く、ウイルスのクリアランスが最も遅いことを示唆しています。これらのデータは、SARS-CoV-2の初期増殖速度を決定する宿主およびウイルスの要因が、感染全体の軌跡に基本的な影響を与えていることを示唆している。増殖速度が速いと、免疫反応による制御が(ウイルス量のピークとその後のウイルス量の減少の両方の観点から)難しくなる。感染時に連続して採取された免疫マーカーを分析することで、感染動態の初期の違いの免疫的な相関関係を知ることができるかもしれません。また、ウイルス量の増加が最も速く、ピークが最も高い人は、地域社会の感染に不相応に貢献している可能性があり、この仮説は今後の研究で検証されるべきである。
日常的に入手可能なデータを用いたいくつかの集団レベルのシングルタイムポイントサンプリング研究では、デルタバリアント感染者のワクチン接種者と非接種者の間でサイクル閾値に大きな違いがないことが明らかになっています10, 27, 28。シンガポールの入院患者を対象としたレトロスペクティブコホート29でも、デルタバリアントのワクチン接種者と未接種者では、ウイルスの減少速度が速いことが報告されており、減少速度の差は今回の推定値よりもやや大きいと報告されています。しかし、この差は、シンガポールの研究では、ワクチン未接種者の重症度が我々の研究よりも高かった(約3分の2が肺炎、3分の1がCOVID-19による治療を必要とし、5分の1が酸素吸入を必要としていた)ことで説明できるかもしれませんし、重症度の高い患者ではウイルス排出量が長くなることが報告されています30。また、この研究では、ワクチン接種者と非接種者の軌跡を比較し、増殖期とピークサイクルの閾値は類似しているが、ワクチン接種者の方がウイルスのクリアランスが早いことを報告しています。しかし、米国で行われたこの研究では、ワクチン接種の有無とウイルスの種類を合同ではなく別々に層別化しています。つまり、デルタ型に感染しているワクチン接種者は、主にアルファ型やアルファ型に感染しているワクチン未接種者と比較されているのです。さらに、サンプリングはプロスポーツ選手の職業健康診断プログラムの一環として行われたため、今回の結果は必ずしも典型的な地域感染を代表するものではありません。
今回の研究には限界がある。第一に、本研究の募集は、日常的な接触者追跡通知に基づいて行われているため、症状のある指標症例の接触者のみを募集した。第2に、指標症例はPCR陽性の綿棒を持った最初の世帯員と定義したが、別の世帯員がすでに感染していて指標症例に感染している可能性も否定できない。第三に、ウイルス負荷の軌跡の記録は左打ち切りの対象となり、有病者との接触者(登録時にすでにPCR陽性)の成長期が一部の参加者で見逃されていました。しかし、今回の調査では、29例の感染者と15例の追加感染者がウイルス量の増加傾向にあったことから、一部の参加者のウイルス量の増加率とピーク時のウイルス量に関する貴重な情報を得ることができました。第4に、英国のワクチン接種プログラムでは年齢が層別されているため、ワクチン未接種のデルタバリアント感染者の年齢はワクチン接種者の年齢よりも低かった。そのため、年齢が結果の交絡因子となっている可能性があり、考察したように、ピーク時のウイルス量は年齢と関連していました。しかし,ワクチン接種を受けていない接触者で観察された高いSARが,ワクチン接種を受けていないことよりも年齢の低さによって引き起こされたとは考えにくく,我々の知る限りでは,年齢の低下に伴ってSARS-CoV-2感染の感受性が高まることを示す証拠は公表されていない31。最後に、今回はウイルスの培養を行っていないが、これはRT-PCRよりも感染力の指標として優れている。他の2つの研究27, 32では、デルタ型に感染したワクチン接種者の約3分の2から培養可能なウイルスが検出されており、ワクチン接種者は、特に感染後早期にウイルス量が多くなり、ほとんどの感染が発生すると考えられる場合には、他の人に感染する可能性があるという我々の結論と一致している30。
今回の知見は、ワクチン接種率が高い集団において、deltaバリアントがどのようにして、またなぜ効果的に感染しているのかを説明するのに役立ちます。現行のワクチンはCOVID-19による重症化や死亡を防ぐのに有効であるが、今回の知見は、家庭内での感染が密接かつ長期にわたる場合には、ワクチン接種だけではデルタ型のすべての感染を防ぐのに十分ではないことを示唆している。ブースタープログラムや10代の若者へのワクチン接種によって集団免疫を高めることで、現在は限られているワクチン接種による感染防止効果を高めることができるが、今回の分析では、重症化のリスクがある人をワクチン接種や非薬理学的介入によって直接保護することが、デルタ型による疾病の負担を抑えるための中心的な役割を果たすことが示唆された。
このオンライン出版物は修正されました。訂正版は2021年11月2日にthelancet.com/infectionに初掲載されました。
貢献者
AS、JD、MZ、NMF、WB、ALalが本研究のコンセプトを提案した。AS、SH、JD、KJM、AK、JLB、MGW、ND-F、RV、RK、JF、CT、AVK、JC、VQ、EC、JSN、SH、EM、TP、HH、CL、JS、SB、JP、CA、SA、NMFがデータの収集と調査を担当しました。AS, SH, KJM, JLB, AC, NMF, ALalが正式なデータ解析を行いました。MAC, AB, DJ, SM, JE, PSF, SD, ALacが実験を担当しました。RV, RK, JF, CT, AVK, JC, VQ, EC, JSN, SH, EM, SEがプロジェクトを監督しました。AS, SH, JD, KJM, JLB, NMF, ALalはデータにアクセスして検証しました。JD、MZ、ALalが資金を獲得しました。NMFはソフトウェアの開発と管理を担当しました。ASとALalは原稿の初稿を書いた。AS, JD, GPT, MZ, NMF, SH, ALalが原稿のレビューと編集を行った。対応する著者は,本研究のすべてのデータにアクセスでき,出版物への投稿を決定する最終的な責任を負っている。
ATACCC研究の調査員
Anjna Badhan, Simon Dustan, Chitra Tejpal, Anjeli V Ketkar, Janakan Sam Narean, Sarah Hammett, Eimear McDermott, Timesh Pillay, Hamish Houston, Constanta Luca, Jada Samuel, Samuel Bremang, Samuel Evetts, John Poh, Charlotte Anderson, David Jackson, Shahjahan Miah, Joanna Ellis, Angie Lackenby.
データの共有
すべての結果を再現できるように、匿名化、非識別化されたデータセットをご要望に応じて提供します。モデリングコードは、GitHubリポジトリで公開されます。
利益宣言
NMFは、UK Medical Research Council、UK National Institute of Health Research、UK Research and Innovation、Community Jameel、Janssen Pharmaceuticals、Bill & Melinda Gates Foundation、Gavi(the Vaccine Alliance)からの助成金、世界銀行からのコンサルティング料、Wellcome Trustからの支払いまたは謝礼、WHOからの旅費、武田薬品のアドバイザリーボードへの参加、eLife誌のシニアエディターであることを報告しています。その他の著者は、競合する利害関係がないことを表明しています。
謝辞
本研究は,米国国立衛生研究所(NIHR200927),米国保健社会福祉省COVID-19 Fighting Fund award,NIHR Health Protection Research Units (HPRU) in Respiratory Infections and in Modelling and Health Economicsの支援を受けている。NMFはMRC Centre for Global Infectious Disease AnalysisおよびJameel Instituteからの資金提供を受けています。PSFとMACは,UK Dementia Research Instituteの支援を受けています。JDはNIHR HPRU in Emerging and Zoonotic Infectionsの支援を受けています。MGWはNIHR HPRU in Healthcare Associated Infections and Antimicrobial Resistanceの支援を受けています。GPTはImperial NIHR Biomedical Research Centreの支援を受けています。本研究に参加したすべての参加者、研究への参加を促してくれたPublic Health Englandのスタッフ、PCRおよびシーケンシングアッセイを実施してくれたVirus Reference Departmentのスタッフ、ワクチン接種データの分析に協力してくれたImmunisations Departmentに感謝します。また,ロジスティクス,データ入力,品質管理に携わっていただいたKristel Timcang,Mohammed Essoussi,Holly Grey,Guilia Miserocchi,Harriet Catchpole,Charlotte Williams,Niamh Nichols,Jessica Russell,Sean Nevin,Lulu Wang,Berenice Di Biase,Alice Panes,Esther Barrow,Lauren Edmundsに感謝します。インペリアル・カレッジ・ロンドンのMolecular Diagnostics Unit、特にLucy Mosscrop、Carolina Rosadas de Oliveira、Patricia Watberには、RNA抽出、定量的RT-PCR、およびシーケンス用サンプルの準備を行っていただきました。
この記事が気に入ったらサポートをしてみませんか?
