
光化学の流行
光を使った化学がトレンドです。 私自身も近赤外光を吸収する粒子(アップコンバージョンナノ粒子; 後述)を合成する研究に携わっていた時期がほんの少し(卒業研究)だけあります。基礎から段階を追って説明します。
エネルギーの変換=光として
私が化学(≒物質の学問)の重要な視点として考えているものの一つはエネルギーです(重要な視点については以下の記事)。
エネルギーと物質は, いくつかの異なる側面を持つ概念です。物質は原子から構成され, 質量・「形」があるものですが, エネルギーは「形」を持ちません。ただし, 注目すべき点は、物質は固有の化学エネルギーを持っています。この点でアインシュタインの有名な$${E=mc^2}$$(Eはエネルギー, mは質量, cは光速)という式が関係しています。この式は質量とエネルギー、すなわち物質とエネルギーの間には密接なつながりがあることを示唆しています。
一般に, エネルギーは以下のような特徴を持っています。
① 物質ごとにエネルギーの大きさが違う
② エネルギーの総量は変化しない(エネルギー保存則)
③ エネルギーは変換される
特に③に関しては以下の図のように化学エネルギーからさまざまな形態のエネルギーへと変換されることをおさえると良いです。通常, 高校では熱エネルギーへの変換を中心に扱います。電気エネルギーへの変換はあまりエネルギーという視点では扱わないことが多い気がします。そして, 光エネルギーに関しては高校化学ではマイナーな分野になってしまっています。しかし, 光エネルギーに関しても冒頭で述べたように研究現場でホットな内容になっています。

光の基本知識
光は波の性質もありますが, 同時に粒子としての性質も持っています(光の二重性)。粒子は光子とよばれ, 光子1つのエネルギーは以下の関係式が成り立ちます。$${\epsilon=\frac{hc}{\lambda}}$$
ただし, $${\epsilon}$$: 光子1つのエネルギー, h: プランク定数, cは光速, $${\lambda}$$は波長です。すなわち, エネルギーと波長は反比例の関係にあります。
物質が光を吸収する前はその物質の電子の軌道は基底状態と呼ばれる最もエネルギーが低く安定な状態になっています。光を吸収するとその分エネルギーが増加して励起状態になります。そのときのエネルギー差も上の式同様にして, $${\Delta E=\frac{hc}{\lambda}}$$となります。
波長と光の種類(可視光の場合は色)の対応は下のようになっています。知っておいた方が良いです。
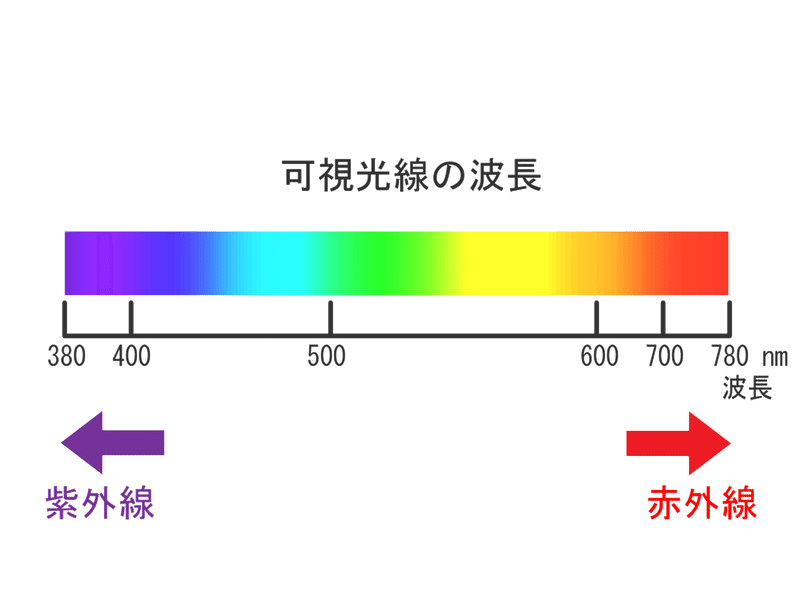
高校教科書にある内容
高校の化学の教科書では光に関する記述はどうなっているのでしょうか?以下のようにまとめられます。
光化学反応: 光によって化学反応が起こる
(例) 水素と塩素から塩化水素ができる(連鎖反応)
化学発光: 化学反応によって光が発生する
(例) ルミノール反応 (血液中の鉄イオンが触媒としてはたらきルミノールが過酸化水素等で酸化される反応で青い光を発する)
⇒ 要するに上2つは正反対の関係と思うと良いです。
感光性: ハロゲン化銀(特にAgBr); Agの生成; 写真のフィルムに利用
光触媒: 酸化チタン(Ⅳ) TiO2
あまり内容は多くなく, 地味な内容ですが最低限上記内容は知っておきましょう。
光化学の法則
これだけだと光化学についてよくわからない状態だと思うのでもう少しずつ深めてみましょう。まずは光化学の法則から。
第一法則: Grotthus-Draperの法則
光反応は物質に吸収されることによって起きまず。特定の波長の光のみを分子は吸収できるので, 光反応では光の波長が重要であるという法則です。
Lambert-Beerの法則
$${A=-{\rm log}(\frac{I_1}{I_0})=\epsilon cl}$$ ただし, $${A}$$: 吸光度, $${I_0, I_1}$$: 入射光の強度, 透過光の強度, $${\epsilon}$$: モル吸光係数, $${c}$$: 媒質のモル濃度, $${l}$$: 媒質の長さ を表す。つまり, 試料の濃度が大きくなるほど, あるいは容器(セル)が長いほど光を吸収するということです。(後述の入試問題2023共通テスト参照)

Stark-Einsteinの法則(光化学第二法則)
1分子は1光子(上述のように光の粒子のこと)を吸収することで光化学反応が起こるという法則です。
Franck-Condonの原理
大雑把に言うと, 光吸収や発光における状態(例 基底状態と励起状態)の遷移に要する時間は分子振動の時間より断然短いため, 遷移の間, 分子(原子核)は静止しているとみなしてよいという原理です。
Kashaの法則
原則, 発光の際は分子は一番低い励起状態から基底状態に戻ろうとします。励起状態はエネルギーが大きい分には複数の状態となれるわけですが, 光化学反応に関与するのは基本的に一番低い励起状態(一番基底状態とのエネルギー差が小さいもの)ということです。
光化学の話題
色とは何か
人間が色を見えるのはなぜなのでしょうか。複数の要因がありますが, 基本的に, 物質が光に当たったとき, 物質が吸収せず反射した光の波長が可視光領域にあると我々の目に映るようになります(目の錐体細胞から視神経に行って脳で情報が伝わる)。
例えば植物は緑っぽく見えるのは, 葉緑体の中のクロロフィルが赤の光を吸収し, 吸収されない緑の光が反射されるためです。クロロフィルは以下のような構造をしています。
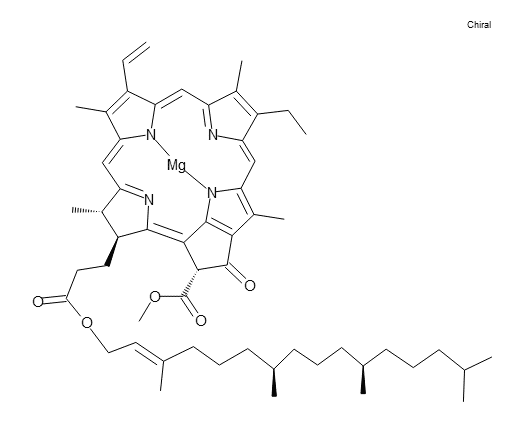
大きな環状構造で、かつ二重結合・単結合が交互に並んだ共役系では色を示すことが多いです(さらに金属錯体も色を示すことが多いです)。
昔は量子化学なんて何のためにやるだろうと思っていましたが、ある日以下の問題を解いて、「すごいじゃん」という気持ちになりました。量子化学が色が密接に関わっているなら身近じゃんということで勉強する気になれたかなという感じです。
<問> β-カロテン(C40H56)は2つの環構造を持ち、その環構造の間は直線状の共役ポリエンとなっており, 11個の二重結合を持つ, 全長1.85 nmの炭素原子22個の鎖となっている。共役系を電子が自由に移動するとき, この電子の吸収する光の波長(すなわちβ-カロテンの吸収する光の波長)はいくらか。ただし, 一次元の井戸型ポテンシャルモデルに従うものとして解け。
<解> β-カロテンの$${\pi}$$電子共役系の全長a=1.85 nmである。β-カロテン1分子あたり11個のπ結合が存在する(π電子は22個)。いま, 井戸型ポテンシャルの大きさはaに相当する。HOMOの量子数が11であり, LUMOの量子数が12となるので, エネルギー差は, $${\Delta E=E_{12}-E_{11}=\frac{12^2 h^2}{8ma^2}-\frac{11^2 h^2}{8ma^2}=\frac{23h^2}{8ma^2}}$$となる。これがβ-カロテンの吸収する分のエネルギーに相当する。吸収波長をλとすると, $${\lambda=\frac{hc}{\Delta E}=\frac{8cma^2}{23h}}$$となるので, aに上述の数値, h: プランク定数(6.63×10^(-34), m: 電子の質量9.11×10^(-31) kg, c: 光速(3.00×10^8 m/s)を代入する。そうすると,λ=491 nmとなる。つまり青色を吸収する。したがってβ-カロテンを豊富に含むもの(例 人参)は赤橙色に見えることが多い。
※ 注1 $${E_n= \frac{n^2 h^2}{8ma^2}}$$はシュレーディンガー方程式を解くことによって得られる。
※ 注2 共役ポリ円の吸収波長の鎖長依存性…鎖長が長くなるにつれ, 励起に必要とするエネルギーは小さくなり, 吸収波長はエネルギーに反比例するので, 吸収波長は長くなる。
熱の反応 vs 光化学反応
有機電子論(矢印を使って反応機構を書くようなやつ)だけで説明しきれない有機化学反応の例としてペリ環状反応があります。量子化学・軌道の理解を通して考えないといけないわけです。私がこの反応で面白いと思ったのは熱反応許容・光反応禁制の反応とその逆の反応があることです。例えばペリ環状反応のうち, 電子環状反応(例 ブタジエン→シクロブタン)の場合, 電子の総数によって場合分けが生じます。電子数が4nで表せる場合, 同旋過程では熱反応許容・光反応禁制, 逆旋過程では熱反応禁制・光反応許容となり, 電子数が4n+2で表せる場合はその逆になります(ついている官能基の立体異性体を考える場合は同旋過程, 逆旋過程で違うものになります; 例えば2, 4-ヘキサジエンの場合, 電子数が4=4×1のため, 加熱で同旋的回転が起こりtrans-3,4-ジメチルブテンが生じるが, 紫外線照射で逆旋的回転が起こりcis-3,4-ジメチルブテンが生じる)。詳しくはフロンティア軌道論で見てみると良いでしょう。
フォトクロミズム
昔, 文化祭などで演示実験をしていたとき, 人気だったのはやはり色が変化する反応でした。変「化」は「化」学の一つの醍醐味ですね。色が変化する反応は酸塩基を利用するもの, 酸化還元を利用するものもありますが, フォトクロミズムは光を利用するものです。スピロピランを利用します。詳しい内容は後輩がwebサイトにまとめており, そのリンクを上に掲載したのでそちらをご覧ください。
光触媒
酸化チタンが光触媒として使えることは主に日本人研究者(藤嶋-本多)によって研究されてきたわけですが, 現在では光触媒をコーティングした商品として空気清浄機, 浄水用フィルター, 自動車のミラー, 抗菌タイルなどに利用されています。原理としては調べたところ以下のような感じです。
TiO2に限らず、一般に結晶はバンド構造と呼ばれるエネルギー構造をもっており、電子がつまったバンドと電子がはいっていないバンド、両者のあいだのバンドギャップから構成されています。光の吸収で電子が励起されて電子がはいっていないバンドに移ります。光のエネルギーを吸収して電子が励起されたとき、正孔という電子が抜けた穴が残ります。正孔は電子とは逆の性質をもっており、電子が何らかの化学物質に移動すると還元が起こりますが、正孔が化学物質に移動すると酸化が起こります。光触媒反応では、電子と正孔がそれぞれ移動することで酸化還元反応が起こるのが特徴です。例えば酸素はTiO2中の電子と結合しスーパーオキシドアニオンができる一方、水と正孔が結合し、ヒドロキシ(ル)ラジカルが生成します。どちらも活性酸素として知られているもので反応性が高いため, 上述のような用途として利用できるわけです。
最近ホットな内容はこれ?
Chem-stationでも光化学セミナーがたびたび開かれています(数回セミナーは聴講しました)。あくまでも自分が個人的にホットだと思っている内容を以下に紹介します。
量子ドット
2023年のノーベル化学賞ですね。有機溶媒中で材料(Cd, Seなど)を入れて加熱する(結構高温にします)と原子が複数集合し数nm程度の大きさの粒子ができます(以下のUCNPも同様の作り方をします; 個人的には再現性がとれるように品質を安定化させるのは難しい印象があります; シュレンクラインなどを使って窒素雰囲気にして作製するのかなって感じです; 最近は別の作製方法も報告されているみたいです)。透過型電子顕微鏡(TEM)などで観察可能です。この粒子にある波長の光を照射しますと, 光を吸収し, 照射した波長より高い波長の光を発光します。サイズを小さくすると, 発光強度がより強くなります。工夫としてCore/Shell構造にしたり, 親水性リガンドを付けたりすることがあります。
応用例としてはバイオマーカー,ディスプレイ用発光素子,レーザー,太陽電池などが挙げられます。結構幅広い用途がありますね。
色付きガラス(ステンドグラス)の導入が面白かったです。
あとは試薬会社のSigma Aldrich社のサイトなどに詳しく書いてあります。
アップコンバージョン粒子(UCNP)
通常の蛍光発光では, 熱の放出によりエネルギーが低下するので短波長の光を吸収し長波長の光を発光します(ストークスの法則)。しかし, アップコンバージョン現象では逆にエネルギーの低い長波長の光を吸収しエネルギーの高い短波長の光を発光します。
この「エネルギーがより高い光を発する」現象は物理学的にも普通と違っていて面白いですが, この現象, そしてアップコンバージョンが起こるナノ粒子(UCNP)が「何に使えて嬉しい」のかというと, UCNPの励起光として用いる近赤外光は, ヘモグロビンや水による光吸収が小さいため生体組織の透過性が高い「生体の窓」とも呼ばれる波長域であり,生体深部での利用が可能だということです。UCNPは退色しづらくそれ自体の毒性も少なく(*),さらに発光波長は自在に調節可能であることも多いです。このような特性を活かし,UCNPを生体深部の非侵襲イメージングへ応用する研究も積極的に行われています。
UCNP自体は色々な種類があります。この辺はChem-Stationで「アップコンバージョン」と調べた方がよりさまざまな種類を比較できて良いでしょう。
ここで具体的なアップコンバージョンナノ粒子を一つ紹介すると, 自分自身が昔関与していたのはランタニドナノ粒子と呼ばれるものでした。NaYF4, NaGdF4, LiYF4などの金属化合物をホスト金属化合物とし, そこにYb, Tm, Nd, Er, Hoなどの様々なランタニドイオンをドープする構成をしています(濃度消光を防ぐために, 何かしらの工夫がある構成をしていることが多いのですが今回は割愛)。典型的なアップコンバージョンでは主に増感剤 (ドナー), 発光剤または活性剤 (アクセプター) と呼ばれる化学種が関わっています。
もっと詳しく説明すると以下の通りです。
まず, 光照射によって増感剤が励起され, 項間交差を通じて励起三重項状態になります。次に, 増感剤から発光剤への三重項エネルギー移動が生じ, 発光剤は励起三重項状態となります(増感剤は基底状態に戻る)。励起された発光剤の分子が溶液中で拡散し, 2つの分子が衝突することで三重項-三重項消滅が生じ, 発光剤はよりエネルギーの高い励起一重項状態となります。最終的に励起一重項状態から発光しますが, この光は励起光より大きなエネルギーを有する短波長の光となります(図)。

アップコンバージョンにおいて増感剤・発光剤となる化学種としてランタニド元素が利用されている理由の一つとしては, 基底状態から励起三重項状態への項間交差の効率が高いからです。一般的な遷移金属がd軌道に空軌道を持つのに対して, ランタニド元素は4f軌道に空軌道があり, より外側にある5s, 5p軌道の電子は充満しています。ランタニド元素は通常3価で安定となるものが多く, ランタニドイオン(3価)では5d, 5f軌道の電子が失われますが, 4f軌道の外側の5s, 5p軌道は残ります。そのため, クーロン相互作用やスピン軌道相互作用により分裂した4f軌道の間で遷移が起こります。さらに, ランタニドイオンでは5s電子, 5p電子が4f電子に対して遮蔽し, イオン周辺の電場・磁場や振動, 溶媒効果の影響が弱まります。結果として, ランタニドイオンでは観察されるスペクトルの幅はシャープで, 光放射に伴う熱は少ないです。例えばイッテルビウム(Yb)を増感剤とし, 発光剤としてエルビウム(Er), ツリウム(Tm)を用いると, 2F7/2と2F5/2の軌道間のエネルギー差である980 nmの近赤外光を照射した場合に, 観測されるスペクトルはそれぞれ 540 nm(緑), 474 nm(青) となります。
(*)…余談ですが, 私の研究背景では「量子ドットはCd, Pb, Hgを含んでいることが多く生体適合性が低いためバイオイメージング/オプトジェネティクスには不向き⇒代替案」という感じでした。
光化学をテーマにした入試問題
最先端(流行り)が入試問題に反映されることもしばしばです。
信州大2020後期 大問1
(※ 問題・解答は信州大学のホームページよりダウンロードできます)
(1)で光の波長と名称(可視光線, 紫外線, 赤外線)を答えさせ, (3)で化学発光と光化学反応の違い, 基底状態・励起状態の違い, TiO2の光触媒や塩素ラジカルの連鎖反応についての穴埋め問題を出し, (5)で炎色反応を出しています。熱化学方程式の話があったり, エネルギーの対応も図から読み取れたりするので比較的平易で良問です。
東京医科歯科大 2016年大問2/2019年大問3
(※ 問題は各自入手してください)
結構ガッツリ聞かれています。2016年の問題では蛍の話題から始まり、ルシフェラーぜ、ルミノール反応、シュウ酸ジフェニル誘導体、テトラセン・ルブレンなど。ルミノールの分子式(問1)は構造式を見ればわかるし, 発生する気体が窒素なのも予想は容易にできますが, 問6, 問7になってくるとだいぶ答えにくいです。さらに、2019年の問題でも共役系と吸収波長の関係、β-カロテン→レチナールへの変換、フェノールフタレインがなぜ指示薬として使えるかが問われています。フェノールフタレインに関してはそれ自身が1価の酸で電離平衡が成り立っているのでそこから変色域を求める問題は解く価値あります(意味を教えれば生徒も面白いと思うみたいです)。
共通テスト 2023年第5問問3/2021年第二問
以下のリンクにある通り。2023年の問題自体は前提知識が要らず文章を読めば良い問題なので, 時間がありそれなりに地頭の良い人なら解けるでしょう。試験として良いのかは微妙ですが。ただ, こういう初見の問題の題材として光化学的な内容を選んでいるのは注目に値します。
共通テストで光化学のネタが問われたのは2023年に限ったことではありません。2021年の問題でも光がテーマでした。
シュウ酸イオンを配位子とした鉄の錯イオンの光化学反応についての問題です。aは無機化学のFe2+, Fe3+の違い判別(頻出)なので長い文章は関係ありません。b, cについてはmol計算なので, これについてもあまり光化学反応である必要はありません……(cみたいな「収率の計算」は高校化学ではあまり話題になりませんのでおやっと思う可能性はありますが実際の研究や学生実験では絶対にやる計算なのでできてほしいなとは思います)。
この記事が気に入ったらサポートをしてみませんか?
