母親の高脂肪食は、腸内炎症の活性化を介して子孫の大腸がん感受性を高める
Front. ニュートラ、2023年5月12日
Sec. クリニカルニュートリション
第10巻 - 2023年|https://doi.org/10.3389/fnut.2023.1191206
この記事は、研究テーマの一部です。
女性児童・思春期の栄養・食事と内分泌学的健康について
すべての記事を見る
母親の高脂肪食は、腸内炎症の活性化を介して子孫の大腸がん感受性を高める
https://www.frontiersin.org/articles/10.3389/fnut.2023.1191206/full

鄭世民1,2、尹建彬2,3、赫悦1,2*、李麗甫1,2*。
1南方医科大学第三付属病院消化器肝臓科(中国・広州市
2南方医科大学第三臨床医学院、広州、中国
3南方医科大学第三付属病院整形外科(中国広州市
高脂肪食は大腸がんの発症に重要な役割を果たし、この腸への影響は高脂肪食の母親の子孫にも起こりうる。本総説では、大腸がんの発症における高脂肪食の役割について述べ、母親の高脂肪食が子孫の炎症の活性化および大腸がんの発症に及ぼす影響についてまとめた。これまでの研究で、母親の高脂肪食は、主に妊娠中の母親自身と子孫の両方の大腸組織において炎症反応を誘導することが分かっています。これにより、大腸組織に炎症性細胞が蓄積され、炎症性サイトカインが放出され、さらにNF-κbや関連する炎症性シグナル伝達経路が活性化されます。研究によると、高脂肪食の母親から摂取した高濃度の脂質や炎症因子が経胎盤ルートで子孫に渡され、大腸の炎症が誘発され、腸の微細生態構造や腸管バリアが損なわれ、子孫の腸の発達が妨げられる。その結果、NF-κbや関連するシグナル伝達経路が活性化され、腸の炎症がさらに悪化する。このような炎症刺激と修復を繰り返す過程で、子孫の大腸粘膜細胞の無秩序な増殖が促進され、大腸がんへの感受性が高まると考えられます。
はじめに
大腸がん(CRC)は、消化管の一般的な悪性腫瘍である。2020年に世界保健機関(WHO)が発表した世界のがん統計によると、CRCは3番目に多く診断されるがん(発生率:10.0%)、2番目に死亡率の高いがん(死亡率:9.4%)となっています(1)。2030年までにCRCの発生率は60%増加し、~220万人が罹患すると推定されています(2)。CRCは、発がんプロセスに基づいて、腺腫に由来するタイプと炎症に関連するタイプの2つに大きく分けることができます(3)。特に、腺腫由来のCRCと炎症に伴うCRCのいずれにおいても、CRCの発症過程では、炎症と細胞増殖の継続的な刺激が持続することが知られています(4)。しかし、CRCの発症機序はまだ明らかになっておらず、大腸の炎症を引き起こすような外的危険因子があれば、CRCの発症・進展につながる可能性があります。
肥満は世界共通の公衆衛生上の問題であり、がんの主要な危険因子として認識されています(5)。米国では、2011年から2015年にかけて、30歳以上の患者における男性がん症例の5%、女性がん症例の10%が肥満と関連していました(6)。複数の研究により、肥満がCRCのリスクを高めることが判明しています(7-9)。肥満は、脂質代謝障害を伴う食事性脂肪の過剰摂取が主な原因であり、しばしば全身性の炎症を引き起こし、炎症後の細胞修復の過程では、継続的な細胞増殖が伴うとされています。この高脂肪食による炎症は、CRCの発症・進展と密接に関連していることが示唆されています。さらに、母親の高脂肪食は、子孫の悪性腫瘍の発生率を増加させることが示されている(表1)。これまでの研究で、高脂肪食を摂取している母親の子孫に乳がんのリスク上昇が認められ、高脂肪食を摂取している乳がん患者の子孫に腫瘍再発のリスク上昇が認められました(10、11)。また、母親の高脂肪食が子孫の膵臓がんや原発性肝がん(12-14)、大腸炎やCRC(15)の危険因子であることが研究で示されている。この知見は、CRCの病態や治療法を深く追究する上で大きな意味を持つ。
表1
表1. 両親の高脂肪食と子孫の悪性腫瘍の関係に関する研究
本レビューでは、「高脂肪食」または「肥満」、「子孫」、「大腸」をキーワードに、2000年から2023年までのPubmedサイト1上の文献をまとめました。我々は、子孫の大腸炎症活性化と発がんにおける母親の高脂肪食の役割を要約し、子孫のCRC発症に関与する可能性のあるメディエーターとシグナル伝達経路を推測しています。このレビューでは、母親の高脂肪食が誘発する子孫のCRC発症は、おそらく腸内炎症の活性化によって媒介されていることを強調しています。このレビューは、大腸の健康と病気における高脂肪食の役割と、CRCの発生と進行におけるその作用機序を探るものである。母親の食事構造の改善と高脂肪食の長期摂取の回避は、子孫のCRCを予防するために必要な措置であると考えられる。高脂肪食は腸の炎症を活性化させ、母体のCRCを促進する
高脂肪食はCRCの発症率上昇と関連している(16, 17)。参加者を最長10年間追跡調査したCRCの危険因子に関する研究のメタアナリシスでは、脂質値が異常に高い参加者は、脂質値が正常な参加者と比較してCRCのリスクが有意に高いことが示されました(18)。初期の研究では、飽和脂肪酸の摂取量が多いとCRCや前がん病変のリスクが高まること、動物性脂肪の摂取量はCRCのリスクと正の相関があることが判明しています(19、20)。LiuらもCRC患者のレトロスペクティブ・コホート研究でこの所見を確認した(21)。また、別の研究では、発がん性物質への同じ曝露条件下で、高脂肪食マウスの大腸細胞は、正常食マウスの大腸細胞に比べて活発に増殖し、腸管陰窩細胞関連増殖因子Ki67のレベルが上昇することが示された(22)。また、高脂肪食に暴露された大腸組織では、幹細胞マーカーの発現量が上昇し、がん化する傾向が顕著に見られたという研究結果もある(23、24)。
高脂肪食による大腸発癌のしやすさは、炎症性サイトカインの血清レベルの上昇によって引き起こされる炎症と関連している可能性がある(25)。慢性炎症は、細胞の増殖や修復を促進し、細胞の過剰増殖や悪性化を誘導する可能性があることが示されている(26)。ある研究では、デキストラン硫酸ナトリウム(DSS)処理下で、高脂肪食マウスの大腸組織において、炎症性サイトカインのインターロイキン(IL)-1β、IL-6、腫瘍壊死因子(TNF)のレベルが通常食のマウスと比較して著しく上昇することがわかった(27)。特に、DSSを含まない高脂肪食を与えたマウスでは、大腸の炎症性サイトカインのレベルも通常食のマウスと比較して有意に上昇した(28)。IL-1β、IL-6、TNFは、マクロファージから分泌される炎症性サイトカインである。我々の以前の研究では、発がん性薬剤や炎症性薬剤を投与しない高脂肪食を与えたマウスは、内臓脂肪の蓄積、大腸の長さの減少、大腸組織におけるマクロファージと腫瘍幹細胞マーカーCD133およびCD44のレベルの有意な上昇を示した(29). この結果は、高脂肪食が大腸の炎症を促進し、CRCの発症を誘発する可能性があることを確認した。
以上の報告から、腸の炎症は高脂肪食のCRC誘導メカニズムにおける重要なステップであると考えられる。重要な免疫細胞であるマクロファージは、炎症性サイトカインであるIL-1β、IL-6、TNFを分泌し、これらはCRCの発症に関わる重要なシグナル伝達経路であるNF-κb経路に関与しています(30)。また、高脂肪食はしばしば腸内細菌異常を引き起こし、腸管粘膜バリアを損傷する。その結果、炎症反応が起こり、循環するリポポリサッカライドとTNF-αのレベルが上昇し、その両方がさらにNF-κb経路を活性化する(31)。NF-κb経路は炎症反応を制御しており、このシグナル伝達経路の活性化は、高脂肪食に関連した炎症反応がCRCの発症と発達を促進するメカニズムであると考えられる。このように、高脂肪食による炎症は、関連するシグナル伝達経路を活性化し、さらに腸管バリアーを破壊していく。腸粘膜の継続的な増殖と修復の過程で、大腸粘膜細胞の無秩序な増殖が起こり、それが腫瘍幹細胞の増殖を誘導し、最終的にCRCに至る可能性があります。本テンプレートの「スタイル」タブで確認できるように、原稿に最大5つの見出しレベルを挿入することができます。これらの書式スタイルはガイドとして意図されており、見出しレベルが明確である限り、組版時にFrontiersスタイルが適用されます。母親の高脂肪食が子孫の脂質代謝障害を引き起こす
高脂肪食は、両親の血中脂質濃度を上昇させ内臓脂肪蓄積を引き起こすだけでなく、妊娠中の子孫の脂質代謝にも影響を及ぼす。妊娠中の母親の肥満や体重増加は、乳児の肥満などの有害なアウトカムのリスクを高めることが疫学的研究でわかっており(32-35)、肥満のある子どもは生涯肥満になりやすく、健康や寿命が損なわれる(36)。肥満や代謝異常には遺伝的素因があり、妊娠中に高脂肪食を摂取した母親から生まれた赤ちゃんは、メタボリックシンドロームを発症しやすく、体重増加や脂質値の上昇を示し、成人期まで続く可能性があることがほとんどの研究で確認されています(36-39)。動物実験でも同様の結果が得られており、高脂肪食を与えたマウスの子どもは、通常食を与えたマウスの子どもよりも新生児肥満を発症しやすいことが分かっています。妊娠中のマウスに高脂肪食を与えると、その子孫は通常の食事を与えた後でも、内臓脂肪の蓄積や血中脂質の上昇などの著しい代謝異常が見られた。また、その孫に通常食を与えた場合にも同様の影響が見られた。また、子孫のマウスでは、腹膜前脂肪沈着と全身性の炎症が認められました(25)。他の研究では、母親の高脂肪食が子孫マウスの全身性炎症と肝脂肪症のリスクファクターであることが判明している(40)。Wangらは、これらの子孫マウスが脂質代謝の障害だけでなく、肝臓の脂肪変性や腸内フローラの乱れを有することを明らかにした(41)。以上の研究から、母体の高脂肪食が子孫の脂質代謝に大きな影響を与え、脂質値の上昇、多臓器への脂肪蓄積、全身の炎症につながることがわかりました。
また、腸内フローラも脂質代謝障害に重要な役割を果たします。高脂肪食は腸内フローラに強く影響し、腸内フローラはさらに、脂質代謝のプロセスにフィードバック効果をもたらします。腸内微生物は脂肪細胞の機能を調節し、宿主の栄養摂取と代謝に影響を与え、体内のエネルギーバランスを調整することができる(42)。高脂肪食はしばしば腸内細菌症を引き起こし(43、44)、その結果、脂肪細胞の調節不全によって宿主のエネルギーバランスを崩し、脂質代謝障害をさらに促進する可能性があります。複数の研究において、母親の高脂肪食群の子や孫の腸内細菌組成は、対照群と異なっていた(25、27、45)。高脂肪食を与えたマウスの子孫の腸内フローラの変化は、主に腸内の高脂肪環境に関連するファーミキューテス(主にラクトコッカス)の存在量の増加、γ-プロテオバクテリア(主にエシェリシア)の存在量の減少、βプロテオバクテリア(主にコマモナス)の存在量の一部増加として表れた(46)。さらに、プロバイオティクスを投与したマウスの子孫は、高脂肪食を与えたマウスの子孫と比較して、腸内細菌叢の組成が改善し、腸内微生物機能が向上し、体重と脂質値が有意に減少した(47)。このことから、母親の高脂肪食による子孫の腸内フローラの変化が、子孫の脂質代謝異常の促進に重要な役割を果たすと結論づけられる。
母親の高脂肪食によって引き起こされる子孫の脂質代謝異常の正確なメカニズムは明らかでない。研究によると、妊婦のエネルギーの一部が胎児に脂肪として変換され、蓄積されることが分かっています。代謝異常の既往症や妊娠中に発症した代謝異常のある母親は、血中脂質濃度が高くなります。この代謝のアンバランスが、妊娠中の胎児の過剰なエネルギー蓄積につながります。妊娠中の代謝異常によるインスリン抵抗性は、母体の血糖値や血中脂質値をさらに上昇させ、グルコース、トリグリセリド、脂肪酸の胎児への過剰な経胎盤移行をもたらす(48)。胎盤は母体と胎児の間で栄養と老廃物の交換を行う重要な器官であるため、母体の栄養と胎盤の状態は胎児の成長と発達を調節する上で重要な役割を果たす(49、50)。母体循環中の脂肪酸は、経胎盤移行により胎児循環に移行する可能性がある(51)。Zhuらは、肥満の雌牛の胎児は、正常な雌牛の胎児と比較して、循環する遊離脂肪酸、コレステロール、トリグリセリドのレベルが有意に上昇していることを発見した(52)。母体の脂質代謝の障害は、経胎盤ルートで胎児のエネルギー代謝に影響を与え、子孫に脂質代謝障害を引き起こす可能性がある。また、母親の肥満は、胎盤機能の低下により、胎盤におけるグルコースおよびアミノ酸トランスポーターの転写量の増加を引き起こす(53、54)。胎盤機能の低下は、子孫の代謝異常も引き起こす可能性があります。母親の高脂肪食は、胎盤において酸化ストレスなどの一連の炎症反応を誘発する(55)。胎盤で活性化したマクロファージは胎盤の血管を調節し、血管の成熟度の低下と胎盤の血流低下をもたらす(52、53)。これはさらに胎盤の低酸素と炎症反応を悪化させ、胎盤の不適応と胎盤機能の障害をもたらす(31)。臍帯由来の間葉系幹細胞を分離した研究では、遺伝性肥満の乳児は幹細胞の脂肪酸代謝が低下しており(56)、これが胎盤機能の低下の現れと考えられる。
以上の研究から、母親の高脂肪食は、高レベルの脂質が胎児循環に移行する経胎盤輸送を介して、子孫の脂質代謝を乱すことが示唆された。また、子孫の代謝異常は胎盤機能と関連している可能性がある。母体の脂質代謝の乱れは胎盤の炎症を活性化し、胎盤機能を損傷させ、ひいては子孫の脂質代謝を障害する。また、母体の脂質代謝障害による腸内細菌症は、子孫の腸内生態にも反映され、子孫の脂質代謝にさらに影響を及ぼす。しかし、母親の高脂肪食によって引き起こされる子孫の脂質代謝異常の具体的なメカニズムについては、まだ明らかにする必要がある。母親の高脂肪食は腸の炎症を引き起こし、子孫の腸粘膜の上皮バリア機能を損傷させる。
母親の高脂肪食は、子孫の脂質代謝を乱し、腸炎への感受性を高め、子孫の腸炎の早期発症を促進することが示されている(57)。例えば、Xieらは、高脂肪食を与えたマウスの子孫は、出生時から普通食を与えていたにもかかわらず、成人後にDSSによる大腸炎を起こしやすいことを示した(27)。さらに、これらの高脂肪食を与えたマウスの子孫の腸は、炎症性サイトカインであるTNF-α、インターフェロン(IFN)-γ、IL-1β、IL-12、IL-6、IL-17、IL-22のmRNA発現量の増加と抗炎症サイトカインであるIL-10のmRNA発現量の減少とともに重度の腸管潰瘍を示した。普通食を与えたマウスの子孫と比較して、これらの子孫は体重減少が大きく、疾患活動指数が高く、大腸が有意に短く、腸の透過性と炎症が大きく、生存率が有意に低かった(58、59)。ヒツジでは、高脂肪食を与えた両親の循環液中の炎症性サイトカインとケモカインのレベルが上昇したことに加え、その胎児の大腸組織では炎症性シグナルタンパク質をコードする遺伝子の発現レベルが上昇し、その結果、出生後の腸管透過性が上昇した。また、これらの子孫は、腸のコンパクトジャンクションタンパク質の発現レベルの低下、杯細胞密度の低下、回腸絨毛-クリプト比の低下を示した(60)。Xueらは、高脂肪食を与えたマウスの16週齢の子孫を調査し、通常食のマウスと比較して、血清および腸内の炎症因子のレベルが有意に増加し、腸管バリア上皮のタイトジャンクション蛋白のレベルが減少していることを見出した。形態学的には、回腸のカップセル数および腸上皮絨毛の高さが減少し、腸陰窩の深さが増加した。絨毛-陰窩比の低下は腸粘膜の損傷を示唆した(61)。Xieらは、高脂肪食を与えたマウスの3週齢の子供を調査し、腸組織におけるタイトジャンクション蛋白の発現が阻害され、その膜局在も変化していることを明らかにした。また、腸内のIgA発現細胞やSIgA量が有意に減少し、炎症性サイトカインであるIL-6やTNF-αの濃度が有意に上昇した。(27)この一連の研究により、母親の高脂肪食が子孫に腸の炎症を誘発し、腸の粘膜バリアを損傷させることが確認された。
母親の高脂肪食は、腸内フローラの垂直伝播による乱れを通じて、腸内炎症の進行を促進し、子孫の腸内発がんを誘発する可能性があります。腸内フローラの確立は胎児期から始まる。腸内微生物の状態は母親から子孫に直接伝えられることが研究でわかっており、この腸内コロニー形成は胎児の子宮内発育、分娩、授乳期にしばしば起こる(62、63)。高脂肪食を与えた親から子への腸内フローラ障害の移行は、子における遺伝的な高脂質レベルと関連していると考えられる(64, 65)。Gohirらは、高脂肪食を与えた親の子孫の腸の発達異常が、腸のミクロエコロジー障害を誘発することも発見した(31)。これらの知見は、Barbosaらが提唱した「遺伝性腸内フローラ障害」という現象と一致し、高脂肪食を与えた親の子孫に見られる腸炎感受性の上昇の理由の一つとも考えられる。腸内フローラは、腸内環境の重要な一部として、腸管バリアや脂質代謝の調節に深く関与しています。高脂肪食は腸内細菌異常を引き起こし、大腸の炎症、さらには発がんを促進する(66, 67)。これらの子孫は、乱れた腸内細菌叢の代謝産物によって引き起こされる損傷した腸バリアを示し、これも腸の炎症や発癌の感受性を高める。母親の高脂肪食が子孫のCRC感受性を高める
高脂肪食を摂取した母親の子孫は、通常の食事を摂取した母親の子孫と比較して、乳がん、膵臓がん、CRCなどのがんのリスクが増加することが知られています(10-14)。米国で行われた大規模な前向きコホート研究では、母親の肥満と妊娠中の体重増加が子孫のCRCの重要な危険因子であることがわかりました(15)。多くの動物実験で、母親の高脂肪食が子孫に内臓脂肪の蓄積を引き起こすことが判明している(68、69)。この内臓脂肪の蓄積は、ひいてはCRCおよびがん関連死のリスクを有意に増加させる(70)。母親の高脂肪食が子孫にCRCを引き起こす具体的なメカニズムはまだ不明であるが、上記の研究は、母親の高脂肪食が子孫に脂質代謝障害と腸の炎症を引き起こすことを確認した。したがって、子孫の腸がんに対する感受性が高まるのは、脂質代謝の障害に起因している可能性がある。
胎児の腸の成長・発達は妊娠中に始まる。母親の高脂肪食は、炎症を通じて子孫の腸の成長・発達に影響を与える可能性がある。ラットにおいて、母親の高脂肪食は腸の炎症因子のレベルを増加させるだけでなく、子孫の腸の組織形態を著しく変化させることが明らかにされた(71)。高脂肪食による胎盤の酸化ストレスは、胎盤の血管を損傷し、胎盤低酸素を誘発するだけでなく、胎盤機能を低下させ、胎児の腸の成長・発達に影響を与えることが研究で示されている(31)。Xieらは、高脂肪食を与えたマウスの3週齢の子孫の絨毛長および陰窩深さが、通常食を与えたマウスのそれよりも有意に小さいことを発見した(27)。腸管陰窩に存在する腸管多能性幹細胞は、様々なタイプの成熟腸管細胞に分化することができる。3週齢のマウスのクリプト深度が浅いのは、胎児期の腸の発達が制限されているためかもしれない。しかし、授乳により腸管幹細胞の増殖が促進され、離乳期のストレス下でさらに急速に分化し、最終的には腸管陰窩の深さが増加し、腸絨毛の高さが減少することが確認された。(72) Xueらは、高脂肪食を与えたマウスの16週齢の子孫において、腸上皮絨毛の高さが減少し、腸陰窩の深さが増加することを発見した(27)。これらのことから、胎盤や授乳などの母体因子の影響を受けずとも、離乳後の子孫の腸の成長・発達は継続的に制御されていることが示唆される。高脂肪食により細胞の増殖・分化の過程が促進され、未熟な腸管上皮細胞や杯細胞の割合が増加するため、腸管透過性が高まり、腸管バリア機能が損なわれている。以上の研究から、母親の高脂肪食は、妊娠中の胎児の腸の成長・発達に影響を与えるだけでなく、出生後や離乳後も、子孫の腸の成長・発達に継続的に影響を与え、腸の炎症が持続する現れである可能性がある。この発達異常は、細胞の増殖や分化の促進によって現れ、子孫の腸の悪性腫瘍に対する感受性を高めると考えられる。
母親の高脂肪食が子孫の腸に及ぼす作用の分子メカニズムは完全には解明されていない。母親の高脂肪食は、子孫の神経系においてNF-κb経路を活性化し、神経系の炎症につながることが研究で証明されている(73)。同様に、高脂肪食を与えた親の子供の腸でもNF-κb経路の活性化が見られ、しばしば顕著な腸の炎症を伴っている(31)。古典的な炎症経路として、NF-κb経路は脂質代謝障害による炎症反応に深く関与している。したがって、NF-κb経路の活性化は、高脂肪食による炎症がCRCの発生を促進するメカニズムとして示唆されている。母体循環や胎盤中の炎症因子は胎盤を通して胎児循環に伝達され(51、74)、これらが子孫のNF-κb経路を活性化する可能性がある(59)。また、脂質代謝異常はCRCの危険因子として知られています。高脂肪食を与えた両親の子孫の脂質が多く、脂質代謝障害があると、大腸の炎症を介してCRCのリスクを高める可能性もある。胎児循環中の遊離脂肪酸濃度の上昇は、NF-κbシグナルを増強することが判明した。(52、75)その結果、NF-κb経路が活性化し、子孫の大腸炎症と発がんをさらに促進する可能性がある。
以上のことから、高脂肪食を摂取した両親の子孫の大腸組織における発がんは、高脂肪食による腸の炎症に起因する粘膜バリア破壊、腸内細菌異常、腸の成長・発達異常が原因であることが考えられる。この過程では、NF-κb経路の活性化が重要な役割を担っていると考えられる。この持続的かつ進行性の炎症反応は、高脂肪食を摂取した両親の子孫においてCRCへの感受性が高まる重要な要因である可能性がある(表2)。
表2
表2. 両親の高脂肪食による子孫の腸内病変に関する研究まとめ
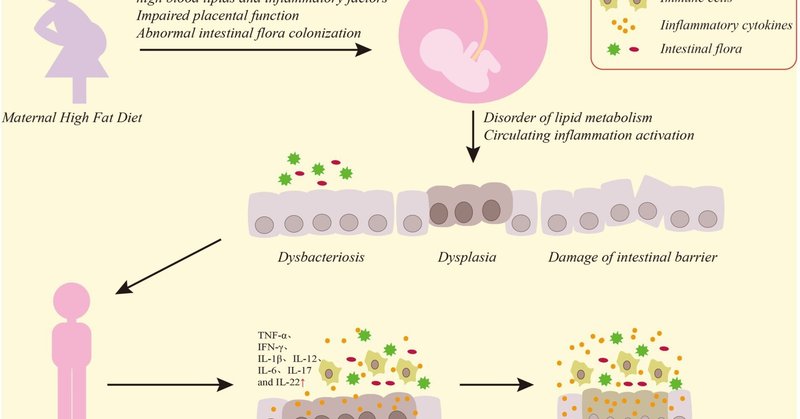
本総説では、高脂肪食とCRC発症との関連について考察し、母親の高脂肪食が子孫の大腸炎症およびCRC発症に果たす役割についてまとめた。我々のレビューから、高脂肪食は宿主の内臓脂肪蓄積を増加させ、炎症性細胞の凝集と炎症性サイトカインの放出を誘発することが明らかになった。これにより、NF-κbおよび関連するシグナル伝達経路がさらに活性化され、CRCへの感受性が高まります。また、母親の高脂肪食は、母親の血清から高濃度の脂質が経胎盤的に移行することにより、血中脂質と子孫の内臓脂肪蓄積を上昇させ、胎盤機能を障害して子孫に代謝障害を引き起こす可能性があります。また、これらの変化は、子孫の腸内細菌症を引き起こし、脂質代謝障害をさらに悪化させる。子孫の循環における脂質代謝障害と母体および胎盤の炎症因子は、子孫に大腸および全身の炎症を引き起こす。大腸の炎症は、腸管バリアを障害し、腸の正常な成長・発達を妨げ、腸管多能性幹細胞の増殖・分化を促進し、腸内細菌症をさらに悪化させる。このような炎症刺激と修復を繰り返す過程で、NF-κbシグナル伝達経路が活性化し、大腸粘膜細胞の無秩序な増殖が起こり、最終的にCRCの発症に至るのです(図1)。
図1
図1. 母親の高脂肪食が子孫のCRCに及ぼす影響の図。母親の高脂肪食は、高濃度の血清脂質や炎症因子を胎盤を通して子孫に移行させ、胎盤機能を損傷させ、母親の腸内フローラの乱れなどの現象も子孫に伝わり、子孫の大腸の粘膜バリアに細菌異常や機能障害をもたらし、大腸の正常な成長・発達に影響を与え、腸の炎症反応を誘発させます。大腸炎症の持続的な破壊と粘膜細胞の無秩序な増殖は、最終的にCRCにつながる。
現在、世界のCRCの診断年齢は徐々に低年齢化しており、CRCの治療効果も理想的とは言えません。これは、CRCの多様な病態と密接に関係していると考えられる。母親の高脂肪食が子孫の大腸に与える影響に着目した研究はほとんどない。両親の高脂肪食による一連の変化は、子孫の大腸発がんを増加させる可能性があるが、関連するメカニズムは現在のところ明らかではない。CRC発生における高脂肪食の細胞および分子作用機序、および大腸の炎症と子孫のCRC感受性増加における母親の高脂肪食の役割を理解するためのさらなる研究が必要である。これらの研究は、CRCの潜在的な治療標的の発見と、これらの標的に基づくCRCの新しい治療戦略の開発に貢献し、CRCの有効性を向上させるのに役立つと思われる。このような研究は、CRCの新たな治療戦略の発見と開発に貢献する可能性があります。
著者貢献
SZ、HY、LLは、本試験の構想および設計に貢献した。SZとJYは文献の収集と整理を行った。SZは原稿の第一稿を執筆した。JY、HY、LLは原稿の一部を執筆した。すべての著者が論文に貢献し、提出されたバージョンを承認した。
謝辞
AsiaEdit (asiaedit.com) のProfessional English language editing supportに感謝する。
利益相反
著者らは、潜在的な利益相反と解釈されるような商業的または金銭的関係がない状態で研究が行われたことを宣言する。
出版社からのコメント
本論文で表明されたすべての主張は、あくまでも著者のものであり、必ずしも所属団体、出版社、編集者、査読者のものを代表するものではありません。この記事で評価される可能性のある製品、またはその製造元が主張する可能性のある主張は、出版社によって保証または支持されるものではありません。
脚注^https://pubmed.ncbi.nlm.nih.gov/
参考文献Sung, H, Ferlay, J, Siegel, RL, Laversanne, M, Soerjomataram, I, Jemal, A, et al. 世界がん統計2020年: GLOBOCANによる185カ国36癌の世界での発生率と死亡率の推定値。CA Cancer J Clin. (2021) 71:209-49. doi: 10.3322/caac.21660.
PubMed Abstract|CrossRef Full Text|Google ScholarArnold, M, Sierra, MS, Laversanne, M, Soerjomataram, I, Jemal, A, and Bray, F. Global patterns and trends in colorectal cancer incidence and mortality. Gut. (2017) 66:683-91. doi: 10.1136/gutjnl-2015-310912
クロスレフフルテキスト|Google ScholarJia, W, Rajani, C, Xu, H, and Zheng, X. Gut microbiota alterations are distinct for primary colorectal cancer and hepatocellular carcinoma. プロテイン・セル。(2021) 12:374-93. doi: 10.1007/s13238-020-00748-0
PubMed Abstract|CrossRef Full Text|Google ScholarKarki, R, Man, SM, and Kanneganti, TD. インフラムマソームとがん。Cancer Immunol Res. (2017) 5:94-9. doi: 10.1158/2326-6066.Cir-16-0269.
PubMed Abstract|CrossRef Full Text|Google ScholarLee, H. Obesity-associated cancers: evidence from studies in mouse models. Cells. (2022) 11:1472. doi: 10.3390/cells11091472
PubMed Abstract|CrossRef Full Text|Google ScholarIslami, F, Goding Sauer, A, Gapstur, SM, and Jemal, A. Proportion of cancer cases attributable to excess body weight by US state, 2011-2015. JAMA Oncol. (2019) 5:384-92. doi: 10.1001/jamaoncol.2018.5639
PubMed Abstract|CrossRef Full Text|Google ScholarChen, K, Guo, J, Zhang, T, Gu, J, Li, H, and Wang, J. The role of dyslipidemia in colitis-associated colorectal Cancer. J Oncol. (2021) 2021:6640384-13. doi: 10.1155/2021/6640384
PubMed Abstract|CrossRef Full Text|Google ScholarDi Franco, S, Bianca, P, Sardina, DS, Turdo, A, Gaggianesi, M, Veschi, V, et al. Adipose stem cell niche reprograms the colorectal cancer stem cell metastatic machine. Nat Commun. (2021) 12:5006. doi: 10.1038/s41467-021-25333-9
PubMed Abstract|CrossRef Full Text|Google ScholarPourvali, K, and Monji, H. Obesity and intestinal stem cell susceptibility to carcinogenesis. Nutr Metab. (2021) 18:37. doi: 10.1186/s12986-021-00567-y
PubMed Abstract|CrossRef Full Text|Google Scholarモーリー、KH、およびコルディッツ、GA。女性におけるホルモン駆動型がんに対する肥満の影響。Sci Transl Med. (2016) 8:323ps3. doi: 10.1126/scitranslmed.aad8842
PubMed Abstract|CrossRef Full Text|Google ScholarZhang, X, de Oliveira, AF, Zhang, H, Cruz, I, Clarke, R, Gaur, P, et al. 母体の肥満は子孫の乳腺がん再発を増加させ、腫瘍免疫応答を損なう。Endocr Relat Cancer. (2020) 27:469-82. doi: 10.1530/erc-20-0065
クロスレフフルテキスト|Google Scholar
12.ダ・クルーズ、RS、クラーク、J、キュリ、ACP、アル・ヤワール、A、ジン、L、ベアード、A、他、親の肥満プログラムは子孫の膵臓がん発症を引き起こす。Endocr Relat Cancer. (2019) 26:511-23. doi: 10.1530/erc-19-0016.
PubMed Abstract|CrossRef Full Text|Google ScholarSun, Y, Wang, Q, Zhang, Y, Geng, M, Wei, Y, Liu, Y, et al. 多世代にわたる母親の肥満は、miR-27a-3pを介して子孫のHCCの発生率を高める。J Hepatol. (2020) 73:603-15. doi: 10.1016/j.jhep.2020.03.050
PubMed Abstract|CrossRef 全文|Google ScholarMoeckli, B, Lacotte, S, and Toso, C. The role of Acsl1 and Aldh2 in the increased risk for liver cancer in offspring of obese mothers. Front Med. (2022) 9:907028. doi: 10.3389/fmed.2022.907028.
PubMed Abstract|CrossRef Full Text|Google ScholarMurphy, CC, Cirillo, PM, Krigbaum, NY, Singal, AG, Lee, M, Zaki, T, et al. 母親の肥満、妊娠中の体重増加、出生体重と大腸癌のリスク. Gut. (2022) 71:1332-9. doi: 10.1136/gutjnl-2021-325001
PubMed Abstract|CrossRef Full Text|Google ScholarKeum, N, and Giovannucci, E. Global burden of colorectal cancer: emerging trends, risk factors and prevention strategies. Nat Rev Gastroenterol Hepatol. (2019) 16:713-32. doi: 10.1038/s41575-019-0189-8.
PubMed Abstract|CrossRef Full Text|Google ScholarMaomao, C, He, L, Dianqin, S, Siyi, H, Xinxin, Y, Fan, Y, et al. Current cancer burden in China: epidemiology, etiology, and prevention. Cancer Biol Med. (2022) 19:1121-38. doi: 10.20892/j.issn.2095-3941.2022.0231
PubMed Abstract|CrossRef Full Text|Google ScholarZhang, C, Cheng, Y, Luo, D, Wang, J, Liu, J, Luo, Y, et al. Association between cardiovascular risk factors and colorectal cancer: a systematic review and meta-analysis of prospective cohort studies. EClinicalMedicine. (2021) 34:100794. doi: 10.1016/j.eclinm.2021.100794.
PubMed Abstract|CrossRef Full Text|Google ScholarGiovannucci, E, Stampfer, MJ, Colditz, G, Rimm, EB, and Willett, WC. 男性における大腸腺腫のリスクと食生活の関係。J Natl Cancer Inst. (1992) 84:91-8. doi: 10.1093/jnci/84.2.91
PubMed Abstract | CrossRef Full Text | Google ScholarWillett、WC、Stampfer、MJ、Colditz、GA、Rosner、BA、およびSpeizer、FE。肉、脂肪、繊維の摂取量と結腸癌のリスクとの関係(女性における前向き研究において)。N Engl J Med. (1990) 323:1664-72. doi: 10.1056/nejm1990121332404
クロスレフフルテキスト|Google ScholarLiu, T, Guo, Z, Song, X, Liu, L, Dong, W, Wang, S, et al. High-fat diet-induced dysbiosis mediates MCP-1/CCR2 axis-dependent M2 macrophage polarization and promotes intestinal adenoma-adenocarcinoma sequence. J Cell Mol Med. (2020) 24:2648-62. doi: 10.1111/jcmm.14984.
PubMed Abstract|CrossRef Full Text|Google ScholarZhu, QC, Gao, RY, Wu, W, Guo, BM, Peng, JY, and Qin, HL. 高脂肪食が大腸腺腫の発生に及ぼす影響(動物モデル)。World J Gastroenterol. (2014) 20:8119-29. doi: 10.3748/wjg.v20.i25.8119
PubMed Abstract|CrossRef Full Text|Google ScholarMana, MD, Hussey, AM, Tzouanas, CN, Imada, S, Barrera Millan, Y, Bahceci, D, et al. High-fat diet-activated fatty acid oxidation mediates intestinal stemness and tumorigenicity. セル・リップ (2021) 35:109212. doi: 10.1016/j.celrep.2021.109212
クロスレフフルテキスト|Google Scholarvan Driel, MS, van Neerven, SM, and Vermeulen, L. High-fat diet impacts on tumor development in the gut. Trends Cancer. (2021) 7:664-5. doi: 10.1016/j.trecan.2021.06.005
PubMed Abstract|CrossRef Full Text|Google ScholarBarbosa, CM, Figueiredo, VP, Barbosa, MA, Cardoso, LM, and Alzamora, AC. 母親の高脂肪食は、第1および第2子孫世代に移行するメタボリックシンドローム障害の引き金となる。Br J Nutr. (2020) 123:59-71. doi: 10.1017/s0007114519002708
PubMed Abstract|CrossRef Full Text|Google Scholarランスクロン、G、デ・ラ・フエンテ、M、トゥワジット、P、トゥワジット、C、およびエルモソ、MA。腫瘍微小環境における慢性炎症とサイトカイン。J Immunol Res. (2014) 2014:149185:1-19. doi: 10.1155/2014/149185.
PubMed Abstract|CrossRef Full Text|Google ScholarXie, R, Sun, Y, Wu, J, Huang, S, Jin, G, Guo, Z, et al. Maternal high fat diet alters gut microbiota of offspring and exacerbates DSS-induced colitis in adulthood. Front Immunol. (2018) 9:2608. doi: 10.3389/fimmu.2018.02608.
PubMed Abstract|CrossRef Full Text|Google ScholarWu, X, Pfalzer, AC, Koh, GY, Tang, S, Crott, JW, Thomas, MJ, et al. クルクミンとサルサレートは、高脂肪食、アゾキシメタン処理マウスにおける大腸炎症と発がん性シグナルを抑制しています。J Agric Food Chem. (2017) 65:7200-9. doi: 10.1021/acs.jafc.7b02648.
PubMed Abstract|CrossRef Full Text|Google ScholarZheng, SM, Chen, H, Sha, WH, Chen, XF, Yin, JB, Zhu, XB, et al. 酸化低密度リポタンパク質がCD206陽性マクロファージを刺激してCD44とCD133の発現をアップレギュレートする高脂肪食による大腸がん。World J Gastroenterol. (2022) 28:4993-5006. doi: 10.3748/wjg.v28.i34.4993
PubMed Abstract|CrossRef Full Text|Google ScholarDe Simone, V, Franzè, E, Ronchetti, G, Colantoni, A, Fantini, MC, Di Fusco, D, et al. Th17型サイトカイン、IL-6およびTNF-αはSTAT3およびNF-kBを相乗的に活性化して大腸がん細胞増殖を促進する。Oncogene. (2015) 34:3493-503. doi: 10.1038/onc.2014.286
PubMed Abstract|CrossRef Full Text|Google ScholarGohir, W, Kennedy, KM, Wallace, JG, Saoi, M, Bellissimo, CJ, Britz-McKibbin, P, et al. 高脂肪食摂取は妊娠に対する母親の腸の適応を調節し、胎盤低酸素、さらに胎児の腸のバリアー蛋白と免疫マーカーを変化させる結果になった。J Physiol. (2019) 597:3029-51. doi: 10.1113/jp277353
PubMed Abstract|CrossRef Full Text|Google ScholarWeng, SF, Redsell, SA, Nathan, D, Swift, JA, Yang, M, and Glazebrook, C. Estimating overweight risk in childhood from predictors during infancy. Pediatrics. (2013)132:e414-21。
PubMed Abstract|CrossRef Full Text|Google ScholarVoerman、E、Santos、S、Inskip、H、Amiano、P、Barros、H、Charles、MA、et al. 妊娠中の体重増加と母親および乳児の有害転帰の関連性. JAMA. (2019) 321:1702-15. doi: 10.1001/jama.2019.3820.
PubMed Abstract|CrossRef Full Text|Google Scholarマムン、AA、マンナン、M、および土井、SA。ライフコースにおける子孫の肥満と関連する妊娠中の体重増加:システマティックレビューとバイアス調整メタアナリシス。Obes Rev. (2014) 15:338-47. doi: 10.1111/obr.12132.
PubMed Abstract|CrossRef Full Text|Google ScholarQuecke, B, Graf, Y, Epure, AM, Santschi, V, Chiolero, A, Carmeli, C, et al. 帝王切開と若年成人子孫の肥満:メタ分析によるシステマティックレビューの更新。Obes Rev. (2022) 23:e13368. doi: 10.1111/obr.13368.
PubMed Abstract|CrossRef Full Text|Google ScholarGonzalez-Bulnes, A, Ovilo, C, and Astiz, S. Transgenerational inheritance in the offspring of pregnant women with metabolic syndrome. Curr Pharm Biotechnol. (2014) 15:13-23. doi: 10.2174/1389201015666140330192009
クロスレフフルテキスト|Google ScholarFlanagan, EW, Most, J, Altazan, AD, Boyle, KE, and Redman, LM. 肥満の世代間伝達における妊娠初期の母親の環境の役割。Obesity. (2021年)29:1780-6. doi: 10.1002/oby.23283
PubMed Abstract | CrossRef Full Text | Google ScholarGodfrey, KM, Reynolds, RM, Prescott, SL, Nyirenda, M, Jaddoe, VW, Eriksson, JG, et al. 母親の肥満が子孫の長期的健康に与える影響。Lancet Diabetes Endocrinol. (2017) 5:53-64. doi: 10.1016/s2213-8587(16)30107-3
PubMed Abstract|CrossRef Full Text|Google Scholarデニズリ、M、カピターノ、ML、およびクア、KL。母親の肥満とそれに伴う早期の炎症が子孫の長期的な健康に与える影響。Front Cell Infect Microbiol. (2022) 12:940937. doi: 10.3389/fcimb.2022.940937.
PubMed Abstract|CrossRef Full Text|Google ScholarWankhade, UD, Zhong, Y, Kang, P, Alfaro, M, Chintapalli, SV, Piccolo, BD, et al. 母体高脂肪食プログラム子孫の肝臓脂肪症は、マウスの腸内細菌生態の変化と関連して性差的に二型である。サイ・レップ(2018)8:16502. doi: 10.1038/s41598-018-34453-0
クロスレフフルテキスト|Google ScholarWang, D, Yan, J, Teng, M, Yan, S, Zhou, Z, and Zhu, W. In utero and lactational exposure to BDE-47 promotes obesity development in mouse offsprises feeding a high-fat diet: impaired lipid metabolism and intestinal dysbiosis. Arch Toxicol. (2018) 92:1847-60. doi: 10.1007/s00204-018-2177-0
クロスレフフルテキスト|Google ScholarGreathouse, KL, Faucher, MA, and Hastings-Tolsma, M. The gut microbiome, obesity, and weight control in women's reproductive health. West J Nurs Res. (2017) 39:1094-119. doi: 10.1177/0193945917697223
クロスレフフルテキスト|Google ScholarMalesza, IJ, Malesza, M, Walkowiak, J, Mussin, N, Walkowiak, D, Aringazina, R, et al. 高脂肪、西洋式食事、全身性炎症、腸内細菌叢:ナラティブ・レビュー. Cells. (2021) 10:3164. doi: 10.3390/cells10113164
PubMed Abstract|CrossRef Full Text|Google ScholarLey、RE、Bäckhed、F、Turnbaugh、P、Lozupone、CA、Knight、RD、およびGordon、JI。肥満が腸内細菌の生態を変化させる。(2005年) 102:11070-5. doi: 10.1073/pnas.0504978102.
PubMedアブストラクト|CrossRefフルテキスト|Google ScholarDreisbach, C, Morgan, H, Cochran, C, Gyamfi, A, Henderson, WA, and Prescott, S. Metabolic and microbial changes associated with diet and obesity during pregnancy: What can we learn from animal studies? Front Cell Infect Microbiol. (2021) 11:795924. doi: 10.3389/fcimb.2021.795924.
PubMed Abstract|CrossRef Full Text|Google ScholarBabu、ST、Niu、X、Raetz、M、Savani、RC、Hooper、LV、およびMirpuri、J. Maternal high-fat diet results in microbiota-dependent expansion of ILC3s in mice offspring. JCI Insight. (2018) 3:e99223. doi: 10.1172/jci.insight.99223.
PubMed Abstract|CrossRef Full Text|Google ScholarGuo, Y, Wang, Z, Chen, L, Tang, L, Wen, S, Liu, Y, et al. Diet induced maternal obesity affect offspring gut microbiota and persists into young adulthood. Food Funct. (2018) 9:4317-27. doi: 10.1039/c8fo00444g.
PubMed Abstract|CrossRef Full Text|Google ScholarBarbour、LA、およびHernandez、TL。母体の脂質と胎児の過成長:脂肪から脂肪を作る。Clin Ther. (2018) 40:1638-47. doi: 10.1016/j.clinthera.2018.08.007.
PubMed Abstract|CrossRef Full Text|Google Scholarハウエル、KR、およびパウエル、TL。胎盤機能と胎児発育に対する母親の肥満の影響。Reproduction. (2017) 153:R97-R108. doi: 10.1530/rep-16-0495.
PubMed Abstract|CrossRef 全文|Google Scholarモスト、J、ダービス、S、ハマン、F、アダモ、KB、およびレッドマン、LM。妊娠中のエネルギー摂取必要量。ニュートリエンツ. (2019) 11:8. doi: 10.3390/nu11081812.
PubMed Abstract|CrossRef Full Text|Google ScholarKirwan, JP, Hauguel-De Mouzon, S, Lepercq, J, Challier, JC, Huston-Presley, L, Friedman, JE, et al. TNF-alpha is a predictor of insulin resistance in human pregnancy. Diabetes. (2002) 51:2207-13. doi: 10.2337/diabetes.51.7.2207
PubMed Abstract | CrossRef Full Text | Google ScholarZhu, MJ, Du, M, Nathanielsz, PW, and Ford, SP. 母体の肥満は炎症シグナル経路をアップレギュレートし、妊娠中期の羊胎盤におけるサイトカイン発現を増強する。Placenta. (2010) 31:387-91.
クロスレフフルテキスト|Google ScholarWallace, JG, Bellissimo, CJ, Yeo, E, Fei Xia, Y, Petrik, JJ, Surette, MG, et al. 妊娠中の肥満は、母親の腸内炎症、胎盤低酸素をもたらし、妊娠中期における胎児のグルコース代謝を変化させます。サイレポ(2019)9:17621. doi: 10.1038/s41598-019-54098-x
PubMed Abstract|CrossRef Full Text|Google ScholarSureshchandra, S, Marshall, NE, Wilson, RM, Barr, T, Rais, M, Purnell, JQ, et al. 胎盤および末梢血における妊娠前の肥満の炎症性決定因子。Front Physiol. (2018) 9:1089. doi: 10.3389/fphys.2018.01089.
PubMed Abstract|CrossRef Full Text|Google ScholarKelly, AC, Powell, TL, and Jansson, T. Placental function in maternal obesity. Clin Sci. (2020) 134:961-84. doi: 10.1042/cs20190266.
クロスレフフルテキスト|Google ScholarBoyle, KE, Patinkin, ZW, Shapiro, ALB, Bader, C, Vanderlinden, L, Kechris, K, et al. 母親の肥満はヒト乳児由来の間葉系幹細胞における脂肪酸酸化、AMPK活性、および関連DNAメチル化について変化させる. Mol Metab. (2017) 6:1503-16. doi: 10.1016/j.molmet.2017.08.012.
クロスレフフルテキスト|Google ScholarGruber, L, Hemmerling, J, Schüppel, V, Müller, M, Boekschoten, MV, and Haller, D. Maternal high-fat diet accelerates development of Crohn's disease-like ileitis in TNFΔARE/WT offspring. Inflamm Bowel Dis. (2015) 21:2016-25. doi: 10.1097/mib.000000000465
PubMed Abstract|CrossRef Full Text|Google ScholarAl Nabhani, Z, Dulauroy, S, Lécuyer, E, Polomack, B, Campagne, P, Berard, M, et al. 生後早期の過剰カロリー摂取は成人期の大腸炎への感受性を高める。Nat Metab. (2019) 1:1101-9. doi: 10.1038/s42255-019-0129-5
クロスレフフルテキスト|Google ScholarBibi、S、Kang、Y、Du、M、およびZhu、MJ。母体の高脂肪食摂取は、マウスのDSS誘発大腸炎に対する子孫の感受性を高める。Obesity. (2017) 25:901-8. doi: 10.1002/oby.21816.
クロスレフフルテキスト|Google ScholarYan, X, Huang, Y, Wang, H, Du, M, Hess, BW, Ford, SP, et al. 母体肥満はヒツジの胎児と子孫の両方の大腸で持続的な炎症を誘導する. Inflamm Bowel Dis. (2011)17:1513-22.doi:10.1002/ibd.21539。
PubMed Abstract | CrossRef Full Text | Google ScholarXue, Y, Wang, H, Du, M, and Zhu, MJ. 母体肥満は、非肥満性糖尿病マウスにおいて腸の炎症を誘発し、腸上皮のバリア機能を障害させる。J Nutr Biochem. (2014) 25:758-64. doi: 10.1016/j.jnutbio.2014.03.009.
PubMed Abstract|CrossRef Full Text|Google ScholarMueller, NT, Bakacs, E, Combellick, J, Grigoryan, Z, and Dominguez-Bello, MG. 乳児のマイクロバイオームの発達:ママの問題(The infant microbiome development: mom matters. Trends Mol Med. (2015) 21:109-17. doi: 10.1016/j.molmed.2014.12.002.
PubMed Abstract|CrossRef Full Text|Google ScholarDerrien, M, Alvarez, AS, and de Vos, WM. 人生の最初の10年間における腸内細菌叢。トレンド・マイクロバイオル(Trends Microbiol. (2019) 27:997-1010. doi: 10.1016/j.tim.2019.08.001.
クロスレフフルテキスト|Google ScholarXue, C, Xie, Q, Zhang, C, Hu, Y, Song, X, Jia, Y, et al. Vertical transmission of the gut microbiota influences glucose metabolism in offspring of mice with hyperglycaemia in pregnancy. Microbiome. (2022) 10:122. doi: 10.1186/s40168-022-01318-8
PubMed Abstract|CrossRef Full Text|Google ScholarZhou, L, and Xiao, X. The role of gut microbiota in the effects of maternal obesity during pregnancy on offspring metabolism. バイオサイ・レップ (2018) 38:BSR20171234. doi: 10.1042/bsr20171234.
クロスレフフルテキスト|Google ScholarAlberca, GGF, Cardoso, NSS, Solis-Castro, RL, Nakano, V, and Alberca, RW. 腸の炎症と微生物叢:多様性を超えて。World J Gastroenterol. (2022) 28:3274-8. doi: 10.3748/wjg.v28.i26.3274
PubMed Abstract|CrossRef Full Text|Google Scholar高脂肪食は腸内細菌叢と代謝物の調節を通じて大腸腫瘍の発生を促進する。Gastroenterology. (2022) 162:135-49.e2. doi: 10.1053/j.gastro.2021.08.041
PubMed Abstract|CrossRef 全文|Google ScholarLiang, X, Yang, Q, Fu, X, Rogers, CJ, Wang, B, Pan, H, et al. 母性肥満は、雄性子孫マウスの内臓脂肪前駆細胞特性をエピジェネティックに変化させる。J Physiol. (2016) 594:4453-66. doi: 10.1113/jp272123
PubMed Abstract | CrossRef Full Text | Google ScholarSaullo, C, Cruz, LLD, Damasceno, DC, Volpato, GT, Sinzato, YK, Karki, B, et al. マウス子孫の脂肪組織に対する母親の高脂肪食の影響:系統的レビューとメタアナリシス(Effects of a maternal high-fat diet on adipose tissue in murine offspring: a systematic review and meta-analysis. Biochimie. (2022) 201:18-32. doi: 10.1016/j.biochi.2022.06.009
PubMed Abstract|CrossRef Full Text|Google ScholarBrown, JC, Caan, BJ, Prado, CM, Cespedes Feliciano, EM, Xiao, J, Kroenke, CH, et al. Stage I-III colorectal cancerの患者における腹部脂肪率と死亡率の関連性.The association of abdominal adiposity with mortality in patients with stage I-III colorectal cancer. J Natl Cancer Inst. (2020) 112:377-83. doi: 10.1093/jnci/djz150
PubMed Abstract|CrossRef Full Text|Google ScholarSłupecka-Ziemilska, M, Grzesiak, P, Kowalczyk, P, Wychowański, P, and Woliński, J. Maternal high-fat diet exposure during gestation and lactation affects intestinal development in suckling rats. Front Physiol. (2021) 12:693150. doi: 10.3389/fphys.2021.693150.
クロスレフフルテキスト|Google ScholarChen, X, Yang, Z, Hu, H, Duan, W, Wang, A, Dong, Y, et al. 離乳期における腸管幹細胞の分化・増殖とその基礎となる制御機構. Curr Protein Pept Sci. (2019) 20:690-5. doi: 10.2174/1389203720666190125101834
PubMed Abstract|CrossRef Full Text|Google ScholarLiu, WC, Wu, CW, Fu, MH, Tain, YL, Liang, CK, Hung, CY, et al. Maternal high fructose-induced hippocampal Neuroinflammation in the adult female offspring via PPARγ-NF-κB signaling. J Nutr Biochem. (2020) 81:108378. doi: 10.1016/j.jnutbio.2020.108378.
PubMed Abstract|CrossRef Full Text|Google Scholarセゴビア、SA、ビッカーズ、MH、およびレイノルズ、CM。母親の肥満が炎症プロセスに与える影響と、後の子孫の健康アウトカムへの影響。J Dev Orig Health Dis. (2017) 8:529-40. doi: 10.1017/s2040174417000204
PubMed Abstract|CrossRef Full Text|Google ScholarSummerfield, M, Zhou, Y, Zhou, T, Wu, C, Alpini, G, Zhang, KK, et al. 妊娠前の高脂肪食からNormal fat dietへの母親の長期食事移行は次世代における脂肪組織炎症を回避する。PLoS One. (2018) 13:e0209053. doi: 10.1371/journal.pone.0209053
PubMed Abstract|CrossRef Full Text|Google Scholar
キーワード:母体、子孫、高脂肪食、大腸がん、腸内炎症
引用元 Zheng S, Yin J, Yue H and Li L (2023) Maternal high-fat diet increases the susceptibility of offspring to colorectal cancer via the activation of intestinal inflammation. Front. Nutr. 10:1191206. doi: 10.3389/fnut.2023.1191206.
Received: 21 March 2023; Accepted: 27 April 2023;
発行:2023年5月12日。
編集者
ジャンヴィンチェンツォ・ズッコッティ(ミラノ大学、イタリア
査読者:ヴァレリア・カルカテッラ
ヴァレリア・カルカテラ、パヴィア大学、イタリア
ヘラス・チェーナ、パヴィア大学、イタリア
Copyright © 2023 Zheng, Yin, Yue and Li. これは、Creative Commons Attribution License (CC BY)の条件の下で配布されたオープンアクセス記事です。他のフォーラムでの使用、配布、複製は、原著者と著作権所有者のクレジットが記載され、本誌の原著が引用されていることを条件に、学術的に認められた慣習に従って許可されます。本規約を遵守しない使用、配布、複製は許可されません。
*Correspondence: Lifu Li, 358268552@qq.com; Hui Yue, yh12070430@vip.sina.com
免責事項:本記事で表明されたすべての主張は、あくまでも著者のものであり、必ずしも所属団体や出版社、編集者、査読者のものを代表するものではありません。この記事で評価される可能性のある製品、またはその製造元が主張する可能性のある主張は、出版社によって保証または承認されるものではありません。
こんな人も見ています
重症患者における骨格筋量低下の有病率と死亡リスク:最新の系統的レビューとメタアナリシス
楊慧、王錫熙、馬慧、李振、李文、夏穎、張暁明
浙江省産地における異なる柑橘類品種の二次代謝産物に関する比較研究
林芽衣、徐承南、高雪英、張偉清、姚周林、王天宇、馮顕珠、王岳(Yue Wang)
小学校のEFL学習者を対象とした読書リテラシー質問票の開発
李維来、姜秀敏、邵延宏
Focal Cross Transformer:クロスウィンドウとフォーカルセルフアテンションに基づくマルチビュー脳腫瘍セグメンテーションモデル
李宗仁、ウシュア・シラム、馮修瑞、閻広輝
Cordia myxaを添加したラクダ乳発酵食品の物理化学的および官能的特性の評価と酸化ストレスおよび高脂血症に対する生物学的効果のラットにおける評価
El Sayed Hassan Atwaa, Magdy Ramadan Shahein, Enrique Raya-Álvarez, El Sayed Abd El-Sattar, Moustafa A. A. Hassan, Madeha Ahmed Hashim, Naief Dahran, Manal F. El-Khadragy, Ahmad Agil and Ehab Kotb Elmahallawy
フッター
ガイドライン
探検する
アウトリーチ
接続
フォローする
© 2023 Frontiers Media S.A. All rights reserved.
プライバシーポリシー|利用規約
この記事が気に入ったらサポートをしてみませんか?
