
37)ミトコンドリアは細胞間を移動して組織を活性化する
体がみるみる若返るミトコンドリア活性化術37
ミトコンドリアを活性化して体を若返らせる医薬品やサプリメントを解説しています。
【ミトコンドリアは細菌が真核細胞に共生して発生した】
約35億年前に発生した最初の生物は、はっきりした核を持たない(核膜をもった核が無い)原核生物です。これらの生物は、 海の中を漂う有機物を利用し、酸素を使わずに生息していました。
約25億年前に光合成を行う藍藻(シアノバクテリア)が登場します。光合成によって、無機物である二酸化炭素と水からグルコース(ブドウ糖)などの有機物と酸素を作り出すことができるようになりました。それまで無酸素状態だった地球大気に大量の酸素分子が放出され、嫌気性生物の多くが絶滅し、酸素を利用した呼吸をする微生物(α-プロテオバクテリア)も誕生しました。
真核細胞のミトコンドリアは、このα-プロテオバクテリアが原始真核細胞に取り込まれて共生するようになって形成されたと考えられています。これを「細胞内共生説」と言います。
原始真核生物はα-プロテオバクテリアを餌として捕食していたのですが、そのうちに寄生して細胞内小器官へと進化し、共生するようになったと考えられています。
嫌気性原始真核細胞が酸素を利用できるα-プロテオバクテリアを細胞内に取り込んで共生することによって、酸素分圧の高い環境で生きていけるようになり、酸素を使って細胞内エネルギーであるATPを大量に産生できるようになって生物の進化が急速化しました。

図:嫌気性の原始真核細胞に好気性細菌のαプロテオバクテリアが食作用で取り込まれ、共生するようになり、ミトコンドリアになった。αプロテオバクテリアに存在していた遺伝子の多くは真核細胞の核内に移動し、ミトコンドリアのたんぱく質の多くは核の遺伝情報によって作られる。
【ミトコンドリアは増やすことができる】
ミトコンドリアは元々は細菌であったので、分裂して増殖することができます。ミトコンドリアが増えることを「ミトコンドリア新生」や「ミトコンドリア発生」と呼んでいます。細胞内でミトコンドリアが新しく発生することです。通常、既存のミトコンドリアが増大して分かれて増えていきます。
ダメージを受けて機能異常を起こしたミトコンドリアはミトコンドリアに特異的なオートファジーによる除去システムのミトファジー(mitophagy)によって分解され、新しいミトコンドリアがミトコンドリア新生によって作られます。このようなミトファジーとミトコンドリア新生のバランスによってミトコンドリアの品質が決まります。
細胞内のミトコンドリアの増殖を刺激することによって、細胞内のミトコンドリアの数と量を増やすことができます。その方法として、ペルオキシソーム増殖因子活性化受容体(PPAR)のリガンド(ベザフィブラートなど)、AMPプロテインキナーゼ(AMPK)を活性化するメトホルミン、カロリー制限、絶食やケトン食で体内で産生されるケトン体(βヒドロキシ酪酸など)が報告されています。
ミトコンドリア新生で最も重要な働きを担っているのが、PGC-1α(Peroxisome Proliferator- activated receptor gamma coactivator-1α)です。日本語訳は「ペルオキシソーム増殖因子活性化受容体γコアクチベーター1α」です。
PPARのリガンド(フェノフィブラート、ベザフィブラートなど)やメトホルミンやプテロスチルベンやカロリー制限やβヒドロキシ酪酸はこのPGC-1αを活性化する作用があります(下図)。
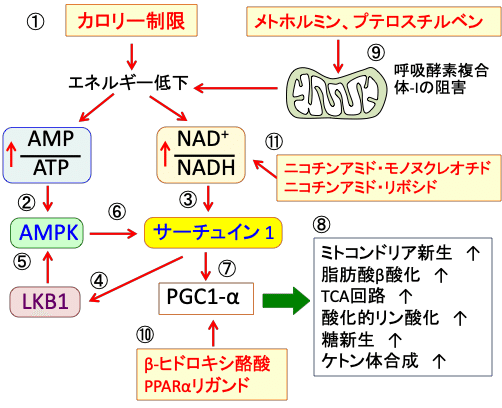
図:カロリー制限は体内のエネルギー低下によってAMP/ATP比とNAD+/NADH比を高める(①)。AMP/ATP比の上昇はAMP活性化プロテインキナーゼ(AMPK)を活性化し(②)、NAD+/NADH比の上昇はサーチュイン1(Sirtuin 1)を活性化する(③)。サーチュイン1はセリン・スレオニン・キナーゼのLKB1を活性化し(④)、LKB1はAMPKを活性化する(⑤)。AMPKはサーチュイン1を活性化する(⑥)。サーチュイン1はPGC-1αの発現を亢進する(⑦)。PGC-1αは、ミトコンドリア新生を亢進し、脂肪酸β酸化とTCA回路と酸化的リン酸化と糖新生とケトン体合成を亢進する(⑧)。メトホルミンやプテロスチルベンはミトコンドリアの呼吸酵素複合体Iを阻害して、カロリー制限と類似のメカニズムでPGC-1αたんぱく質の発現を亢進する(⑨)。ケトン体のβヒドロキシ酪酸やPPARαのリガンド(フェノフィブラートやベザフィブラートなど)はPGC-1αたんぱく質の発現を亢進する(⑩)。NADの前駆物質であるニコチンアミド・モノヌクレオチド、ニコチンアミド・リボシドを補充するとNAD+/NADH比を高めてサーチュイン1を活性化する(⑪)。
【ミトコンドリアは細胞間を輸送される】
ミトコンドリアは真核細胞の細胞質に見られる細胞小器官であり、エネルギー産生や物質代謝に関わっています。前述のように、ミトコンドリアを増やすことができます。さらに、ミトコンドリアが離れた細胞間を移動する現象が知られています。
ミトコンドリアのダメージを受けた細胞を救うために、正常な別の細胞からミトコンドリアが輸送される可能性が指摘されています。
がん細胞では他の細胞からミトコンドリアが輸送されると増殖が促進される可能性が指摘されています。さまざまな種類の悪性細胞が他の細胞からミトコンドリアを受け取っていることが観察されており、ミトコンドリア輸送によってがん細胞の侵襲性が増強したり、放射線や化学療法に対する耐性を獲得することが報告されています。
組織傷害やがんなどの病態生理学的条件下のみならず、機能的に正常な細胞の間でも観察されていますが、その生理的機能についてはまだ十分に解明されていません。
ミトコンドリア輸送の経路として、トンネルナノチューブ、樹状突起、細胞外小胞、細胞間の放出と取り込みがあります(下図)。

図:ドナー(Donor)細胞からレシピエント(Recipient)細胞へのミトコンドリア転移の経路。(①)トンネルナノチューブ(tunneling nanotubes)は、細胞膜から伸びる膜状の管状突起で、直径は50〜1500 nm、長さは数十〜数百ミクロン。 トンネルナノチューブは接続された細胞間のミトコンドリア移動の最も一般的な経路。(②)樹状突起(Dendrite)は、膜状突起のもう1つの形態で、 樹状突起を持ついくつかの細胞(例えば、骨細胞)は、固有の樹状突起を介して互いに接続されて細胞間ネットワークを形成し、ミトコンドリア移動のための経路としても使用される。 (③)細胞膜によって形成された細胞外小胞(Extracellular Microvesicles)を介したミトコンドリア移動。(④)運搬体(carriers)の無い遊離ミトコンドリアのみが、細胞外に放出され、別の細胞に取り込まれて輸送される経路もある。これらの経路を使って、ミトコンドリアは細胞間を輸送されている。
【ミトコンドリア輸送によってダメージを受けた細胞・組織を救っている】
長い間、ミトコンドリアは細胞質内に拘束されていると考えられていました。しかし、前述のように、いくつかの経路を介して、ミトコンドリアは細胞間を輸送されていることが明らかになっています。ダメージを受けた細胞や組織の修復のメカニズムの一つとして、間葉系幹細胞と損傷した組織の間のミトコンドリアの移動が示されています。ミトコンドリア輸送は、心臓血管系、呼吸器系、神経系および腎臓系で広く研究されています。
トンネルナノチューブを介した哺乳類細胞間の細胞小器官の輸送は2004年に最初に見つかりました。さらに、2006年には、機能不全のミトコンドリアを有する哺乳動物細胞への間葉系幹細胞から正常なミトコンドリアの転送が実証されています。
抗がん剤治療によって誘発される認知障害は、がん治療の重大な副作用の一つです。マウスを用いた実験で、抗がん剤のシスプラチンは神経細胞のミトコンドリア機能を破壊することが示されています。
このダメージを受けた神経細胞に、間葉系幹細胞から正常なミトコンドリアが輸送され、神経細胞のミトコンドリア機能が回復し、細胞死を阻止することが報告されています。
また、アストロサイト(星状膠細胞)からダメージを受けた神経細胞へのミトコンドリア輸送が神経細胞の細胞死を阻止する現象も報告されています。
以下のような報告があります。
Mesenchymal stem cells transfer mitochondria into cerebral microvasculature and promote recovery from ischemic stroke(間葉系幹細胞はミトコンドリアを脳微小血管系に輸送し、虚血性脳卒中からの回復を促進する)Microvasc Res. 2019 May;123:74-80.
【要旨】
間葉系幹細胞は虚血性脳卒中の新しい治療法として使用できるが、その治療効果と作用機序にはさらなる検討が必要である。ミトコンドリア機能障害は、虚血再灌流性脳卒中傷害において重要なメカニズムである。
私たちの最近の研究は、間葉系幹細胞が細胞膜ナノチューブを介して損傷した内皮細胞に機能的なミトコンドリアをin vitroで転移させ、好気性呼吸を救出し、内皮細胞をアポトーシスから保護できることを示している。したがって、ミトコンドリア保護のメカニズムは、損傷した脳微小血管系の幹細胞を介した救済および虚血性脳卒中からの回復に関与している可能性がある。
この研究では、中大脳動脈閉塞および再灌流手術がラットで実施され、次に、間葉系幹細胞を損傷した脳血管系に移植した。我々の結果は、損傷した脳微小血管系の宿主細胞が移植された幹細胞から移されたミトコンドリアを受け入れ、それによって損傷した微小血管系のミトコンドリア活性を著しく改善し、血管新生を増強し、梗塞体積を減少させ、機能回復を改善することを示した。私たちのデータは、幹細胞がまだ特定されていないメカニズムを介して脳卒中の損傷した脳血管系を救うことができるという証拠を提供した。
ダメージを受けた組織の回復を促進する方法として体の中の細胞のミトコンドリアの数を増やし、機能を活性化する方法は有効です。ダメージを受けた組織の間葉系幹細胞や線維芽細胞や血管内皮細胞がミトコンドリア輸送によって死にかけている細胞を救うことができるためです。
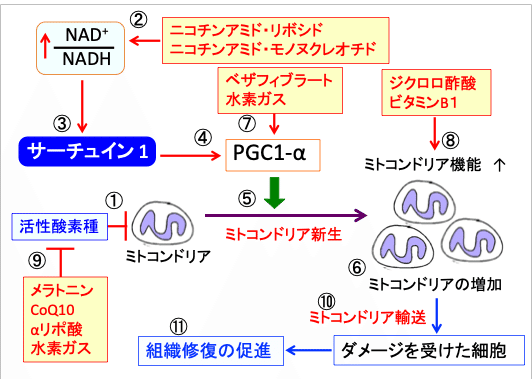
図:活性酸素はミトコンドリアの酸化傷害を引き起こす(①)。ニコチンアミド・アデニン・ジヌクレオチド(NAD+)の前駆体のニコチンアミド・リボシドやニコチンアミド・モノヌクレオチドの補充はNAD+/NADH比を高め(②)、サーチュイン1を活性化する(③)。サーチュイン1はPGC-1α(PPARγコアクチベーター1α)を活性化し(④)、PGC-1αはミトコンドリア新生を亢進して(⑤)、細胞内のミトコンドリアの数と量を増やす(⑥)。PPAR(ペルオキシソーム増殖因子活性化受容体)の汎アゴニスト(受容体に結合して活性化する物質)であるベザフィブラートと水素ガスは、PPARを介してPGC-1αを活性化する(⑦)。ジクロロ酢酸とビタミンB1はピルビン酸脱水素酵素を活性化する機序でミトコンドリア機能(物質代謝とエネルギー産生)を亢進する(⑧。抗酸化作用のあるメラトニン、CoQ10、αリポ酸、水素ガスは活性酸素を消去して、ミトコンドリアのダメージを阻止する(⑨)。増えたミトコンドリアの一部はミトコンドリア輸送によってダメージを受けた細胞に輸送され(⑩)、組織の修復を促進する(⑪)。
この記事が気に入ったらサポートをしてみませんか?
