
デジタルバイオマーカー/エンドポイントを利用した臨床試験の実現可能性【後編】
閲覧ありがとうございます。データサイエンティストの杉尾です。主にデジタルバイオマーカーの開発プラットフォームである(SelfBase)の機能開発や、そこで収集されたデータの解析を担当しております。
今回は、「臨床試験におけるデジタルバイオマーカー・デジタルエンドポイントの選定方法」をテーマに整理していきます。
以下のこちらの記事の続きになります。
臨床試験におけるデジタルバイオマーカーへの期待と課題
背景と課題のおさらいから。
ウェアラブル、小型デバイス、またはアルゴリズムの進化によって、新しいデジタルバイオマーカー(Digital Biomarker, dBM)またデジタルエンドポイント(Digital Endpoints)は、臨床試験(Clinical Trial)において大きな期待を集めています。
しかし、これらの新しい測定値の検証プロセスやガイドラインが確立していないため、(特に日本は)その導入が遅れています。
では、どのようにしてデジタルバイオマーカーを検証し、選定していけばいいのでしょうか。
まだまだ勉強中ではございますが、国内外の論文や記事を拝読する過程で、自身らの整理も兼ねて、記事としてまとめたいと思います。(主にKruizinga MD氏の論文[1]を参考に記述しております。)
さて、デジタルバイオマーカーの選定は、
1. 技術的なバリデーションの観点
2. 臨床的なバリデーションの観点
に分けて考えることができるとされています[1]。
そして、この記事では、「2. 臨床的なバリデーションの観点」に関して整理していきます。
臨床的バリデーション
1. 患者さんへの忍容性と使いやすさが担保できているか
デジタルエンドポイントを利用した臨床試験及びアセスメントは、対象者にとって使いやすいものでないといけません。従来の臨床試験及びアセスメンは、最小限の侵襲性であるべきで、できるだけ手動での入力が必要でした。しかし、デジタルエンドポイントの使用は、「臨床試験の分散化(平たく言うと、自宅でできるようになること)」が進むことを意味するため、臨床試験のアドヒアランスとリテンションを最適化するために、参加者のユーザー体験の向上が不可欠なのです。ウェアラブルデバイスやそれに伴うセンシング技術の発達によって、被験者の移動的な負担を減らし、フォローアップ期間を長くすることができるかもしれませんが、それは試験を長時間実施すること被験者が耐えられる場合に限られます。例えば、小児、高齢者、障害を持つ患者など、脆弱な集団を調査する場合にも、忍容性が重要です。技術的またはユーザビリティ上の小さな問題が、コンプライアンスの低下、ユーザーによる回避策、あるいは脱落につながる可能性があるのです。
2. 患者群と対象群の違いをコントロールできるか
重要な検証基準は、患者群と対照群の間の差であり、これを正しく評価することが非常に重要です。また、このデータは、適切な治療効果を検出するために必要なサンプルサイズを正確に計算するために役立ちます。
例として、小児喘息の分野での「健常者とARID1B関連の知的障害者」という研究事例を紹介します[2]。図3Aは、喘息がコントロールされていない子供と健康な子供との間の身体活動の違いを示しています。このエンドポイントの候補は、健康な子供と喘息患者の間だけでなく、2つの疾患状態の間でも区別できるようです。データの解像度を上げると、1日のうちでどのような時間帯に集団の違いが生じるか(図3、B、C)を把握できるのです。
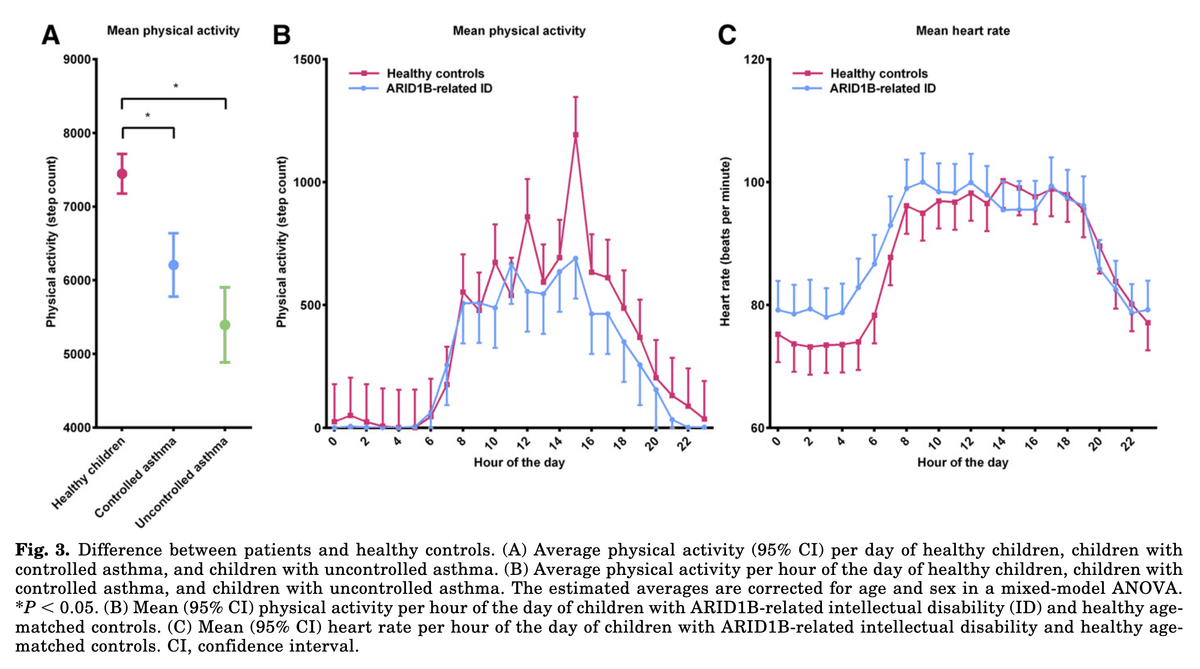
デジタルエンドポイントを活用するための測定法やアルゴリズムの場合、年齢、性別、ライフスタイルの選択、社会経済的地位が在宅測定結果に影響を与えることは間違いないため、対象群の基準値を取得する必要があると考えてられています。患者群と対象群の差を評価し、治療効果を推定する場合、(部分的に)可逆的な疾患と必ず進行する疾患を区別することができると考えられています。例えば、進行性疾患の場合、治療によって期待される効果は、基準値に対する絶対的な改善ではなく、悪化の速度の減少である可能性があり、それをを観測し、評価することが大事だとされています。
3. 再現性・ばらつきの観察
測定値は、介入や疾患活動性の変化がない限り、経時的に安定していなければならず、結果変数の変化は、疾患の改善または増悪のいずれかでなければなりません。これは自宅での連続測定では非現実的と思われるかもしれませんが、季節、天候、場所などの要因によって引き起こされる実世界の変動の影響や、年齢や社会環境などのベースライン要因の影響を考慮する必要があることを示唆しています[3]。さらに、自由生活環境では、薬物の併用が交絡因子となることもあります。
4. 既存の疾患指標との相関性
新しいエンドポイントを従来のエンドポイント(理想的にはゴールドスタンダード)との相関が保証されていることも重要です。しかし、デジタルと従来のエンドポイントの性質を考慮すると、完全な相関を得ることはできません。したがって、研究者はデータを批判的に評価し、相関性が低いのは新規エンドポイントの限界によるものか、「ゴールド」スタンダードの限界によるものか、あるいは両者が疾患の異なる側面を定量化しているためかを判断する必要があります。
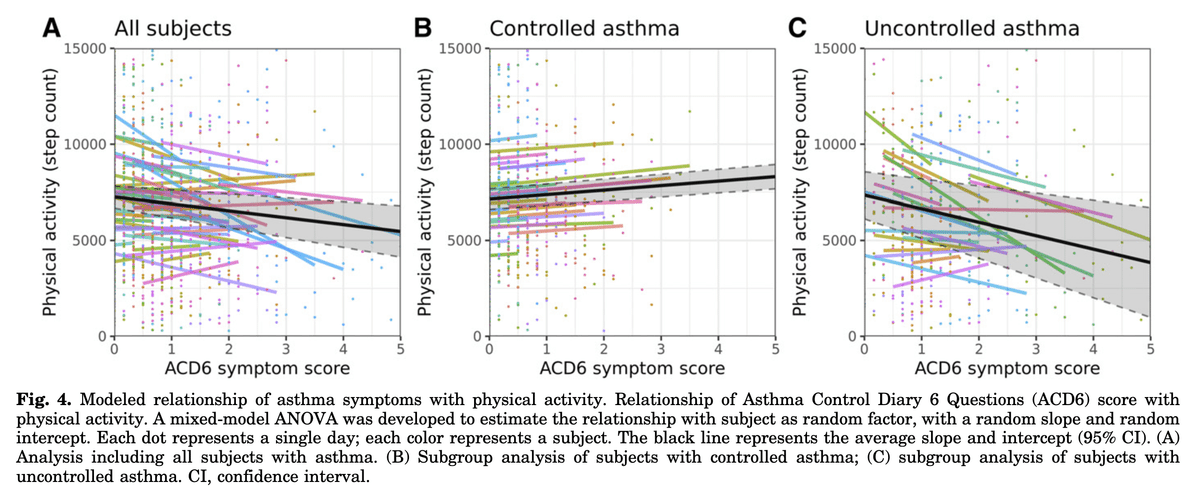
単純な例としては、慢性閉塞性肺疾患患者における"1日の歩数"と"6分間歩行試験"の相関が挙げられます[4]。この場合、両エンドポイントは概念的には同じなのですが、測定方法と表現方法が異なります。また、GPS移動度と統合失調症(schizo-phrenia)の症状負担[5]や喘息コントロール日記スコアと小児喘息(図4)における1日あたりの歩数[6]を相関させると解釈はより困難になります。その場合、喘息がコントロールされている被験者については、日々の症状と1日の身体活動の間に相関はないように見える(図4B)。これは、これらの患者にとって、喘息の症状が日常生活に支障をきたすほど限定的であるためと考えられます。しかし、喘息がコントロールされていない被験者(図4C)を見ると、症状の負担が大きく、その結果、身体活動に大きな影響を及ぼしているようです。
このことから、身体活動は、コントロールされていない喘息児の症状のモニタリングにのみ付加価値があるとの結論に至る可能性があります。解釈は、検証の他のフェーズで行われた分析も考慮に入れながら、慎重に行う必要があります。この時点で、新規エンドポイントが患者にとって意味のある疾患状態を捉えているかどうかを評価するために、一般的なQOLや疾患関連のQOLとの関係も調査することができます。
5. 病態の変化に対応できるかどうか
エンドポイント候補が目的に適合していると判断する最終段階では、エンドポイントが疾病負荷の変化に対応するかどうかを調査することが必要になってきます。一つの方法は、肺の増悪や鎌状赤血球の危機のようなマイナスの効果が期待できる特定の健康イベントや、外科的介入のようなプラスの効果が期待できるイベントの影響を調査することです。発生する健康イベントからは、前駆症状、回復の傾きや速度、ベースラインへの復帰に要する時間など、いくつかの特徴を抽出することができます(図5A)。
例えば、図5Bは、変形性関節症の高齢者の人工膝関節置換術前後の身体活動パターンを示しています。このグラフでは、術後に身体活動量の急激な低下が見られますが、数カ月かけて回復していく様子が可視化されています。
今後、身体活動量がベースライン以上に回復した被験者を、治療に対する良好な反応者として特定することができるかもしれません。さらに、図5Cは、中等度の肺増悪を受けた嚢胞性線維症の単一の被験者の身体活動および肺機能を表示しています[7]。臨床イベントと回復期が明確に識別でき、図5Aで提案されたいくつかの特徴を抽出することができるのです。

デジタルバイオマーカー/エンドポイントが臨床にもたらす可能性
技術的・臨床的観点のバリデーションを終え、正しくデジタルバイオマーカー/エンドポイントの候補を選定し、それらが真のエンドポイントとして認められた場合、重要な測定値を高い頻度でサンプリングでき、医師は患者の健康状態をより総合的に把握することができるかもしれません。例えば、困難な患者の診断のサポート、リスクカテゴリーに基づく患者の層別化、薬学的な反応マーカー、従来の外来診療所への訪問に加えてモニタリングツールとして提供、さらには入院後だけではなく退院後の健康状態の予測・観察に役立てることができます[8][9]。
このようなヘルスケアの未来を実現するには、診断とフォローアップを目的に稼働するアルゴリズムやそれらを扱うことのできる病院内のデータインフラ及び人的リソース・スキルの改善に向けた積極的なアプローチが必要です。そして、これらの実現する要件は厳しいものであり、この記事内で整理させていただいたステップ以外にも、長い臨床検証のプロセスが必要になると思います。本当に本当に一朝一夕でできることが多くない領域ではございますが、技術的・臨床的な観点の課題をひとつひとつクリアしていけるように頑張り続けたいと思います。
最後に
弊社では、臨床試験のデジタル化、バイオマーカーの開発に向けたデータ収集・分析基盤をご用意しております。社内で蓄積された数々のスタディやノウハウなど、少しでもご興味を持っていただいた方は、お気軽にご連絡ください。
https://www.selfbase.jp/
参考文献
[1] Kruizinga MD (2020) Development of Novel, Value-Based, Digital Endpoints for Clinical Trials: A Structured Approach Toward Fit-for-Purpose Validation The American Society for Pharmacology and Experimental Therapeutics.
[2] Kruizinga MD (2020) Finding suitable clinical endpoints for a potential treatment of a rare genetic disease: the case of ARID1B, Neurotherapeutics.
[3] Chan (2009) Assessing the effects of weather conditions on physical activity participation using objective measures, Int J Environ Res Public Health 6:2639–2654.
[4] Steele BG (2000) Quantitating physical activity in COPD using a triaxial accelerometer, Chest 117: 1359–1367.
[5] Depp CA (2019) GPS mobility as a digital biomarker of negative symp- toms in schizophrenia: a case control study, NPJ Digit Med 2:108.
[6] Kruizinga M (2019) Activity and pulmonary function collected via a non invasive platform differentiate healthy and asthmatic children - Selected abstracts from pharmacology 2019, Br J Clin Pharmacol 86:1182–1183.
[7] Kruizinga M (2019) Activity and pulmonary function collected via a non invasive platform differentiate healthy and asthmatic children - Selected abstracts from pharmacology 2019, Br J Clin Pharmacol 86:1182–1183.
[8] Burnham JP (2018) Using wearable technology to predict health outcomes: a literature review, J Am Med Inform Assoc 25:1221–1227.
[9] Coravos A (2019) Developing and adopting safe and effective digital biomarkers to improve patient outcomes, NPJ Digit Med 2:14.
この記事が気に入ったらサポートをしてみませんか?
