Off Flavor入門〜⑩エネルギーと反応
前回からの続き
前回は分子軌道のHOMOとLUMOに着目した反応理論であるフロンティア軌道論についてでした。今回はその反応を引き起こす要因となるエネルギーについてです。
熱力学の法則を出していますが、物理学的な専門性がある記述にはなっていません。イメージだけふわっとお借りしてる感じです。誰もそこまでは期待してないと思いますが念のため。
エネルギーと熱力学
エネルギーの代表的なものは熱エネルギーです。温度が上がると液体の水は水分子(H2O)同士の水素結合を断ち切って気体になり、より自由に動き回ります。さらに高温下では水分子のO-H結合も切れます。もっと極端な状況、ビッグバン直後の原始宇宙は100兆から1000兆℃と推定されており、この高エネルギー下では陽子も中性子も存在できずバラバラになった素粒子が激しく運動していたそうです。
熱エネルギーが上がると運動性が上がり、化学反応が促進されるというのは直感的にも理解しやすいと思います。
熱力学の法則

熱力学第一法則によると、エネルギーは勝手に生じたり減ったりすることはありません。あらゆるエネルギーの移動が遮断された孤立系におけるエネルギーの総量(エンタルピー)は一定で、変換されてもエンタルピーは変わりません。もし缶ビールが孤立系だとすると、缶の中のエネルギーはどう変換されてもエンタルピーは一定ということになります。ただもちろん実際にはビールは様々なエネルギーの影響で変化していきます。

実際の缶ビールには外からのエネルギーの入力があります。例えば熱エネルギーとか振動による運動エネルギーとか。瓶だったら光エネルギーも入ってきますね。それらの外部からのエネルギーを極力遮るために、要冷蔵が推奨されます。でも要冷蔵にすればビールは劣化しないかというとそうでもありません。熱力学第三法則によると絶対零度(0K=−273℃)でエントロピーがほぼゼロに近づくそうです。逆にいうと冷蔵温度である5℃(278K)だとまだまだエネルギーの影響を受けます。ビールには様々な成分の化学結合エネルギーがあり、外部からのエネルギーの影響を引き金にして様々な反応を連鎖的に引き起こします。
エントロピー増大則
熱力学第二法則はエントロピー増大則として有名です。エネルギー変換のたびに無秩序は増えていき、その変化は不可逆的です。水に絵の具を垂らすと徐々に絵の具が混ざり、やがて均等に水に混ざってしまいます。一旦混ざってしまうと水と絵の具を再び分離することはできません。ビールの劣化・老化も不可逆的に進むのでエントロピーと言えます。一度劣化したビールを新鮮な状態にすることは通常はできません。ただし、オフフレーバーがすべて不可逆的というわけではなく、ダイアセチルのように可逆的に反応させて取り除けるものもあります。

エントロピーとして無秩序化したエネルギーは使うことができません。等温等圧下での利用可能なエネルギーをギブスの自由エネルギー(G)といいます。エンタルピー(H)、絶対温度(T)とエントロピー(S)との関係は以下のとおり。
H = G + TS
これが転じて、
G = H - TS
利用可能なエネルギーは総エネルギーから無秩序を除外したものです。反応を繰り返すことでエントロピーが不可逆的に増大していくので、理屈の上ではビールの劣化は最初の頃は大きく進み、その後は化学反応に利用可能なエネルギーが少なくなりだんだん変化が緩やかになるのかもしれません。出来立てから1ヶ月の間には急激に劣化しても、6ヶ月後から1年後までの半年間の変化は比較的緩やかという感じ。
また、温度が自由エネルギーに与える影響はとても大きいです。ずっと低温でキープできれば理想的です。ただ最初にある程度の高温で自由エネルギーを減らし、そのときにある程度美味しければどうでしょうか?容器内発酵やパス(低温殺菌)はエントロピー増大則的にも理にかなっているのかもしれません。
ちなみに熱力学の法則は時間の経過を扱っているものではないので、ここで私が引き合いに出している「6ヶ月後」とか「ずっと低温でキープ」とかいうのは熱力学の法則によって導出される根拠ある仮説ではなく、熱力学の法則に一般的な例を無理やりくっつけた空想です。
反応とエネルギー
位置エネルギーと運動エネルギー

エネルギーはいろいろな形をとります。熱エネルギー、電気エネルギー、光エネルギー、化学エネルギーなど。それらの様々なエネルギーを大きく2つに分類したのが、位置エネルギー(ポテンシャルエネルギー)と運動エネルギーです。位置エネルギーは物理的に高い位置にあるなどの条件下で蓄えられたエネルギーであり、きっかけがあると運動エネルギーに変換されます。
化学結合も位置エネルギーの一種で、結合エネルギーとして蓄えたものが反応によって放出されることで、化学反応を駆動します。
発エルゴン反応と吸エルゴン反応
化学結合は反応によって運動エネルギーを放出したり吸収したりします。典型的には複雑な高分子が低分子に変わるとエネルギーが放出され、逆にエネルギーを吸収することで低分子が高分子になります。
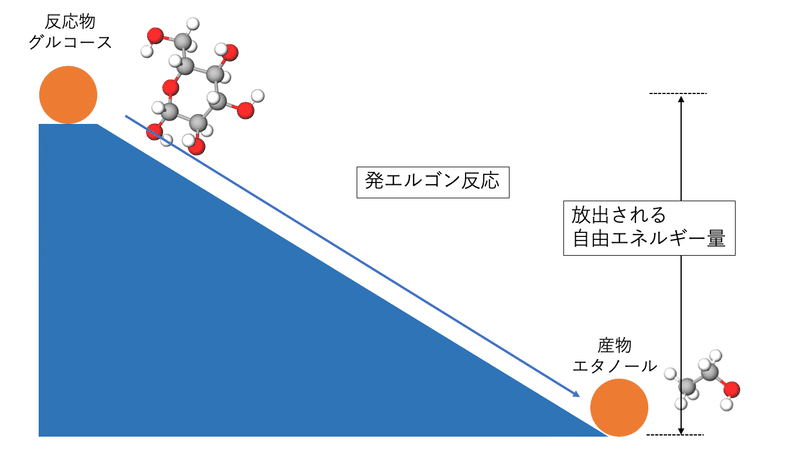
グルコースが分解されて産物としてエタノールができるときにエネルギーが放出されます。これが発エルゴン反応です。ビールの発酵のときには発酵熱が出るので経験的に分かりやすいやすいですよね。発熱反応とも言われますが、熱だけが放出されるというより自由エネルギーの放出に着目しているので、ここではより広範囲な用語である発エルゴン反応とします。
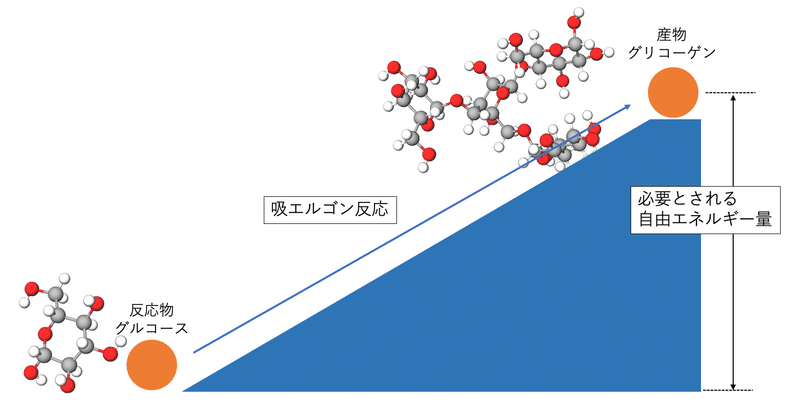
グルコースからグリコーゲンを合成する反応は多くの自由エネルギーを必要とする吸エルゴン反応です。
発エルゴン反応と吸エルゴン反応は車の両輪のように反応を駆動します。
ΔG = G(産物) - G(反応物)
式で表すと産物と反応物の差がマイナスの場合は発エルゴン反応、プラスの場合は吸エルゴン反応です。
これらのエネルギーを利用した反応は、生物が関与することでより複雑なものになります。生物の関与については次回以降に説明します。
化学平衡とエネルギー

乳酸を水(麦汁)に入れる操作はビール造りではよく行われますよね。このとき乳酸からプロトン(H+)が放出されることでpHが下がりますが、すべての乳酸分子からプロトンが解離するわけではありません。例えばpH3.9付近では解離する割合は半分くらいになります。
AH ⇌ A- + H+ (A=酸、H=水素)
Ka(酸解離定数) = [A-] [H+] / [AH]
両向きの矢印で反応がどちらにも向かっていることを示しています。Kaが定数なのでこの反応は平衡であることが分かります。(平衡については以前の投稿も参照ください)
こういう平衡状態はエネルギーの変化量ΔGがゼロになった状態であるということもできます。逆にいうと反応が進むということは、産物と反応物の間にエネルギーの差があるということです。お風呂を沸かすときに最初は温度差があっても徐々にお湯の温度は均一になりますよね。化学反応も熱エネルギーも平衡になるまで進むという性質があります。実際の化学反応では産物とエネルギーの間に差があってもそれだけでは反応が進まないことが多いです。ここに関与する活性化エネルギーという概念は次回以降説明します。
次回へと続く
今回は反応に関連するエネルギーについて基礎的な内容をざっくりと見てみました。反応にはエネルギーが大きく関与していますが、そこにさらに生物が関与することで大きな違いが生まれます。ビールは酵母という生物が大きく関与して造りあげるものなので、生物学的な反応は無視できません。ただ単にエネルギーがあるだけだと、様々な反応がランダムに進むだけです。そこに生物が関与することでまるで建築物のような秩序を持った生成物ができるわけです。というわけで次回は代謝と酵素について。
お読みくださりありがとうございます。この記事を読んで面白かったと思った方、なんだか喉が乾いてビールが飲みたくなった方、よろしけばこちらへどうぞ。
定番品リブランディングのお知らせを再掲します。「Far Yeast 東京シリーズ」「Far Yeast 源流シリーズ」を終売し、Far Yeastシリーズとしてリブランディングします。発売は6月とまだ少し先ですが、楽しみにお待ち下さい。

この記事が気に入ったらサポートをしてみませんか?
