
たんぱく質のミクロな世界~立体構造編~
いつも読んでいただき
ありがとうございます。
さおりんです。
前回は、
たんぱく質の小さく分解された
アミノ酸の構造について
さらっとご紹介しましたが、
今回はさらに顕微鏡の世界での
ミクロな立体構造について
一緒に見ていきましょう。
たんぱく質のはたらきを考えるうえで、
アミノ酸配列の折り畳まれ方が
重要な意味を持ちます。
アミノ酸配列というたんぱく質の基本的
な形を一次構造と呼びます。
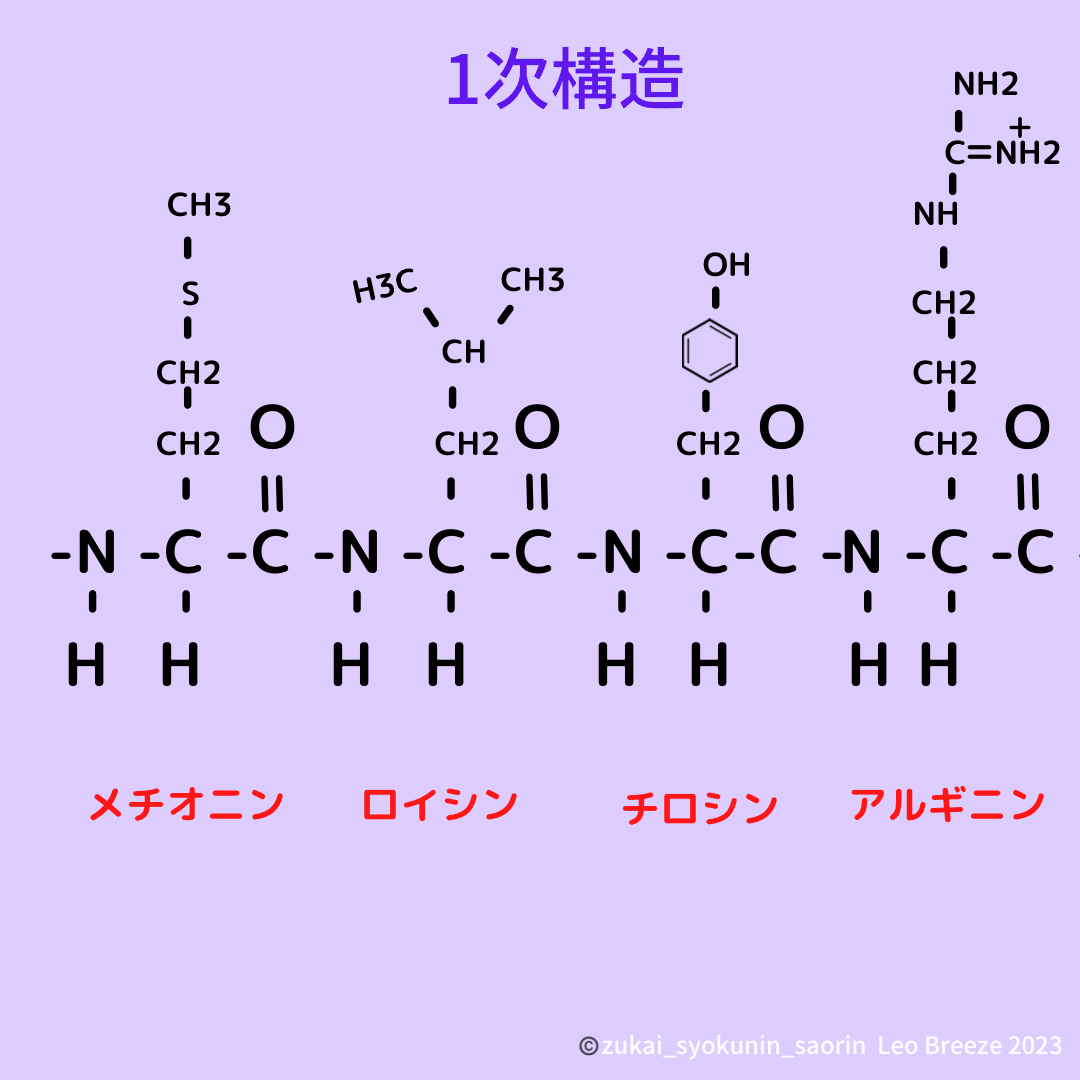
このアミノ酸の側鎖の構造により、
種類が決まってきます。
側鎖同士の相互作用で
さらに高次の構造が
形作られていきます。
まずはある決まった形がつくられます。
αヘリックス(らせん状)とβシート(板状)
と呼ばれる構造です。

βシートを形成する
一本ずつのアミノ酸配列は
βストランドといいます。
αヘリックスは、
あるアミノ酸の酸素元素(O)と
そのアミノ酸から4つめのアミノ酸の
水素原子(H)との間に形成される
「水素結合」が基本となって
形成されています。
この水素結合が
それぞれのアミノ酸との間で
順次形成されることにより、全体として
らせん状のコイルを巻くのです。
一次構造のアミノ酸配列全体が
そうなるのではなくて、その一部が
らせん状になります。
αヘリックスは、どのたんぱく質にも
必ず1つ以上はあると考えられるほど、
多くのたんぱく質で見られる基本形です。
βシートはアミノ酸配列同士がやはり、
水素結合によってゆるく結びつくことに
より、規則的に折り畳まれたアミノ酸の
鎖が全体的に板状に広がった形
になります。
これも多くのたんぱく質で見られる
基本形の1つです。
一次構造を元にして作られるこうした
部分的な基本形を二次構造といいます。
しかし、二次構造でも、
それでもまだたんぱく質としてうまく
働くところにまでは到達しません。
この二次構造同士がほかのアミノ酸の
側鎖の力も関係しながらさらに複雑に
折り畳まれていったところで、ようやく
そのポリペプチドは、あたかもボウフラ
が蚊になるがごとく、ヤゴがトンボに
なるがごとくたんぱく質になります。
何が言いたいかというと、
たんぱく質はそこにはなんらかの役割
を果たす機能的な状態が必要です。
ポリペプチドとはペプチドという
分子同士のつながりにすぎず、
ポリペプチドとたんぱく質には、
幼虫と成虫ほどの差があります。
二次構造がさらに複雑に
折り畳まれていき、ようやくたんぱく質
と呼ばれるにふさわしい状態となった時
私たちは三次構造と呼ばれます。

図で表したのは、教科書にも出てくる
典型的なたんぱく質であるリゾチーム
です。
二次構造のαヘリックスやβシートが
あちらこちらで形成されており、
全体が折り畳まれています。
これがリゾチームの三次構造であり、
この形をとってはじめてポリペプチドは
リゾチームとしての働きができます。
たんぱく質の立体構造をリボンのように
描いたこのモデルをリボンモデルと
言います。
細胞の中で働くたんぱく質は
チームで成果を出すのです。
三次構造を作ってたんぱく質として
自立したはずのポリペプチドだけど
なにかのはたらきをしようとしても
なかなか一人では効率よく仕事が進まない
という場合が多いです。
細胞の内部は極めて多くの分子が
ひしめきあった、芋を洗うがごとき状態
になっているし、化学反応の種類も膨大
で複数の化学反応が協調しながら、
複雑にからまりあって細胞の活動を
支えているからです。
そこでたんぱく質は、いくつかの仲間
が集まって一つのチームを作り、
協同して成果を出していきます。
たとえば、遺伝子の転写にかかわる
RNAポリメラーゼⅡと呼ばれる
たんぱく質があります。
このたんぱく質は、三次構造を作った
一個のポリペプチドから
できているわけではなく、
じつに12種類ものポリペプチドから
寄り集まってできた、
巨大なたんぱく質の複合体なのです。
こういう状態になってはじめて
このたんぱく質の複合体は、
RNAポリメラーゼⅡという名前に
ふさわしい役割を果たすことができます。
このように、三次構造をつくった
ポリペプチドがいくつか集まって、
1つの役割を果たすたんぱく質の複合体
ができる場合、
その構造を四次構造といいます。

たとえば、私たちの赤血球に存在し、
酸素を運搬する役割を持つ
たんぱく質「ヘモグロビン」は、
α、βの2種類ある「グロビン」という
名のたんぱく質(ポリペプチド)が、
2個ずつ集まってつくられた四次構造を
形作っています。
そして、この四次構造を作っている、
三次構造をとったそれぞれの
ポリペプチドのことを、特別に
「サブユニット」といいます。
それぞれのサブユニットは、
たんぱく質としては独立したものである
にも関わらず、四次構造においては
単なる構成員にすぎません。
たんぱく質に熱を加えると構造は
どうなっていくのでしょうか。
たとえば、目玉焼きをつくった時、
それまで透明だった白身が真っ白になる
のは卵白に含まれるたんぱく質
(多くは、オボアルブミン)の三次構造が、
熱により壊されてしまい、結果お互いに
凝集(硬くぎゅっと集まってしまうこと)
してしまいます。
これがたんぱく質の変性です。
変性とは、平たく言えば
「形を変え、はたらきを失ってしまう」
ということです。
熱が加わると、たんぱく質のこの
三次構造が変化し、往々にして
はたらきが失われます。
ときには二次構造までも変化します。
言い方を変えると、通常、
熱による変性などの場合、
アミノ酸配列上で変化が起きることは
ありません。したがって基礎構造の
一次構造は変化しないです。
食品を熱で加工しても、
そのたんぱく質の栄養価が
下がってしまうことはありません。
アミノ酸の組成(たんぱく質中のアミノ酸
が含まれる割合)は変わらないです。
熱で加工することで
たんぱく質の形が変化し、
消化酵素であるペプシンやトリプシン
などの作用を受けやすくなる面もあります。
たんぱく質の栄養価は、そのたんぱく質
に含まれるアミノ酸の組成により
決まります。
食品を熱で加工するとたんぱく質は
変性しますがたんぱく質自身が失活しても
アミノ酸の組成は変化しません。
牛肉のたんぱく質は、焼かれることにより
筋肉のたんぱく質としてのはたらきは
失われてしまうが、アミノ酸組成そのもの
は変わりません。
アミノ酸配列は変化しないので、
変性してしまったたんぱく質を
元のはたらきがある状態に戻そうと思えば
元に戻る潜在的な可能性は残っています。
しかしそう簡単にはいきません。
熱によって変性したたんぱく質が、自然の
状態で元に戻ることはまずないです。
その可能性は、別れた恋人同士が
ヨリを戻す確率よりもはるかに低く、
限りなくゼロに近いといっていいでしょう。
変性はたとえば
多くのたんぱく質では、
60℃以上に加熱されるとたんぱく質自身、
その周囲にあってたんぱく質と軽く
結びついている水の分子(水和)の運動が
激しくなります。
すると、四次構造は壊れ、三次構造を
形作っているアミノ酸側鎖同士、
二次構造同士のさまざまな結合(水素結合、
疎水結合)が破壊され、三次構造が大きく
変化します。
通常、たんぱく質は、内部に疎水性部分
(水が嫌いなので内側に閉じこもった部分)
があるが、加熱によって三次構造が
大きく変化すると、こうした
水が嫌いな部分が表に出てしまいます。
すると、なんせ水が嫌いだから
悲鳴を上げるのもそこそこに
他のたんぱく質の、やはり表に出てきた
疎水性部分同士でいそいそと
結合しあうことになります。
こうして、たんぱく質の分子同士が
凝集し不溶化してしまいます。
少し長くなってきそうなので
次回は火を扱うメリットについて
さらに詳しくご紹介していきます。
ここから先は、
アフィリエイトプログラムを利用して
商品のプロモーションをしております。
ここまで読んでいただき
ありがとうございました。
さおりんでした。
ここから先は、
アフィリエイトプログラムを利用して
商品のプロモーションをしております。
こちらの記事は、私が尊敬する
武村政春博士の著書「たんぱく質入門」
から、LGBTQのジェンダー種族そして
ADHD・HSPなどの繊細敏感種族いわゆる
繊細感覚派のマイノリティ向けに、
最高傑作としての愛する自分として
最幸な人生を生きられるギフトとして
私の体験や主張も入れてまとめています。
ぜひ、武村先生の本を読んでみてくださいね。
たんぱく質入門 どう作られ、どうはたらくのか (ブルーバックス) [ 武村政春 ]
価格:1100円(税込、送料無料) (2023/3/6時点)
楽天で購入
この記事が気に入ったらサポートをしてみませんか?
