
7-8. 電気分解(1)
こんにちは、おのれーです。
いよいよ化学基礎も最終項目「電気分解」です。とはいっても、発展項目なので、詳しくは専門科目の『化学』で学ぶことになっているので、ここでは基本的なところだけ確認していきたいなと思います。
■電気分解は、強制的に酸化還元反応を起こすこと!
電気エネルギーを与えて、強制的に酸化還元反応を起こすことを、電気分解もしくは電解といいます。
それでは、電子の流れに注目をして、電気分解ではどのような反応が起きているのかを確認してみましょう。
では、電解装置の陰極・陽極での反応をそれぞれ確認してみましょう。
★ 陰極:電源の負極と接続した電極。還元反応が起こる。
電池の負極では電子を吐き出す反応=酸化反応が起こるので、負極とつながっている陰極では、電子を受け取る反応=還元反応が起こります。
★ 陽極:電源の正極と接続した電極。酸化反応が起こる。
電池の正極では電子を吸い込む反応=還元反応が起こるので、正極とつながっている陽極では、電子を吐き出す反応=酸化反応が起こります。
「正」と「陽」は「+」、「負」と「陰」は「-」というイメージがあると思うので、それぞれ同じ反応が起こると錯覚してしまうのですが、実は異なるところが、理解を難しくさせるところです。電源装置の電極は「正・負」、電解装置の電極は「陽・陰」であることに注意して、理解をするようにしてください。
■電気分解で、具体的にどんな反応がおこるのか?
電気分解において、陰極では外部から電子が流れ込むので、イオンや分子が電子を受け取る還元反応が起こります。一方、陽極ではイオンや分子が電子を失う酸化反応がおこります。
では、具体的にはどのような反応が起こるのでしょうか。具体的に考えてみましょう。
【陰極での反応】 =還元反応
陰極では、マイナスの電荷をもった電子e-を受け取る必要があります。マイナスと仲が良いのはプラスということで、注目Pointはつぎの2点です。
① 水溶液中の陽イオン
② 水溶液の性質
水溶液中の陽イオンのイオン化傾向が、水素Hよりも小さいとき、そのイオンはイオンよりも金属の単体でいる方が幸せなので、電子をもらって金属の単体になり、析出ます。
一方、水溶液中の陽イオンのイオン化傾向が、水素Hよりも大きいときは、そのイオンはイオンでいる方が幸せなので、水溶液中にいる水素イオンH+が身代わりになって電子をもらい、気体の水素H2が発生します。
このとき、水溶液の性質が酸性だと、水溶液中に水素イオンH+がたくさんありますが、中性や塩基性の場合には、水H2Oが電離して水素イオンを提供する必要があるので、反応式が異なります。
陰極で起こる反応をフローチャートでまとめたのが以下の図です。

頭の中でこのフロチャートにしたがって条件を整理いていけば、陰極で何が起こるかは分かるようになると思います。
【陽極での反応】 =酸化反応
陽極では、電子e-を放出して酸化する必要があります。ということで、考えられるのは「金属が溶けて陽イオンになる」「陰イオンが電子を放出して単体になる」という可能性です。したがって、注目Pointはつぎの2点です。
① 電極の材質
② 水溶液中の陰イオン
③ 水溶液の性質
電極の材質が、非金属である炭素Cや、イオン化傾向の小さい白金Ptや金Auでない場合、電極の金属が溶けだして陽イオンとなることで、電子e-を放出します。
しかし、電極の材質が炭素Cや白金Ptだった場合は、水溶液中の陰イオンが身代わりになって、電子e-を放出する必要があります。このとき、真っ先に身代わりを申し出てくれるのは、ハロゲン(17族:F, Cl, Br, I)のイオンです。水溶液中にハロゲンのイオンがある場合は、ハロゲンのイオンが電子を放出して、ハロゲンの単体が生成します。ハロゲンのイオンがない場合は、水溶液中の水酸化物イオンOH-が身代わりになって電子を放出し、酸素O2が発生します。
このとき、水溶液の性質が塩基性だと、水溶液中に水酸化物イオンOH-がたくさんありますが、酸性や中性の場合には、水H2Oが電離して水酸化物イオンを提供する必要があるので、反応式が異なります。
陽極で起こる反応をフローチャートでまとめたのが以下の図です。

■いろいろな電気分解
先程で出てきたフローチャートを使って、いろいろな水溶液と電極での電気分解で、どのような反応が起こるのかを確かめてみましょう。
◎塩化銅水溶液の電気分解
◆電極が銅板の場合
<陰極での反応>
陰極では、水溶液中の銅(Ⅱ)イオンが電子を受け取って、金属の銅Cuが析出するという反応が起こります。

<陽極での反応>
陽極では、電極の銅Cuが溶けだして電子を放出し、銅(Ⅱ)イオンCu2+になるという変化が起こります。

◆電極が白金板の場合
<陰極での反応>
陰極では、水溶液中の銅(Ⅱ)イオンが電子を受け取って、金属の銅Cuが析出するという反応が起こります。

<陽極での反応>
電極板がイオン化傾向の小さい白金Ptなので、溶けだすことはありません。代わりに、水溶液中に存在するハロゲン化物イオンである塩化物イオンCl-が電子を放出し、塩素Cl2が発生します。

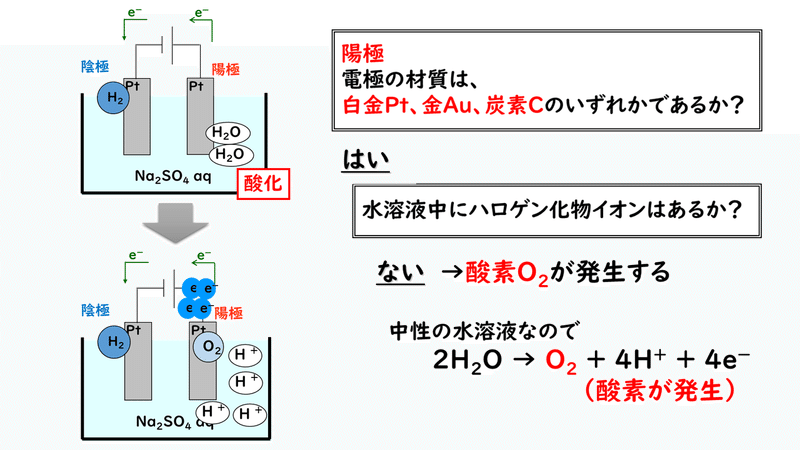
◎硫酸ナトリウム水溶液の電気分解(電極:白金Pt)
<陰極での反応>
水溶液中の金属イオンであるナトリウムイオンNa+はイオン化傾向が大きいので、水素イオンH+が身代わりになって電子を受け取り、水素H2が発生します。

<陽極での反応>
電極はイオン化傾向の小さい白金Ptなので、溶けることはありません。また、水溶液中にハロゲン化物イオンも存在しないので、水酸化物イオンOH-が電子を放出し、酸素O2が発生します。
今回はここまでです。まずは、反応式までは書けなくてもよいので、電解装置の陽極・陰極のそれぞれでどのような反応が起こるのか、フローチャートにしたがって判断していけるように、練習してみましょう。
次回はいよいよ最終回(たぶん)です!お楽しみに!
この記事が気に入ったらサポートをしてみませんか?
