
7-7. 電池(2)
こんにちは、おのれーです。
前回は、「電池とは酸化還元反応(電子のやり取り)によって生じた化学エネルギーを、電気エネルギーに変える装置なのだ」ということを、その発見と改良の歴史とともに確認していきました。
でも、ボルタの電池やダニエルの電池は、私たちが知っている電池と大きく見た目も違っていたと思います。
そこで今回は、私たちの生活の中で使われている、実用的な電池についてみていきたいと思います。
■充電できる電池、できない電池??
最近は、スマホでもパソコンでも、充電して使うことができる電子機器類が増えてきましたが、乾電池などは一度使ったら再利用できないものもあります。充電できる電池と、できない電池の違いは、どこにあるのでしょうか?
そもそも、電池から電気エネルギーを取り出すことを放電といいます。一方、放電した電池に外部から電気エネルギーなどを与えて、無理やり放電の逆向きの反応を起こすことを充電といっています。
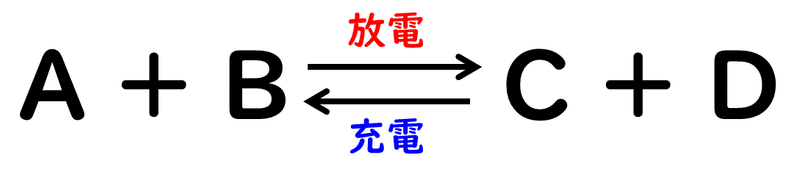
放電は、二種類の異なる金属板と電解質溶液さえあれば、自動的に勝手に起こる反応です。買ってきた乾電池を何年も使わないまま置いておくと使えなくなってしまうのも、自然に放電してしまうからです。
しかし、充電は意図的に外部からエネルギーを与えないとできません。スマホのバッテリーが切れて、しばらく放置しておいたら充電が満タンになっていた、などということはないわけです。コンセントのあるカフェの人気が上がるわけですね・・・。
ただし最初にも触れたように、電池であれば何でも充電できるわけではありません。電池であっても、一回放電すると充電できない一次電池と、充電して繰り返し使える二次電池(蓄電池)があります。
なぜ充電ができるものと、できないものがあるのでしょうか?
簡単にいってしまうと、放電によって生じた生成物を、元の物質に再生することができるかどうかというところが鍵になります。
たとえば、木を燃やして炭にしたとき、炭を元の木に再生することはできないと思います。でも、酸化鉄(さびた鉄)を還元して鉄を取り出すということは、技術的には可能です。
このように、一度反応してできた物質を、何らかの方法によって元の物質に戻すことができるかどうかが、充電できるか、できないかに関わっているのです。
ただし、充電できる物質であったとしても、何百回も繰り返し充電するとだんだん性能が衰えてきます。買いたてのスマホは電池が長くもったのに、何年間か使うと、すぐに電池が無くなってしまうという経験をしたことのある方はいませんか?
それは、いくら放電と逆向きの反応が可能で、元の物質に戻すことができたとしても、"完全に元通り"になるということはないからです。だから、充電池にも寿命があるのです。
■乾電池は、なんで「"乾"いた電池」と書くのか?
前置きが長くなってしまいましたが、ここから少し具体的に、実用的な電池についてみていきたいと思います。
まずは乾電池です。乾電池、何で「"乾"いた電池」と書くのでしょうか?
その理由は「電池」の「池」という漢字にヒントがあります。
「池」という漢字の部首は"さんずい"ですから、水に関わっている漢字だということができます。事実、ボルタやダニエルが発明した電池は、電解質水溶液として、希硫酸や硫酸亜鉛水溶液、硫酸銅(Ⅱ)水溶液などの液体が使われていましたので、初めの頃の電池は、液体がこぼれやすい電池だったのです。
しかし、1888年、ドイツのガスナーが、電解質水溶液をセッコウでかため、持ち歩いても中の液体がこぼれない電池を発明しました。これによって、電池は使いやすくなり、世界に広まったと言われています。そして、この液体ではない電池のことを、「乾いた電池=乾電池」と呼ぶことになったのです。英語ではそのまんま、dry cell(乾いた電池)と言います。
ちなみに、その3年前の1885年、日本人の屋井先蔵という人も独自に乾電池を作っています。しかし、特許の申請費用が用意できなくてすぐには出願できなかったため、第一号とはならなかったようです。
乾電池にもいくつかの種類があります。ここでは4種類を紹介したいと思います。
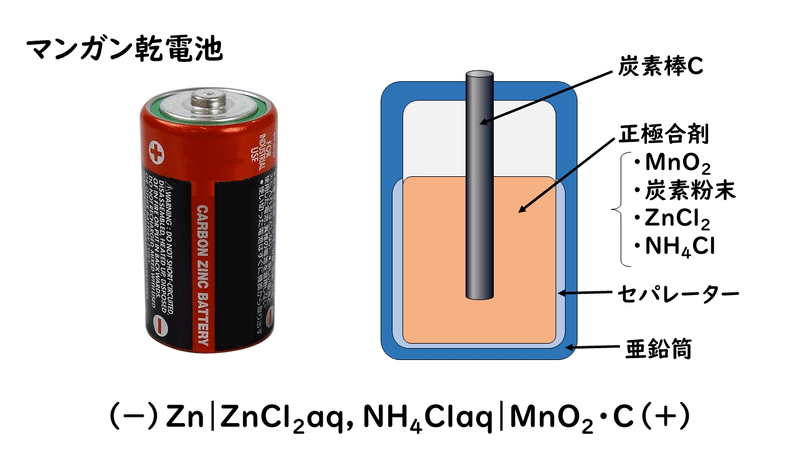
①マンガン乾電池
マンガン乾電池は、懐中電灯などのように時々使うもの、短時間くり返し使うものに用いられています。
負極活物質が亜鉛Zn、正極活物質が酸化マンガン(Ⅳ)MnO2で、電解液には塩化亜鉛ZnCl2を主体に、塩化アンモニウムNH4Clを少量加え、それを糊と練り合わせてこぼれないようにしたものを使っています。
②アルカリマンガン乾電池
アルカリマンガン乾電池は、マンガン乾電池よりも大容量で電圧低下が少ないので、強力ライトなど大きな電流で使うものや、ラジカセなど連続して使うものに利用されています。
負極活物質は亜鉛Zn、正極活物質は酸化マンガン(Ⅳ)MnO2と、マンガン乾電池と同じものを使っていますが、電解液には酸化亜鉛ZnOを飽和させた水酸化カリウムKOH水溶液を用いているところが異なります。電解質水溶液がアルカリ性であることから、"アルカリ"マンガン乾電池と呼ばれています。

③酸化銀電池
酸化銀電池は小型で、長期保存が可能なので、腕時計や電子体温計などの精密機器にボタン型電池として使われています。
負極活物質が亜鉛Zn、正極活物質が酸化銀Ag2Oで、電解液には濃厚な水酸化カリウムKOH水溶液を用いています。

④空気電池
空気電池もボタン型電池として、補聴器などに使われています。
負極活物質が亜鉛Zn、正極活物質が空気中の酸素O2で、電解液には濃厚な水酸化カリウムKOH水溶液を用いています。シールをはがすと、表面から空気中の酸素O2を取り込んで反応が始まります。

■元祖二次電池の代表格、鉛蓄電池!
鉛蓄電池は、自電車のバッテリーに使われている電池で、充電することができる二次電池です。
負極活物質が鉛Pb、正極活物質が酸化鉛(Ⅳ)PbO2で、電解液には希硫酸H2SO4を用いています。
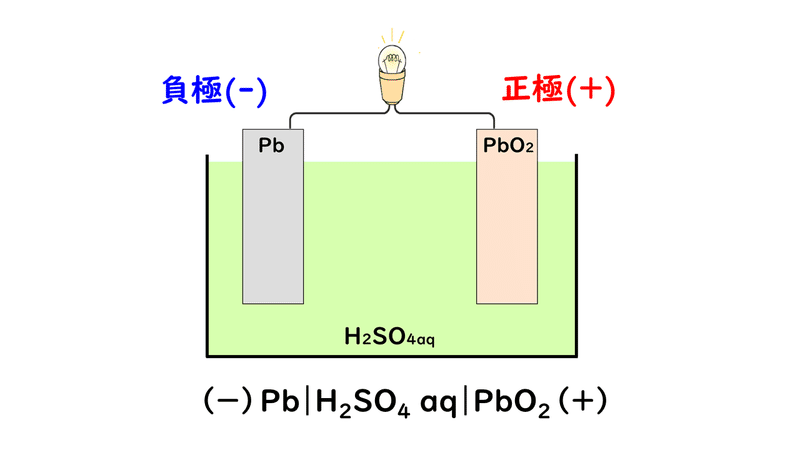
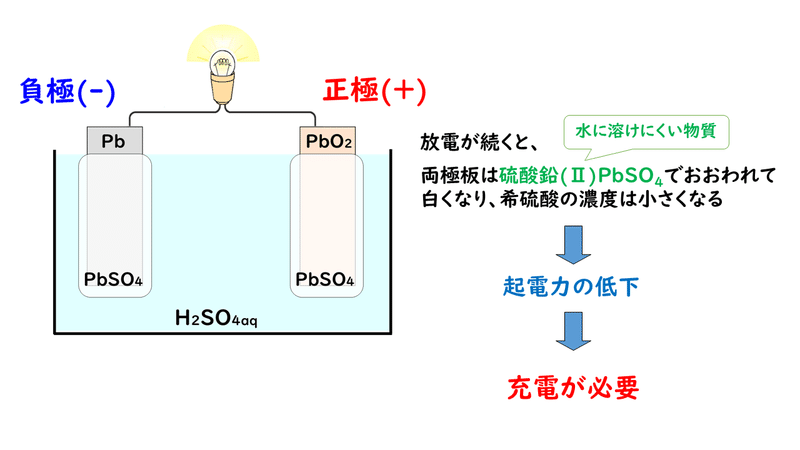
ではまず、放電時の反応について見ていきましょう。
①負極の鉛Pb板が溶けて、電子e-を放出し、鉛(Ⅱ)イオンPb2+になります。
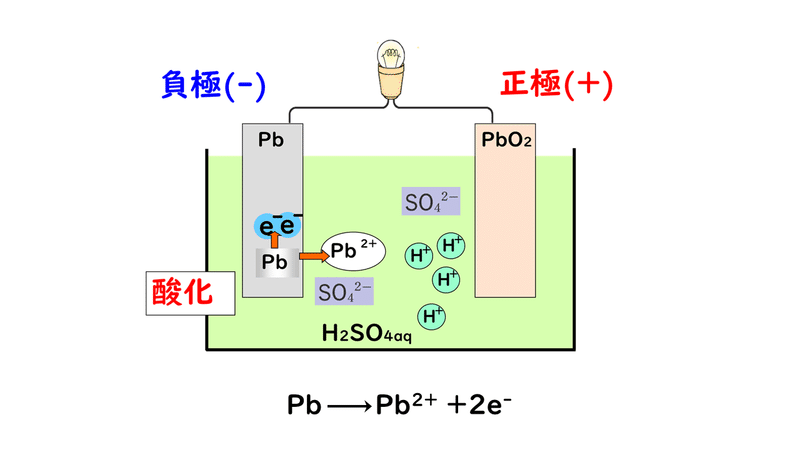
②さらに負極でPb2+が水溶液中の硫酸イオンSO4 2-と反応し、水に不溶の硫酸鉛(Ⅱ)PbSO4になります。
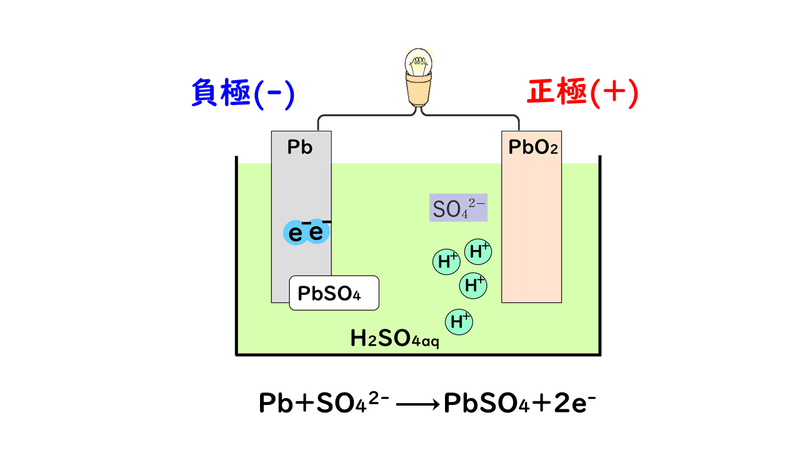
③電子が負極から正極に移動する。
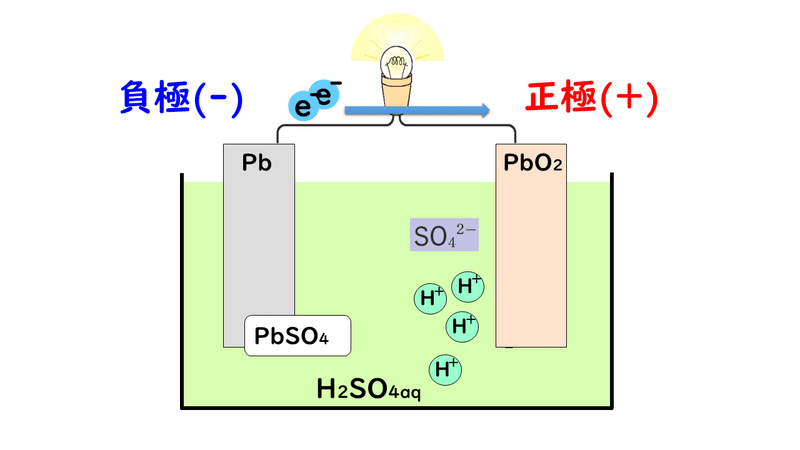
④正極で酸化鉛(Ⅳ)と、硫酸H2SO4が電離して生じた水素イオンH+と硫酸イオンSO42-が電子を受け取り、硫酸鉛(Ⅱ)PbSO4と水H2Oが生成する。
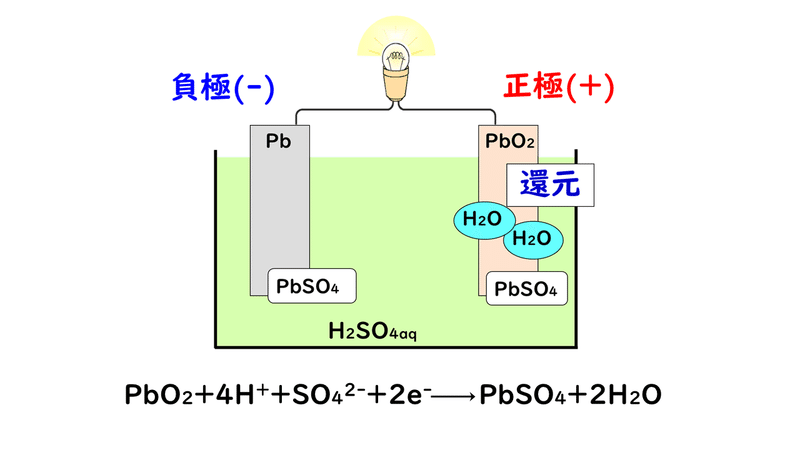
ここまでの放電の反応を、1つの反応式にまとめてみると、次のようになります。
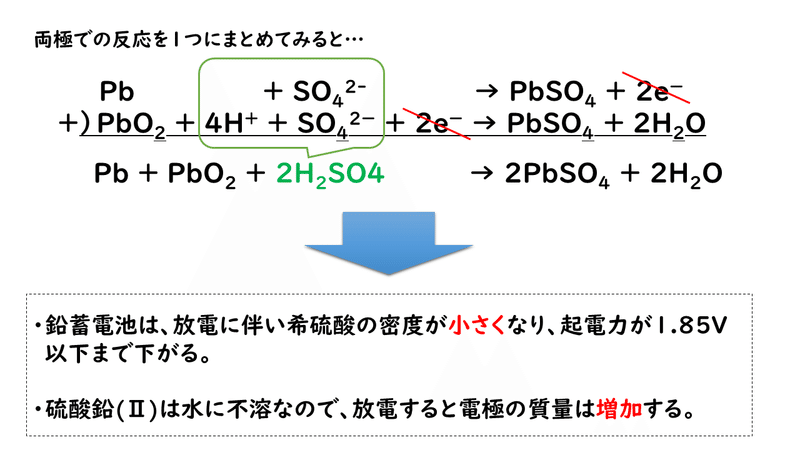
このように、放電が続くと、正極・負極のいずれにも硫酸鉛(Ⅱ)PbSO4がこびりついていき、希硫酸は減少していくため、反応が起こりにくくなり、起電力が低下します。そして、やがてそのままでは使うことができなくなり、充電が必要な状態になります。
では、充電はどのようにして行われるのでしょうか?
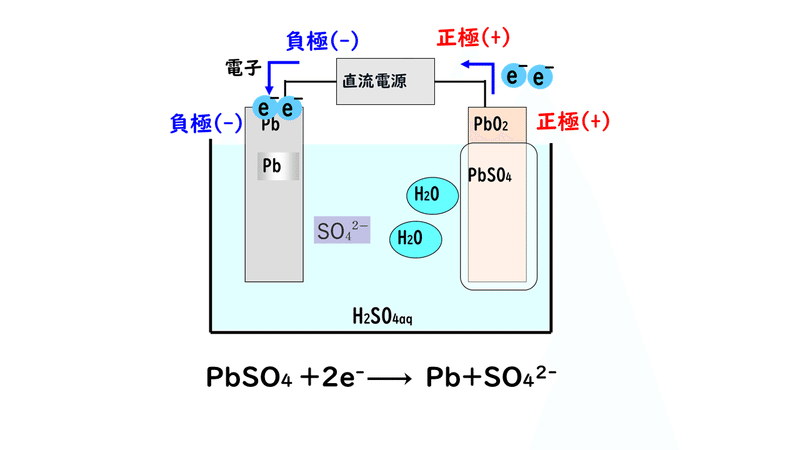
まず、充電には外部電源(コンセントから供給する電流など)が必要です。そして、外部電源の負極に鉛蓄電池の負極、外部電池の正極に、鉛蓄電池の正極をつなぎます。
反応を具体的に見てみましょう。
①外部電源の負極から放出された電子e-を、鉛蓄電池の負極にへばりついている硫酸鉛(Ⅱ)が受け取り、元の鉛Pbと硫酸イオンSO4 2-に戻ります。
②外部電源の正極では電子e-吸い込む(受け取る)反応をします。そこで、鉛蓄電池の正極にへばりついている硫酸鉛(Ⅱ)が受け取り、元の鉛Pbと硫酸イオンSO4 2-に戻ります。
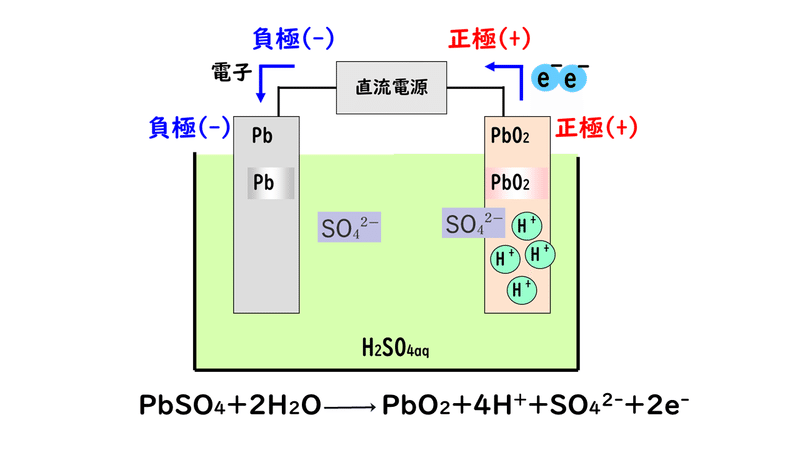
このように、充電時では、正極、負極のそれぞれで放電時の逆反応が起こり、元の物質に戻るため、また自力で発電が可能な電池として再生するのでした。
■クリーンエネルギーとして注目されている、燃料電池!
燃料電池は、水素H2(燃料)が燃焼するときに放出するエネルギーの一部を、電気エネルギーとして取り出す装置です。
燃料電池には、電解質の種類によって、リン酸型燃料電池やアルカリ型燃料電池などがあり、非常に発電効率の高く、反応によって生じる物質も水H2Oであることから、次世代のエネルギーとして注目されています。
燃料電池の負極活物質は水素H2、正極活物質が酸素O2で、電解液にはリン酸H3PO4や水酸化カリウムKOHを用いられています。
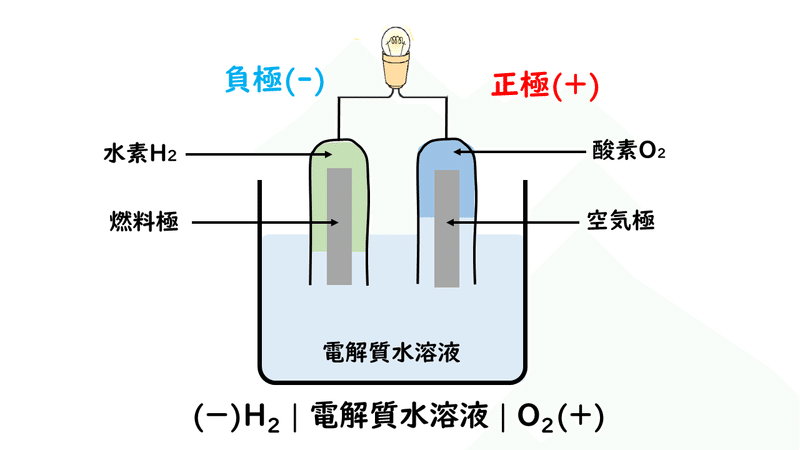
では、燃料電池の反応を見ていきましょう。
①負極の水素が電子e-を放出して(酸化されて)、水素イオンH+になる。
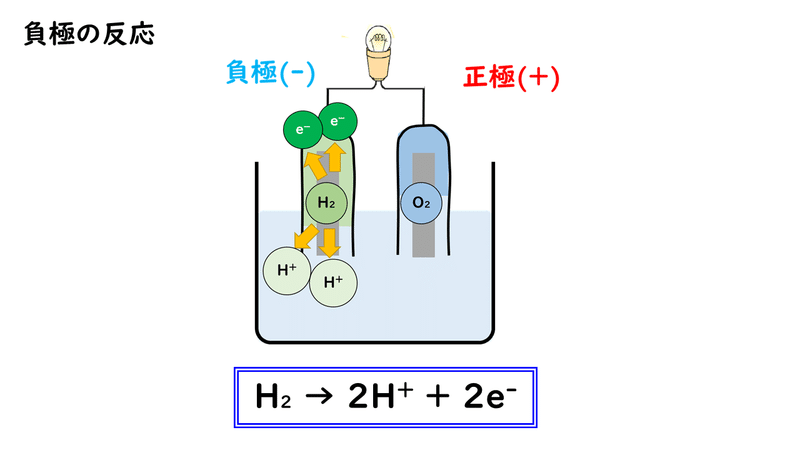
②電子が負極から正極に移動する
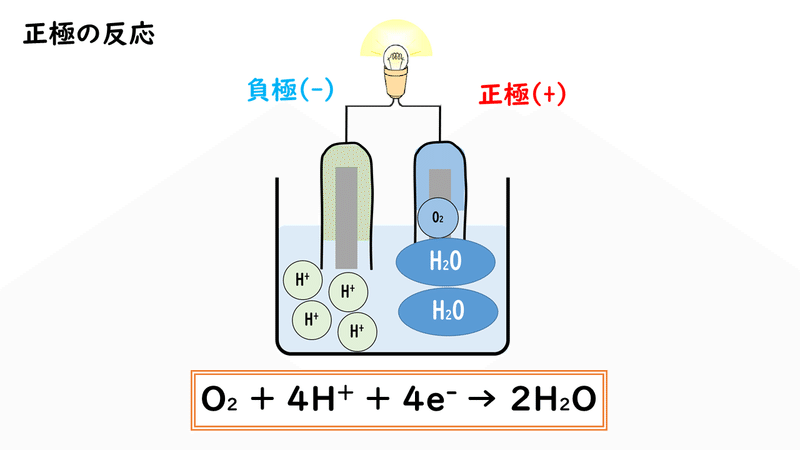
③正極で酸素O2と水溶液中の水素イオンH+が電子e-を受け取り、水H2Oになる。
ここまでの反応を、1つの反応式にまとめてみると、次のようになります。
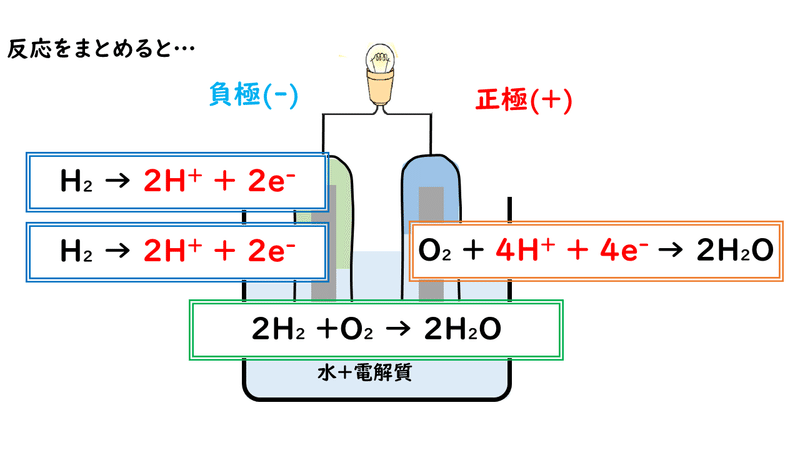
このように、燃料電池での反応は「水素と酸素が反応して水ができる」という反応なので、自動車のエネルギー源として用いたときなど、二酸化炭素を発生させず、排気ガスも水蒸気になるため、環境によいと考えられています。
ただし、燃料となる水素をどのように製造するかという点では、まだ課題が残されています。
■ノーベル賞も受賞した、モバイル時代の救世主、リチウムイオン電池!
昨年(2019年)、吉野彰博士ら3名の研究者が、「リチウムイオン電池の開発」によりノーベル化学賞を受賞しました。
リチウムイオン電池は、負極活物質が黒鉛CとリチウムイオンLi+の化合物であるLixC、正極活物質がコバルト酸リチウムLiCoO2で、電解液には有機化合物を用いています。
長く使用でき、起電力が大きいため、電子機器の小型軽量化に大きく貢献しました。現在では携帯電話やスマートフォン、電気自動車などに幅広く用いられています。
詳しくは、理化学研究所の動画が分かりやすいので紹介しておきます。
リチウムイオン電池が開発されていなかったら、私たちは未だに「しもしも~」で有名なショルダーフォンを背負って、重いデスクトップパソコンに頼って生活していたかもしれませんね。
■まとめ
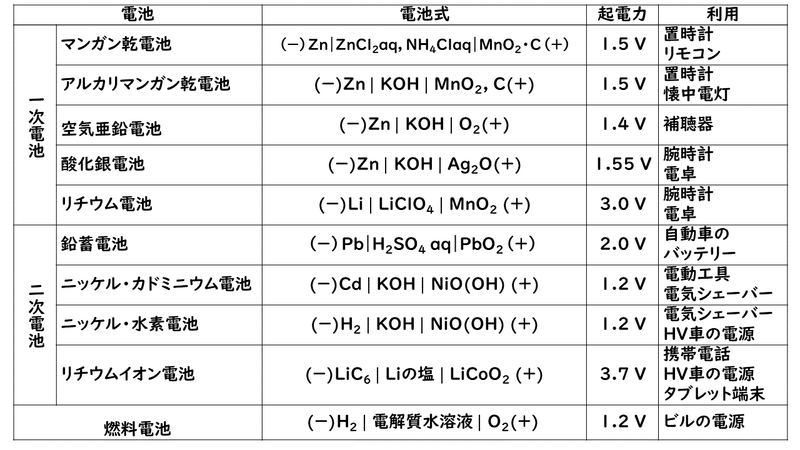
今回登場した電池をはじめ、私たちの身の回りにある電池を表にまとめておきましたので、参考にしてみて下さい。
今回はここまでです。
最後にワンポイントチェック!
1.一次電池と二次電池の違いとは何か?
2.マンガン乾電池の構造を電池式で表すと?
3.鉛蓄電池の正極、負極での半反応式は?
4.鉛蓄電池を放電させると希硫酸の密度はどうなる?
5.鉛蓄電池を充電するとき、正極は外部電源の何極とつなぐ?
6.燃料電池で起こる反応を1つの反応式で表すと?
次回は、酸化還元反応の最後の砦、「電気分解」に入っていきます。お楽しみに!
この記事が気に入ったらサポートをしてみませんか?
