
7-6. 電池(1)
こんにちは、おのれーです。
前回は「金属のイオン化傾向」ということで、金属原子が電子を放出して陽イオンへなるときのなりやすさには、元素によって違いがあるということを確認しました。
今回は、その違いが、実際に私たちの生活にどのように役立っているのか、その一例として「電池」を取り上げてみたいと思います。
■金属のイオン化傾向を確認してみよう!
金属元素を、イオンになりやすい順(=イオン化傾向が大きい順)に並べたものをイオン化列といいました。

そして、イオン化傾向が大きい金属Aを、それよりもイオン化傾向の小さい金属のイオンB+が溶けている溶液に入れると、Aが電子e-を放出して溶けてイオンA+になり、B+がその電子を受け取って金属の単体Bになるという現象が起こることを確認しました。
例)亜鉛版を銅(Ⅱ)イオンが溶けている水溶液に入れると…
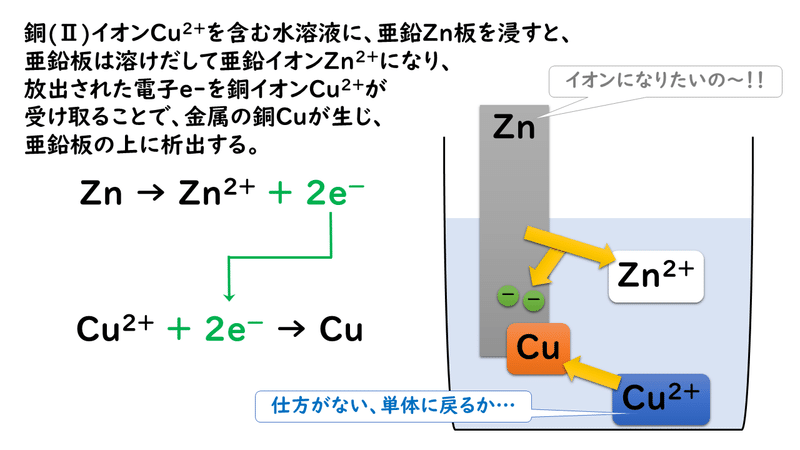
実はこのことが、私たちが日常利用している電池のしくみに深く関わっているのです。
■ボルタが発見した電池のしくみ
18世紀のイタリアの哲学者、アレッサンドロ・ボルタは、食塩水に2枚の異なる種類の金属板を浸すと、電流が取り出せることを発見しました。これが化学電池の始まりと言われています。
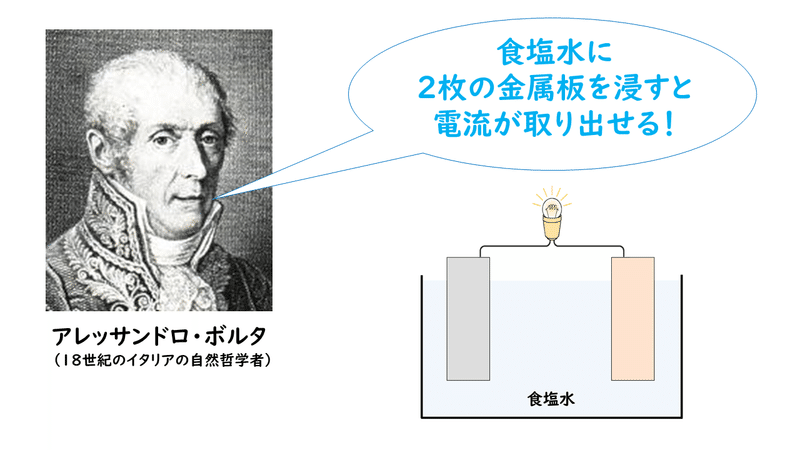
なぜ、そのような現象が起こるのでしょうか?
それは、先ほど確認したように、イオン化傾向が大きい金属から小さい金属へと電子が移動するという酸化還元反応が起こっていることが原因です。電流の正体は電子の流れですから、電子の移動が起これば、電流が流れると考えることができます。
このように、電池は、金属のイオン化傾向の違いによって起こる酸化還元反応を利用し、電流を取り出す装置(化学エネルギーを電気エネルギーに変換する装置)のことをいいます。
このとき、イオン化傾向が大きく、電子を放出する反応(=酸化反応)が起こる電極を「負極」といいます。逆に、イオン化傾向が小さく、電子を受け取る反応(=還元反応)が起こる電極を「正極」といいます。電子は負極から出て、正極にもらわれていくので、「マイナスガバガバ(吐き出し)、プラスチューチュー(吸い取り)」と覚えておくとよいかと思います。

ちなみに、電流の正体は「電子の流れ」なのに、電流と電子の流れの向きが逆向きのが気持ち悪いと思ったそこのあなた!・・・いいとことに気付きましたね。
これは、まだ「電子」というものが発見されていないときに「電流は正極から負極に向かって流れる」と定めてしまったことが原因です。何だか実際に起こっていることと逆なのは気持ち的に複雑なのですが、特に使用上不都合がないということで、現在もそのままになっています。
また、電池の能力の大きさ(電流を流し続けようとするはたらき強さ)を起電力といいます。正極と負極で用いる金属のイオン化傾向の差が大きいほど、起電力は大きくなります。
■ちょっと残念だったボルタの電池
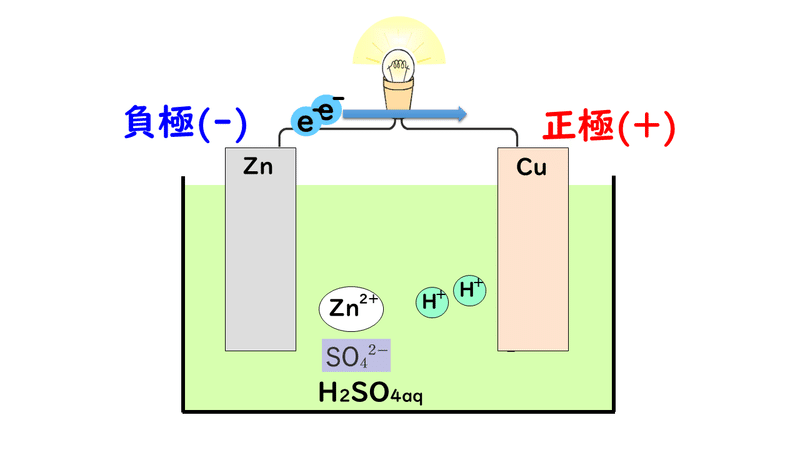
ボルタは研究の結果、負極に亜鉛板、正極に銅板、電解質水溶液に希硫酸を使った電池を発表しています。
ちなみに、電池の構造を表す式を電池式といい、次のように表します。
(-)負極活物質|電解質水溶液|正極活物質(+)
これにしたがって、ボルタの電池を表すと次のようになります。
(-)Zn|H2SO4aq|Cu(+)
このとき、"aq"は水溶液を表しています。
ボルタの電池のしくみは次の通りです。
①負極の亜鉛版が溶け出してZn2+になり、電子を放出する

②負極から正極に向かって電子が移動する
③電解質水溶液中にある陽イオンである水素イオンH+が電子e-を受け取って、気体の水素H2が発生する
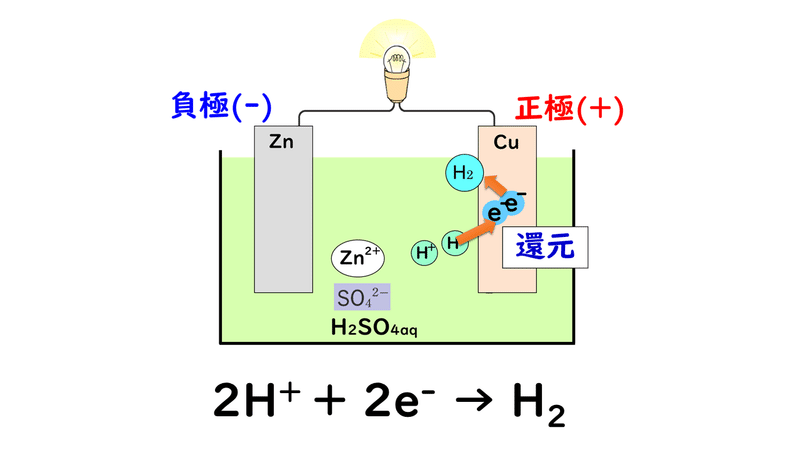
ただし残念なことに、放電が進むと、正極で発生した水素H2の気泡が電極板の表面にたまって電子の受け渡しができなくなり、起電力が著しく低下してしまいます。これを分極といいます。
これを防ぐために、酸化水素H2O2水や二クロム酸カリウムK2Cr2O7水溶液などを加え、発生した水素H2を酸化して水H2Oにしてしまうことで、一時しのぎをすることがあります。このように、分極を防ぐために使われる酸化剤のことを減極剤といいます。
■より実用に近い電池を発案したダニエルの功績
実際にボルタの電池をつくってみると、わずか30秒ほどで分極が起こり、減極剤を加えても、継続して電流を流し続けることができる時間はさほど長くありません。これではとても実用的ではありませんよね。
このボルタの電池を、より実用に近づけたのは、19世紀のイギリスの化学者、ジョン・フレデリック・ダニエルです。

ダニエルは、分極が起こらないように、ボルタの電池を改良しました。
分極の原因は気体の水素H2であり、そのもととなる水素イオンH+が容易に出てこないように電解質水溶液を変えればよいのだというのがダニエルの考えです。
硫酸イオンSO42-が含まれる水溶液というところは同じですが、陽イオンが水素イオンH+の代わりに、電極に使われている金属のイオンであるところがポイントではないでしょうか。また、正極側と負極側の水溶液が混ざらずに電子のやり取りができるように、素焼き板や塩橋などをつかって仕切りをつくったという工夫も素晴らしいところだと思います。
ダニエル電池のしくみは次の通りです。
①負極の亜鉛版が溶け出してZn2+になり、電子を放出する

②負極から正極に向かって電子が移動する 👈ここまでボルタと一緒

③電解質水溶液中にある陽イオンである銅(Ⅱ)イオンCu2+が電子e-を受け取って、金属の銅Cuが生成する

これが、電池の原型ともいえるものです。これがどんどん改良されて、今の私たちの生活を支えているわけです。
■おまけ:身近なものでつくる電池
ちなみに、2種類の異なる金属と、電解質水溶液があれば、電池をつくることができます。ここでは身近なものでつくれる電池をちょっとだけ紹介しておきたいと思います。
①果物電池
レモンやキウイフルーツに、異なる2種の金属板を刺して、導線で結べば完成です。

果物の数を増やせば、より大きな電流を取り出すことができます。
ちなみに使った後の果物には、亜鉛イオンZn2+が溶け出しているので食べないでください。
②五十五円電池
十円玉→食塩水で濡らしたキッチンペーパー→一円玉→食塩水で濡らしたキチンペーパー→十円玉→…のように交互に55円分重ねていくとつくることができます。
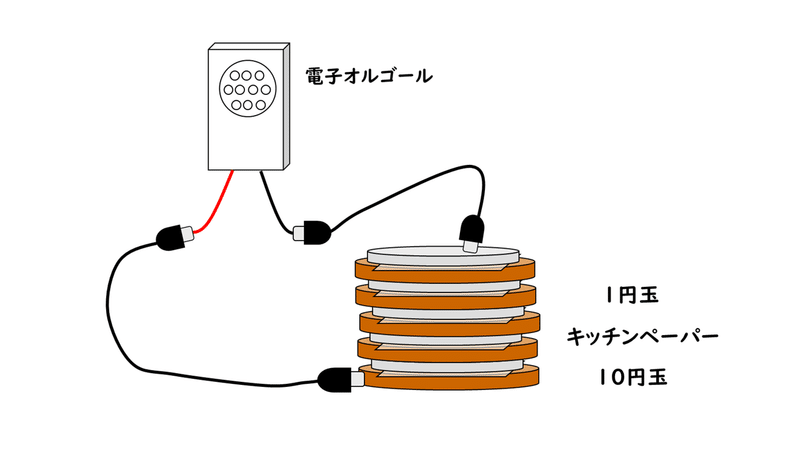
ただし、1円硬貨を若干溶かすことになるので、法律上あまりよろしくないかと思います。
③人間電池
銅板、亜鉛版を交互に並べて銅線でつなぎ、食塩水で濡らした手をその上に載せると、人間が電解質水溶液の代わりとなって、電池をつくることができます。

人間が電気を通し、電池になるってどこか不思議に思うかもしれません。でも、動物の筋肉は、電気刺激によって動きます。低周波治療器なども、筋肉に電流を流すことで血流をよくする機会ですし、体重計の体脂肪も「どれだけ電気を流すか」を調べることで測定しています。
今回はここまでです。
最後にワンポイントチェック
1.電池とはどのような装置か?
2.電子は正極から負極、負極から正極、どちら向きに流れるか?
3.電流は正極から負極、負極から正極、どちら向きに流れるか?
4.電池の正極はイオン化傾向が大きい金属か、小さい金属か?
5.電池の負極では何が起こっているか?
6.ボルタ電池の電池式、正極・負極での半反応式を書け。
7.ダニエル電池の電池式、正極・負極での半反応式を書け。
8.電池の起電力を大きくするにはどうしたら良いか?
お疲れさまでした。次回も電池の続きです。お楽しみに!
この記事が気に入ったらサポートをしてみませんか?
