
ペットの猫が飼い主の腸内環境と生活環境の抗生物質レジストームを形成している可能性
本文へスキップ
BMC
検索
メニュー
マイクロバイオーム
ホーム
マイクロバイオームについて
記事一覧
セクション
コレクション
投稿ガイドライン
原稿の投稿
PDFダウンロード
リサーチ
オープンアクセス
公開日:2023年10月23日
ペットの猫が飼い主の腸内環境と生活環境の抗生物質レジストームを形成している可能性
https://microbiomejournal.biomedcentral.com/articles/10.1186/s40168-023-01679-8
Yiwen Yang, Xinwen Hu, ...Xindi Liao 著者一覧を見る
マイクロバイオーム第11巻、論文番号:235 (2023) この記事を引用する
メトリクス詳細
要旨
背景
コンパニオンアニマルは、人の身体的および精神的健康に貢献することができ、多くの場合、飼い主と非常に密接な関係を保ちながら生活している。しかしながら、コンパニオンアニマルが保有する抗生物質レジストームや、コンパニオンアニマルが飼い主や生活環境に与える影響については不明な点が多い。本研究では、メタゲノム解析を用いてネコ、ヒト、およびその生活環境のARGプロファイルを比較し、ネコとヒトの腸内のコアARGを同定するとともに、ネコが環境を通してヒトの腸内のARGに与える潜在的影響を探索した。
結果
その結果、ネコ腸内のARGの存在量はヒト腸内のそれよりも有意に高く(P < 0.0001)、ネコ腸内のARGではアミノグリコシド耐性遺伝子とテトラサイクリン耐性遺伝子が支配的であった。猫の飼い主と非飼い主の腸内の総ARGの存在量に有意差はなかった(P > 0.05)。しかし、APH(2'')-IIaおよびAAC(6')-Imを含むアミノグリコシド耐性遺伝子の存在量は、非飼い主よりも猫の飼い主で有意に高かった(P < 0.001)。また、ARGの多さは生活環境における猫の活動頻度と正の相関を示した。腸内細菌科細菌は、猫の腸内、ヒトの腸内、および生活環境に共存するARG宿主として支配的であった。
結論
我々の結果は、猫が生活環境のレジストームを形成し、その結果、ヒト腸内のいくつかのARGの組成を形成する可能性があることを示しており、コンパニオンアニマル環境の健康の重要性を浮き彫りにしている。
ビデオ要約
背景
コンパニオンアニマルは、人の身体的・精神的健康に貢献することができ、しばしば飼い主と非常に密接な関係を保ちながら生活し、時には同じベッドを共有することさえある。しかしながら、コンパニオンアニマルと飼い主の密接な接触に関連する潜在的なバイオセキュリティの安全性リスクは、見過ごされがちである。コンパニオンアニマルの中で圧倒的に人気の高い犬と猫は、人獣共通感染症の重要な感染源である [1]。研究によれば、ペットの犬や猫は、複数のヒト関連病原体や、メチシリン耐性黄色ブドウ球菌やβラクタム系抗生物質耐性腸内細菌科細菌を含む様々な多剤耐性細菌を保有している可能性がある[2, 3]。これらの抗生物質耐性微生物は、直接接触、外部寄生、エアロゾルを介してコンパニオンアニマルからヒトに感染する可能性がある。特に、免疫不全の高齢者や乳幼児を含む脆弱な集団は、より大きなリスクにさらされる可能性がある。さらに、コンパニオンアニマルの数が増え続けるにつれて、ペットの臨床診察における抗生物質の使用はより一般的になっている。適切に使用されない抗生物質は、抗生物質耐性を促進する可能性があり[4]、コンパニオンアニマルの飼育における抗生物質耐性のリスクは無視できないという事実が強調されている。
コンパニオンアニマルが飼い主のレジストームや生活環境に及ぼす影響については、まだ明らかになっていない。これまでの研究では、抗生物質耐性遺伝子(ARG)が空気感染する可能性は極めて低いことが判明している[5]。しかし、猫と飼い主の間のコミュニケーションは空気感染よりも物理的なものである可能性が高いため、猫と飼い主の間のARGの感染経路は、作業面や床などの生活環境を経由する可能性が高い。さらに、現在、ARGの存在量の変化に焦点を当てた研究が多く行われており、移動に関連するARGや病原体に関連するARGに関する研究は、これらのARGがヒトにとってより大きな脅威となるにもかかわらず、不足している[6, 7]。
本研究では、メタゲノム解析を用いてネコ、ヒト、およびその生活環境のARGプロファイルを比較し、ネコとヒトの腸内のコアARGを同定するとともに、ネコが環境を通じてヒトの腸内のARGに与える潜在的影響を探った。
材料と方法
実験デザインとサンプル採取
ペット猫とヒトの腸内からのARGプロファイルの違いを調べるため、2020年8月に中国・広州のペット猫30匹とボランティア30人から60個の糞便サンプルを採取した(図1A)。猫およびボランティアに関する追加情報は、補足表S1および表S2に記載されている。すべての糞便サンプルは無菌の糞便採取器で採取され、4時間以内に実験室に届けられ、その後の使用のために-80℃の冷蔵庫で保存された。
図1
図1
猫の腸とヒトの腸のレジストームの比較。Aサンプリングフローチャート;ネコとヒト腸内のARGのBβ多様性、C存在量、D数、Eα多様性。F猫の腸とGヒトの腸におけるコアARG。H, I 猫の飼い主とそうでない人の腸内のARG存在量。
フルサイズ画像
次に、猫の飼い主の1人の生活環境を選んだ(サンプルID:Human_4)。そして、リビングルーム、ダイニングルーム、バルコニー、小型寝室、中型寝室、大型寝室、猫砂(トイレ内)などの猫飼育環境からサンプルを採取した。各サンプリング地点の床を滅菌綿棒で水平・垂直方向に拭いた。家主は3日ごとに床を清掃していたため、毎回の清掃前に床サンプルを採取し、2022年4月中に合計5回実施した。各サンプリング部位で毎回10本の綿棒を採取し、1つのサンプルに混合した結果、生活環境から35個の混合サンプルが得られた。最後に、猫飼育環境と臨床環境のARGを比較するため、米国国立生物工学情報センター(NCBI)のウェブサイトから病院環境のメタゲノム配列決定サンプル19件をダウンロードした。
メタゲノムシークエンシングおよび微生物群集解析
全DNAはQIAamp PowerFecal DNA Kit(Qiagen、ドイツ)を用い、製造業者の指示に従ってサンプルから抽出した。DNAサンプルはNovogene社でIllumina NovaSeqプラットフォームを用いたメタゲノムシークエンシングに供され、各サンプルについて6~8Gの生データが得られた。病院環境を含む全サンプルのメタゲノム生データは、デフォルトパラメータ(SLIDINGWINDOW:4:20 MINLEN:50)でKneadData(Trimmomatic 0.33)を使用して品質管理した[8]。その後、ヒト(Homo_sapiens_Bowtie2_v0.1)およびネコ(GCF_018350175.1)ゲノムを参照し、bowtie2ソフトウェア(-very-sensitive)を用いてすべてのヒトおよびネコのDNAを同定し、除去した[9, 10]。各サンプルのクリーンアップされたデータは、Kraken2ソフトウェアの標準データベース[11]に基づいて微生物群集解析に使用された。最後に、クリーンデータをMegahit v1.2.9(デフォルトのkmerに基づく)を用いてアセンブルした[12]。これらのコンティグをProdigalソフトウェア(v2.6.3)を用いてオープンリーディングフレーム(ORF)を予測した。その後、Cd-hit(v4.8.1)を用い、デフォルトパラメータ(-c 0.95)でORFをクラスタリングした。ORFは、Salmonソフトウェア(v1.4.0)を用いて定量した[13,14,15]。
抗生物質レジストーム解析
Comprehensive Antibiotic Resistance Database (CARD v3.2.5, https://card.mcmaster.ca/)をダウンロード、照合し、DIAMOND software (v2.0.15.153) [16]を用いてARGデータベースを構築した。同様に、mobileOG-db (1.6 v1)をダウンロードし、mobile genetic element (MGE) データベースを構築するために使用した[17]。ORFsファイルはDIAMONDソフトウェアを用いて、e値1e - 7、max-target-seqs 70、id 80のパラメータでARGおよびMGEデータベースと比較した。ARG-like-ORFおよびMGE-like-ORFが同定された。サンプルあたりの原核細胞数はARGs_OAP v3.2を用いて推定し、ARGとMGEの存在量はコピー/細胞数に補正した[18]。
MAGビニングによるARG宿主の同定
全サンプルのクリーンメタゲノムデータをMetaspades (v3.14.0)を用いてデフォルトパラメータで細かくアセンブルし、コンティグを用いてメタゲノム-アセンブルゲノム(MAG)をアセンブルした[19]。MAGは、MetaWRAPパイプライン[20]のMetabat2、Maxbins、CONCOCTによって生成された。最終的に、MAGは50%以上の完全性と10%未満のコンタミネーションに基づいて出力された。MAGの種分類は、GTDBデータベース(R207_v2)を用いてGTDB-TK v2.1.1を用いて行った[21, 22]。ARGおよびMGE宿主を得るために、「メタゲノム配列決定および微生物群集解析」の項と同様に、MAG中のARGおよびMGEを同定した。VFDB_setAデータベース(最終更新日:2022年10月7日)とデータを比較することにより、MAG中の病原因子(Virulence Factor:VF)を同定し、これらのMAGはネコやヒトの腸内および生活環境中の細菌病原体と考えられた。
ARGのパブリックリスクの同定
メタゲノムアセンブリからのコンティグを、BLASTツールを用いてARG、MGE、およびVFデータベースと比較し、病原性細菌におけるARG(ARGs-like contigs)、移動性関連ARG(ARGs-MGEs like contigs)、および移動性関連ARG(ARGs-MGEs-VFs like contigs)の存在量を求めた[7]。その後、MetaCompareパイプラインを使用して、ネコやヒトの腸内、病院や生活環境におけるレジストームリスクを評価した[6]。そしてMetaCHIPパイプラインは、これらのARGの水平伝播リスクを評価するために使用された[23]。
データ解析とプレゼンテーション
すべてのデータは、まずWPS office 11.1.0で照合し、SPSS 22.0(一元配置分散分析)を用いて有意性分析を行った。また、Tukeyの多重比較検定を用いた。列グラフはGraphPad Prism 8.01でプロットし、遺伝子および微生物分析の箱ひげ図はSTAMP 2.1.3で描いた。主座標分析(PCoA)と冗長性分析(RDA)はR 4.2.2で行った。系統樹はiTOL (https://itol.embl.de/) [24]を用いて作成した。その他の画像はOriginPro 2023で作成した。グラフィックのレイアウトにはAdobe Illustrator 22.1を使用した。
結果
ネコとヒトの腸内レジストームの比較
その結果、ネコとヒトの腸内のARG β-多様性には有意な差が認められた(P = 0.001)(図1B)。ネコ腸内のARGの存在量は1.809 ± 0.070コピー/細胞数で、ヒト腸内のそれ(1.765 ± 0.185コピー/細胞数)よりも有意に高かった(P < 0.0001)(図1C)。ネコの腸におけるARGの割合は遺伝子総数の0.07%で、ヒトの腸(0.03%)よりも高かった(図1D)。猫の腸内のARGのリッチネスとシャノン指数も、ヒトの腸内のそれよりも高かった(図1E)。ネコ腸内の中核ARGはテトラサイクリン、アミノグリコシド、MLS耐性遺伝子であり、ヒト腸内の中核ARGはテトラサイクリン、MLS、多剤耐性遺伝子であった。ネコの腸におけるテトラサイクリン耐性遺伝子(tetOやteWなど)やアミノグリコシド耐性遺伝子(APH(2'')-IIaやACC(6')-Imなど)の存在量は、ヒトの腸のそれよりも有意に高かった(P < 0.05)(図1F, Gおよび図S1)。さらに、猫の飼い主とそうでない人の腸内のARG総存在量に有意差はなかったが(図1H)、APH(2'')-IIaやACC(6')-ImなどのARGの存在量は、猫の飼い主の方がそうでない人よりも高かった(図1I)。猫の腸内におけるこれらの特異的ARGの存在量も、ヒトの腸内よりも有意に高かった(P < 0.001)。
猫から飼い主および生活環境へのレジストーム伝播リスク
猫の腸管におけるMGEs組成解析の結果、猫の腸管とヒトの腸管におけるMGEs組成は有意に異なっていた(P = 0.001)(図2A)。ヒト腸管におけるMGEsの存在量はネコ腸管よりも有意に高く(P < 0.0001)、それぞれ76.61 ± 3.28コピー/細胞数、47.03 ± 1.74コピー/細胞数であった(図2B)。ヒト腸内の移動性関連ARG(ARG-MGのコンティグ)は、コンティグ全体の0.59±0.060%を占め、ネコ腸内の存在量(0.576±0.068%)より有意に高かった(P < 0.05)(図S2)。ネコの腸におけるVFの主な種類は、付着、免疫調節、ウレアーゼであり、ヒトの腸におけるVFの主な種類は、付着、栄養/代謝因子、免疫調節であった。ヒト腸管におけるVFの総存在量は1.319 ± 0.494コピー/細胞数であり、ネコ腸管におけるそれ(0.183 ± 0.021コピー/細胞数)よりも有意に高かった(P < 0.05)(図2C、D)。しかし、ネコの腸とヒトの腸では、病原体-移動性関連ARG(ARG-MGEs-VFのコンティグ)の割合に有意差はなかった。また、レジストームリスクスコアについても、ヒト腸管とネコ腸管で有意な差は見られなかった(図2E、F)。
図2
図2
ネコ、ヒト、およびその生活環境におけるレジストームリスク。ネコとヒトの腸内におけるA β-多様性とB MGEsの存在量。C, D VFの多さ。E 病原体移動性ARGの割合。F ネコとヒトの腸におけるレジストームリスクスコア。G 猫の飼い主とそうでない人の腸における病原体移動性関連ARGの割合。H 猫の飼い主とそうでない人の腸内の、猫とヒトの腸内のレジストームリスクスコア。I 生活環境のサンプリングフローチャート。図中の猫の数が多いほど猫の活動頻度が高い。J 生活環境におけるARGの存在量とKレジストームリスクスコア。
原寸大画像
また、猫の飼い主とそうでない人の腸内では、病原体移動性関連ARG(ARGs-MGEs-VFのコンティグ)の割合に有意差はなかったが、猫の飼い主の腸内のレジストームリスクスコアは、そうでない人の腸内のそれよりも有意に高かった(P < 0.05)(図2G、H)。これらのことから、猫由来のARGはヒト腸内のレジストームに影響を及ぼすリスクがあることが示唆された。本研究のために、猫の飼育環境からサンプルを採取した(図2I)。本研究では、猫が最も活発に活動する場所は大部屋であり、次いでダイニングルーム、小部屋、中部屋リビングルーム、バルコニーの順であった。生活環境分析では、猫砂と広い寝室でそれぞれ2.414±0.287コピー/細胞数、2.411±0.330コピー/細胞数でARGの存在量が最も高く、次いでダイニングルーム、小さな寝室、中くらいの寝室、リビングルームであった(図2I、J)。ARGの存在量が最も少なかったのはバルコニーで、0.744 ± 0.104コピー/細胞数であった。生活環境におけるARGの多さは、猫の活動頻度と正の相関があった。このことは、猫の腸内から生活環境へARGが伝播し、それが飼い主に影響を与えている可能性を示唆している。むしろ驚くべきことに、抗生物質レジストームの伝播リスクは、病院よりも生活環境のほうが高かった(図2K)。飼育猫の生活環境におけるレジストームリスクに注目することの重要性を思い起こさせる。
宿主構成特性とARGの水平伝播リスク
ネコ腸管とヒト腸管では細菌群集組成に有意差があり、ネコ腸管では放線菌(0.45±0.24)とファーミキューテス(0.52±0.23)の相対存在量が最も高く、ヒト腸管ではファーミキューテス(0.49±0.20)とバクテロイデーテス(0.40±0.23)の相対存在量が最も高かった(図3A)。また、猫の腸内のビフィドバクテリウムの存在量はヒトの腸内のそれよりも有意に高く、猫の飼い主の腸内のビフィドバクテリウムの存在量は猫の飼い主でない人に比べて高かった(図3Bおよび補足図S3)。このことから、猫の微生物はヒト腸内の微生物組成に影響を与え、おそらくARG宿主を含む可能性が示唆された。
図3
図3
ネコとヒトの腸内細菌群集組成。A上位4フィラとビフィドバクテリウムの相対的存在量;Cネコ腸およびDヒト腸におけるARGと細菌群集の共起パターン
フルサイズ画像
共起分析を用いてARG宿主を探索したところ、ネコとヒトは腸内細菌科で共通の宿主を持ち、それぞれ12個および46個のARGと有意かつ正の相関があった(ρ > 0.6、P < 0.01)(図3C、D)。ネコとヒトの腸における主要なARG宿主をさらに特定するために、次にメタゲノムアセンブリを用いて、主にファーミキューテス、放線菌、バクテロイーダ、プロテオバクテリアから構成される、ネコの腸から161個、ヒトの腸から313個、生活環境から351個の計828個のMAGを得た(図S4)。ネコとヒトの糞便から同定された異なる門レベルの細菌のほとんどがARGを保有していることが判明し、ARGが環境細菌に広く存在していることが示唆された(図4および図S5)。腸内細菌科はネコとヒトの腸内における主要なARG宿主であり、65個(bin.62)と73個(bin.157)のARGを保有することが検出された。さらに心配なことに、腸内細菌科にはエシェリヒア、サルモネラ、赤痢菌などの一般的な病原性細菌が含まれており、抗生物質耐性のリスクを高めている。これらのMAGをさらに水平転移評価した結果、猫の腸内の主なARG宿主であるbin62(腸内細菌科)は、生活環境bin317に遺伝子転移するリスクがあることが明らかになった(図5)。また、bin197とbin259の間のように、生活環境中の異なるMAG間の水平転移のリスクもあった。最後に、生活環境からヒト腸内への細菌遺伝子の水平転移のリスクが確認された。例えば、生活環境ではbin197とbin92の間、ヒト腸内ではbin138とbin157の間であった。中でもbin157はヒト腸内における主要なARG宿主であった。
図4
図4
猫の腸内でMAGが運ぶARGの数
フルサイズ画像
図5
図5
ネコの腸、ヒトの腸、環境からMAGに起こる遺伝子の水平移動
フルサイズ画像
考察
コンパニオンアニマルはヒト腸内のレジストームを形成する
腸管内には、比較的一定の常在細菌と外部環境から入ってくる一過性の細菌を構成する多数の微生物が存在する[25]。常在細菌は腸内細菌叢の主成分であり、宿主の栄養、免疫、消化などの正常な生理機能を促進することで、環境や宿主とのダイナミックなバランスを保っている [26] 。一過性細菌は、接触やエアロゾルを介して腸管内に侵入する無害または病原性の外来細菌である。通常、常在細菌は腸管内に付着、定着、増殖してバリアを形成し、拮抗作用によって一過性細菌を抑制・拒絶することで、腸管の恒常性と宿主の健康を守っている。しかし、長期間の曝露により、生活環境や職場環境中の微生物も腸内細菌叢を形成し、ARGの重要な宿主である微生物の組成の変化がレジストームの変化につながる可能性がある[27]。
本研究では、ネコの腸内細菌叢の組成と多様性がヒトの腸内細菌叢と大きく異なることがわかった。また、ネコ腸内のARGのα-およびβ-多様性はヒト腸内のそれとは有意に異なり、ネコ腸内のARGの存在量は、すべてのタイプのARGを含めてヒト腸内のそれよりも有意に高かった。mcr-1耐性遺伝子を持つリスクの高い細菌もまた、ネコやイヌから分離されている[28]。したがって、猫の腸内に存在する抗生物質耐性の高いリスクは無視できない。さらに本研究では、腸内のAPH(2''-IIa)およびACC(6')-Im耐性遺伝子の存在量が、猫の飼い主ではそうでない飼い主よりも有意に高いことが判明した。これらの耐性遺伝子は、今回検査された猫のコアARGでもある。先行研究でも、愛犬とその飼い主の間でマクロライド耐性遺伝子に強い相関があることが示されている[29]。Belasら(2020)は、コンパニオンアニマルのレジストームは、彼らと密接に接触している人のレジストームと類似していることを明らかにした[30]。従って、コンパニオンアニマルは飼い主の腸内レジストームをある程度形成していると推測できる。
私たちはまた、猫の腸とヒトの腸の両方で中核ARG宿主が腸内細菌科であること、これらの中核ARG宿主と生活環境やヒトの腸内の異なる細菌との間で水平遺伝子移動のリスクがあることを示した。ネコの腸内にいるこれらのコアARG宿主は、一過性の細菌として異なる経路でヒトの腸内に入り込み、水平的遺伝子移入によって飼い主の腸内のレジストームをさらに変化させる可能性があるという仮説が成り立つ。もちろん、これらのARGとその宿主が、より長期間にわたってヒトの腸に付着し、コロニー形成する可能性もある。長期にわたって農場で働く給餌者の腸内細菌叢とレジストームが再形成される可能性があることが研究で示されている [31, 32]。さらに心配なことに、この研究で同定された中核的なARG宿主である腸内細菌科には、エシェリヒア、サルモネラ、赤痢菌などの病原性細菌も含まれており、抗生物質耐性や病原性のより複雑なリスクをもたらす可能性がある。
今回の試験で、最初の部分で30人のボランティアと30匹の猫しかサンプリングできなかったのは非常に残念である。当初の計画では100頭以上のボランティアからサンプルを採取する予定であったが、COVID-19のパンデミック流行が突然深刻になり、何人かのボランティアが試験から離脱せざるを得なくなった。本研究は期待したほど順調には進まなかったが、得られた結果は重要な参考価値を持つものである。
コンパニオンアニマルがヒトのレジストームに影響を及ぼす経路
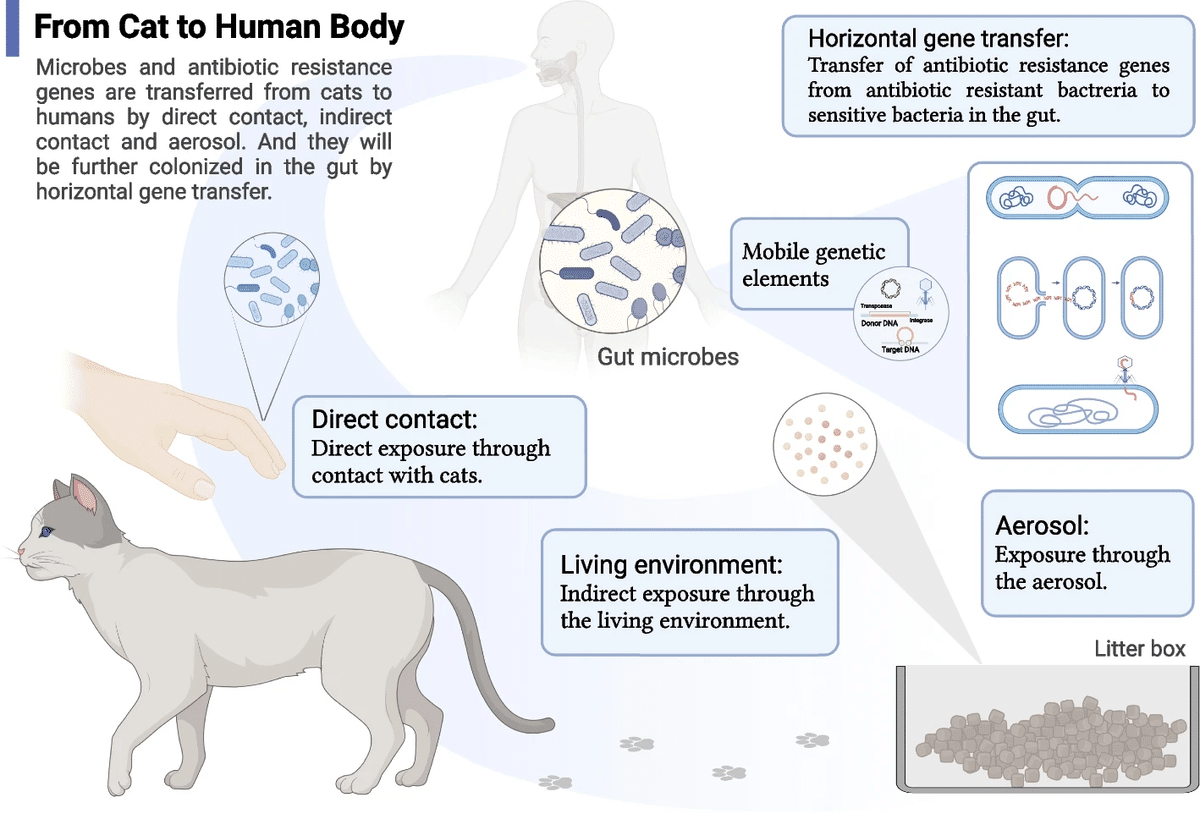
環境におけるARGとその宿主の主な感染経路は、空気や表面などの接触である[33]。コンパニオンアニマルがヒトのレジストームに影響を及ぼす経路として、空気が重要であることが示唆されている。猫飼育家庭では独特の臭いがすることから、猫から揮発した抗生物質耐性微生物やARGが猫飼育環境の空気中に浮遊している可能性が推測された。さらに、環境中の微生物やARGがエアロゾルの形でヒトに侵入することも、これまでの研究で確認されている[34, 35]。驚くべきことに、我々の結果は猫の腸(糞便)から空気中に揮発する微生物やARGはごくわずかであることを示しており、空気は猫から飼い主へのARGの主な感染経路ではないことを示唆している[5]。ペットの猫は好奇心旺盛な動物であり、その行動範囲において居住空間のほぼ全域をカバーする。そこで、住環境の様々なエリアから床サンプルを採取したところ、これらのエリアにおけるARGの多さは、ペット猫の活動頻度と正の相関があることがわかった。猫の腸、環境、ヒトの腸の間で遺伝子の水平移動が起こることが判明したことから、ペットの猫が生活環境での活動を通じてヒトのレジストームに影響を与える可能性があり、その影響は空気感染による影響よりも大きいと考えられる。これは特に、猫が活発に活動する部屋において当てはまる。
腸の恒常性制御 [36] のため、ARG宿主を含め、猫や生活環境からヒトの腸に侵入する微生物は通常、ヒトの腸にとっては一過性であり、腸に付着してコロニー形成することはほとんどない。ヒトの腸内サンプルには、ファージ、インテグロン、トランスポゾンタイプを含むMGEが、ネコや環境サンプルよりも多く検出された。これらのMGEsは、異なる微生物におけるARGの水平遺伝子転移において重要な因子として働く[36]。このことから、ヒトの腸内ではARGの水平遺伝子転移のリスクが高いことが示唆される。また、水平遺伝子転移は環境レジストームの変動に重要な影響を与える要因であり、MGEは排水中のARG変動の10.3%、ブタ腸内のARG変動の13.9%、イヌ腸内のARG変動の13.76%まで説明している[29, 37, 38]。さらに、ARGとMGEのコンティグを解析したところ、ネコ腸とヒト腸における移動性ARG(MGE-ARG様コンティグ)の割合は、それぞれコンティグ全体の0.576±0.068‰と0.590±0.060‰であった。また、ネコの糞便、生活環境、ヒト腸内の異なる微生物間で、遺伝子の水平移動が認められた。
要約すると、ネコからヒトの腸内環境および生活環境へレジストームが形成される過程をマッピングした(図6)。ネコのARGとその宿主は、ネコの活動を通じて生活環境にもたらされ、環境中のレジストームを形成し、それがヒトの腸内レジストームに影響を与える。また、エアロゾルを介して呼吸器からヒトの体内に入るARG宿主も少なからず存在する[5]。もちろん、ARG宿主がヒトの腸内に侵入する主な経路は、ネコとの直接接触かもしれない[39]。ヒトの腸内に侵入したARGは、その後、遺伝子の水平移動などによって腸内で再配置され、飼い主のレジストームを形成する。
図6
図6
ネコからヒトの腸や生活環境への耐性形成
フルサイズ画像
コンパニオンアニマルからのレジストームリスクは低い
ARGは、深海や北極圏の永久凍土のような極限環境であっても、自然環境には普通に存在する[40, 41]。したがって、ARGの存在やARGの水平拡散の存在は、レジストームリスクが高いとは考えられない。環境のレジストームリスクを評価する方法はいくつかある。最も直接的な方法は、環境中のARGスコアの絶対量と正常量の両方を検出することである。環境中のARGの存在量が多いほど、レジストームリスクが高いと考えられている。レジストームリスクは、総ARG、可動性ARG(MGEs-ARGs like contigs)、病原性細菌に関連する可動性ARG(MGEs-VFs-ARGs like contigs)の存在量の解析を組み合わせることによっても推定できる[6, 7]。本研究では、猫を飼っている家庭のレジストームリスクを評価するために両方の方法を用いたところ、猫を飼っている人と飼っていない人のARGの存在量に有意差はなく、また人と猫の腸内のレジストームリスクスコアにも有意差はなかった。また、善玉菌とされるビフィズス菌の存在量は、ヒトの腸内よりもネコの腸内の方が有意に高いことがわかった。また、猫の飼い主の腸内のビフィズス菌の存在量は、猫の飼い主でない人の腸内のそれよりも有意に高かった。このエビデンスから、猫の飼育は飼い主の腸内環境や生活環境におけるレジストームを形成する可能性があるが、レジストームリスクは小さいことが示唆される。さらに、ペットの飼育による抗生物質耐性汚染の報告は見つからなかった。にもかかわらず、猫を飼う際には清潔さが重要である。また、ARGの濃縮を防ぐために、猫の食事を調整し、ペット用の抗生物質を合理的に使用することで、ARGを減少させることができる。
結論
猫の腸内のARG存在量はヒトの腸内のARG存在量よりも有意に高いこと、猫飼育者の腸内のレジストームリスクは非飼育者よりも高いこと、生活環境中のARG存在量は猫の活動頻度と正の相関があることを明らかにした。また、猫の腸とヒトの腸では、ARGの中核宿主(腸内細菌科)が共通していることも示された。これらの結果は、ペットの猫がヒト腸内の抗生物質レジストームを形成している可能性を示唆している。また、ヒトの腸内だけでなく、環境中の細菌間の水平遺伝子移動も、レジストームの形成にさらに寄与する可能性がある。コンパニオンアニマル飼育時のレジストームリスクを再認識し、生活環境の管理や動物の健康管理により、コンパニオンアニマル由来の耐性菌の伝播経路を最小化することが必要である。
データおよび資料の入手可能性
本研究の全シークエンスデータはNCBIデータベースから入手可能である(アクセッション番号:PRJNA944553)。本研究で使用した病院環境メタゲノムシーケンスデータのアクセッション番号はPRJNA726763である。
参考文献
Christou L. 細菌およびウイルス性人獣共通感染症の世界的負担。Clin Microbiol Infect. 2011;17(3):326-30.
論文
CAS
PubMed
パブメドセントラル
Google Scholar
韓国の野良猫、入院猫、動物病院スタッフにおける細菌種の分布と抗菌薬耐性プロファイル。BMC Vet Res. 2020;16(1):109.
犬および猫から分離されたメチシリン耐性黄色ブドウ球菌およびメチシリン耐性偽中性ブドウ球菌における誘導性クリンダマイシン耐性。Vet Microbiol. 2009;139(3–4):419–20.
論文
CAS
パブコメ
Google Scholar
ドキシサイクリン耐性の進化に伴うエシェリヒア・コリの炭素代謝の変化。Front Microbiol. 2019;10:2506.
Yang Y, et al. 猫の糞便と犬の糞便における抗生物質耐性遺伝子の存在量、多様性、拡散。Environ Pollut. 2022;292:118364.
論文
論文
パブコメ
Google Scholar
MetaCompare:環境レジストームリスクの優先順位付けのための計算パイプライン。FEMS Microbiol Ecol. 2018;94(7):fiy079.
Zhang A, et al. 抗菌薬耐性遺伝子の健康リスクを評価するためのオミックスベースのフレームワーク。Nat Commun. 2021;12(1):4765.
Bolger、Lohse M、Usadel B. Trimmomatic: a flexible trimmer for Illumina sequence data. Bioinformatics. 2014;30(15):2114-20.
論文
論文
パブコメ
パブメドセントラル
グーグル奨学生
Langmead B, Salzberg SL. Bowtie 2による高速ギャップドリードアライメント。Nat Methods. 2012;9(4):357-9.
論文
論文
パブコメ
パブメドセントラル
Google Scholar
汎用プロセッサで数百スレッドまでリードアライナーを拡張する。Bioinformatics. 2019;35(3):421-32.
論文
CAS
PubMed
Google Scholar
Wood DE, Salzberg SL. Kraken: 正確なアラインメントを用いた超高速メタゲノム配列分類。Genom Biol.
MEGAHIT: A ultra-fast single-node solution for large and complex metagenomics assembly via succinct de Bruijn graph. Bioinformatics. 2015;31(10):1674-6.
論文
CAS
PubMed
Google Scholar
Li W, Godzik A. Cd-hit: a fast program for clustering and comparising large set of protein or nucleotide sequences. Bioinformatics. 2006;22(13):1658-9.
論文
論文
パブコメ
Google Scholar
Patro R, et al. Salmonによる転写産物発現の高速かつバイアスを考慮した定量。Nat Methods. 2017;14(4):417-9.
論文
CAS
PubMed
パブメドセントラル
Google Scholar
Hyatt D, et al. Prodigal: 原核生物の遺伝子認識と翻訳開始部位の同定。BMC Bioinformatics. 2010;11:119.
論文
論文
パブメドセントラル
Google Scholar
Buchfink B, Xie C, Huson DH. DIAMONDを用いた高速かつ高感度なタンパク質アラインメント。Nat Methods. 2015;12(1):59-60.
論文
論文
PubMed
Google Scholar
MobileOG-db: A manual curated database of protein families mediating the life cycle of bacterial mobile genetic elements. 応用環境微生物学(Applied Environ Microbiol. 2022;88(18):e0099122.
環境メタゲノムにおける抗生物質耐性遺伝子の特性解析と定量化を強化するための拡張SARGデータベースと隠れマルコフモデルを用いたARGs-OAP v2.0。Bioinformatics. 2018;34(13):2263-70.
論文
CAS
PubMed
Google Scholar
Nurk S, et al. metaSPAdes: a new versatile metagenomic assembler. Genome Res. 2017;27(5):824-34.
論文
CAS
PubMed
パブメドセントラル
Google Scholar
ゲノム分解メタゲノム解析のための柔軟なパイプライン。Microbiome. 2018;6(1):158.
GTDB-Tk v2: ゲノム分類データベースによるメモリフレンドリーな分類。Bioinformatics. 2022;38(23):5315-16.
GTDB: A ongoing census of bacterial and archaeal diversity through a phylogenetically consistent, rank normalized and complete genome-based taxonomy. Nucleic Acids Res. 2022;50(D1):D785-94.
論文
論文
パブコメ
Google Scholar
MetaCHIP:ベストマッチと系統遺伝学的アプローチの組み合わせによるコミュニティレベルの水平遺伝子転移の同定。Microbiome. 2019;7(1):36.
Letunic I, Bork P. Interactive Tree Of Life v2: Online annotation and display of phylogenetic trees made easy. Nucleic Acids Res. 2011;39:W475-8.
論文
論文
パブコメ
パブメドセントラル
Google Scholar
ヒト腸内細菌叢における摂取細菌の運命、活性、影響。Trends Microbiol. 2015;23(6):354-66.
論文
CAS
PubMed
Google Scholar
Donaldson GP, Lee SM, Mazmanian SK. 細菌叢の腸内生物地理学。Nat Rev Microbiol. 2016;14(1):20-32.
論文
論文
PubMed
Google Scholar
Caballero-Flores G, Pickard JM, Nunez G. Microbiota-mediated colonization resistance: mechanism and regulation. Nat Rev Microbiol. 2022;21(6):347-60.
Lei L, et al. コンパニオンアニマル由来の腸内細菌科細菌におけるmcr-1(中国、北京、2012-2016年)。Emerg Infect Dis. 2017;23(4):710-1.
論文
PubMed
PubMed Central
Google Scholar
Zhao, R., et al., The co-occurrence of antibiotic resistance genes between dogs and their owners in family.
Belas A, et al.コンパニオンアニマルとその家族のメンバーによる臨床的に重要な抗菌薬耐性遺伝子の共有。Microb Drug Resist. 2020;26(10):1174-85.
論文
CAS
PubMed
Google Scholar
畜産場におけるヒト腸内細菌叢の環境リモデリングと抗生物質レジストーム。Nat Commun. 2020;11(1):1427.
Ding D, et al. 畜産場での曝露が作業員の口腔咽頭および腸内微生物群集と抗生物質耐性遺伝子に及ぼす影響。Sci Total Environ. 2022;806:150685.
論文
論文
パブコメ
Google Scholar
都市屋外エアロゾル中の腸内病原体と抗生物質耐性遺伝子に関するシステマティック・レビュー。2022:212:113097.
論文
論文
パブコメ
Google Scholar
Bai H, et al.畜産農場から環境への空気中抗生物質耐性の拡散:拡散パターンと暴露リスク。2022;158:106927.
論文
論文
パブコメ
Google Scholar
養鶏場における抗生物質耐性遺伝子と細菌群集の動物-エアロゾル-ヒトにおける分布特性を明らかにした: One-Healthの観点から。Ecotoxicol Environ Saf. 2021;224:112687.
論文
論文
パブコメ
グーグル奨学生
Coyte KZ, Schluter J, Foster KR. マイクロバイオームの生態学: ネットワーク、競争、安定性。Science. 2015;350(6261):663–6.
論文
CAS
パブコメ
Google Scholar
中国の養豚場廃水処理場における細菌/ファージを介したARGのプロファイル:移動性遺伝要素、細菌群集および環境因子との関連。J Hazard Mater. 2021;404:124149.
論文
論文
パブコメ
Google Scholar
短期低温ストレスはブタの盲腸と糞便中の抗生物質耐性遺伝子量を減少させる。J Hazard Mater. 2021;416:125868.
論文
論文
パブコメ
Google Scholar
iMeta.Wei X, et al. 2022;1(4):e15.
北極圏永久凍土地域における抗菌剤耐性遺伝子と病原性因子遺伝子のメタゲノム解析。Environ Pollut. 2022;294:118634.
論文
論文
パブコメ
Google Scholar
南シナ海における抗生物質耐性遺伝子と病原性因子の多様性、存在量、分布がメタゲノム解析によって明らかになった。Sci Total Environ. 2022;814:152803.
論文
論文
パブコメ
Google Scholar
参考文献ダウンロード
謝辞
該当なし。
資金提供
本研究は、中国博士研究員科学基金(2022T150226)および広東省科学技術計画プロジェクト(2020B1212060060)の助成を受けた。
著者情報
著者および所属
華南農業大学畜産学院広東省嶺南現代農業研究室、農業動物ゲノム・分子育種広東省重点実験室、中国広州市、510642
ヤン・イーウェン、ユアン・イーリン、ウー・インバオ、ワン・イェン、リャオ・シンディ
香港中文大学医学部消化器病研究所、香港、999077、中国
胡新文
中国農業大学畜産科学技術学院動物栄養国家重点実験室, 北京, 100193, 中国
Shuang Cai
広州医科大学第二附属病院リハビリテーション科、広州、510260、中国
胡南
蘭州大学獣医学院獣医病因生物学国家重点実験室 蘭州市, 730000, China
Mi Jiandui
寄稿
Yiwen Yang: 構想、調査、方法論、形式分析、原案執筆、プロジェクト管理、資金獲得。胡新文: 調査、方法論、執筆-校閲・編集。Shuang Cai: 執筆-校閲・編集、方法論。ナン・フー 調査。イリン・ユアン 調査。 インバオ・ウー 執筆、校閲、編集。ヤン・ワン 執筆-校閲・編集。Mi Jiandui: 形式分析。シンディ・リャオ 方法論、形式分析、プロジェクト管理。
対応する著者
Yiwen YangまたはXindi Liaoまでご連絡ください。
倫理申告
倫理承認と参加同意
広州医科大学第二附属病院倫理委員会(2019-KY-166C)により倫理的承認を得た。動物倫理は華南農業大学倫理委員会より承認を得た。
発表に関する同意
該当なし。
競合利益
著者らは競合する利益はないと宣言している。
追加情報
出版社ノート
シュプリンガー・ネイチャーは、出版された地図の管轄権の主張および所属機関に関して中立を保っている。
補足情報
追加ファイル1:
表S1.本研究のネコに関する情報。表S2. 本研究のボランティアに関する情報。図S1. (A)猫の腸と(B)ヒトの腸におけるコアARG。図S2. 移動性ARGの相対的存在量。図S2. 移動性ARGの相対的存在量。図S4. 猫の腸、ヒトの腸、および生活環境由来のMAGの相対的存在量。図S5. ヒト腸管由来のMAGにおけるARGの存在量。
権利と許可
オープンアクセス この記事は、クリエイティブ・コモンズ表示4.0国際ライセンスの下でライセンスされている。このライセンスは、原著者および出典に適切なクレジットを与え、クリエイティブ・コモンズ・ライセンスへのリンクを提供し、変更が加えられた場合にその旨を示す限り、いかなる媒体または形式においても使用、共有、翻案、配布、複製を許可するものである。この記事に掲載されている画像やその他の第三者の素材は、その素材へのクレジット表記に別段の記載がない限り、記事のクリエイティブ・コモンズ・ライセンスに含まれています。この記事のクリエイティブ・コモンズ・ライセンスに含まれていない素材で、あなたの意図する利用が法的規制によって許可されていない場合、あるいは許可された利用を超える場合は、著作権者から直接許可を得る必要があります。このライセンスのコピーを閲覧するには、http://creativecommons.org/licenses/by/4.0/。クリエイティブ・コモンズ・パブリック・ドメインの権利放棄(http://creativecommons.org/publicdomain/zero/1.0/)は、データへのクレジット表記に別段の記載がない限り、この記事で利用可能となったデータに適用されます。
転載と許可
この記事について
アップデートを確認する。CrossMarkで最新性と真正性を確認する。
この記事の引用
Yang,Y.,Hu,X.,Cai,S.他. Pet cats may shape the antibiotic resistome of their owner's gut and living environment. Microbiome 11, 235 (2023). https://doi.org/10.1186/s40168-023-01679-8
引用文献のダウンロード
受領
2023年3月15日
受理
2023年9月27日
掲載
2023年10月23日
DOI
https://doi.org/10.1186/s40168-023-01679-8
この記事を共有する
以下のリンクをシェアすると、誰でもこのコンテンツを読むことができます:
共有可能なリンクを取得
コンテンツ共有イニシアチブSpringer Nature SharedItにより提供されています。
キーワード
抗生物質レジストーム
ペット猫
ヒト
腸内環境
生活環境
マイクロバイオーム
ISSN: 2049-2618
お問い合わせ
投稿に関するお問い合わせ:lyndie.manicani@springernature.com
一般的なお問い合わせ: info@biomedcentral.com
ブログを読む
BMCニュースレターを受け取る
記事アラートの管理
言語校正
著者のための科学的校正
ポリシー
アクセシビリティ
プレスセンター
サポートとお問い合わせ
フィードバックを残す
採用情報
BMCをフォローする
BMCツイッターページ
BMC Facebookページ
BMC微博ページ
このウェブサイトを使用することで、当社の利用規約、お客様の米国におけるプライバシー権、プライバシーステートメント、およびクッキーポリシーに同意したものとみなされます。プライバシーに関する選択/プリファレンスセンターで弊社が使用するCookieを管理する。
シュプリンガー・ネイチャー
別段の記載がない限り、© 2023 BioMed Central Ltd. シュプリンガー・ネイチャーの一部です。
この記事が気に入ったらサポートをしてみませんか?
