
サル痘について
はじめに
サル痘は、天然痘に類似した発疹を生じるウイルス性人獣共通感染症である。しかし、サル痘感染による人から人への感染および死亡率は、天然痘の場合よりもかなり低い。臨床的には、これら 2 つのウイルス感染症の区別は困難であり、サル痘がバイオテロに利用される懸念がある[1]。
■ウイルス学
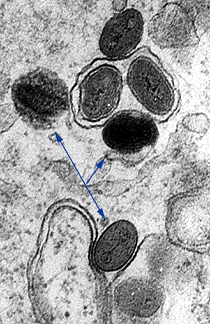
オルソポックスウイルスであるサル痘は、1950年代後半に病気のサルのコロニーから初めて単離された。このウイルスは、バリオラ(天然痘の原因物質)およびワクシニアウイルス(天然痘ワクチンに使用されるウイルス)と同じ属に属するものである。サル痘ウイルスを感染させた細胞を電子顕微鏡で観察すると、レンガ状のビリオンが観察され、バリオラウイルスやワクシニアウイルスと区別がつかない(写真1)。
疫学的、動物学的、分子生物学的証拠から示唆されるように、サル痘はアフリカの異なる地理的地域に2つの異なる系統が存在する[2]。中央アフリカから分離された株と比較して、西アフリカのサル痘は毒性が弱く、もう一方のウイルス株に存在する多くの遺伝子が欠如している[2,3]。
■疫学
歴史
- 猿痘ウイルスは、サハラ以南のアフリカで数千年にわたりヒトに感染してきたと考えられている [1]。
サル痘は、1970年代にコンゴ民主共和国(旧ザイール共和国)でヒトの疾患の原因として初めて同定された[1,4-7]。ヒトの病原体として認識された後、1970年から1980年の間に59例のヒトのサル痘が報告され、死亡率は17%であった。これらの症例はすべて、西部および中部アフリカの熱帯雨林で、森の小動物(例えば、げっ歯類、リス、サル)に接触した個体の間で発生した。
西半球で最初にサル痘が発生したのは、2003年に米国だった[8-10]。
感染経路
動物からヒトへの感染
-ウイルスは通常、感染した動物の体液との接触や咬傷によって獲得される。サルやヒトは偶発的な宿主であり、レザボアは不明だが、げっ歯類である可能性が高いとされている。西アフリカから感染したげっ歯類が誤って米国に輸入されたため、西半球で初めてヒトにサル痘が感染した。
2003年に米国で発生した集団感染の知見に基づくと、感染経路および曝露の程度(例えば、咬傷と感染動物への接触)がサル痘感染の臨床症状の重症度に影響を及ぼす可能性がある。例えば、ある研究では、プレーリードッグへの曝露を非侵襲性(例えば、感染動物に触れた、感染動物のケージを掃除した)と「複合型」(例えば、病気のプレーリードッグに噛まれたり引っかかれたりした)に分類した [11]。複合的な曝露を受けた患者は、非侵襲的な曝露を受けた患者よりも全身性疾患の徴候を発症する可能性が高かった。
ヒトからヒトへの感染
- ヒトからヒトへの感染は、大きな呼吸器飛沫を介して起こる可能性がある。また、感染性の皮膚病変との密接な接触や病変物質との接触によっても感染することがある。
飛沫感染の場合、感染には長時間の対面接触が必要な場合がある(例:個人防護具[PPE]がない場合、半径6フィート以内で3時間以上) [12]。
一般に、人から人への感染性は非常に低い [13]。しかし、2022年5月に見られた症例群では、人から人への感染リスクは高いようだ[14]。これらのクラスターでは、性行為時の感染性皮膚病変の密接な接触が最も可能性の高い感染様式であると考えられる。より詳細な情報は、今後の調査により明らかにされる予定である。
天然痘の予防接種が中止されて以来、ほとんどの症例は中央・西アフリカで発生している。しかし、他のいくつかの国でも散発的な症例が報告されており、その多くは旅行に関連したものである。米国では、アフリカから輸入されたエキゾチックアニマルが原因となり、発生したことがある。
①アフリカ
- 1996年から1998年にかけて、約100人の間で膿疱性病変を伴う熱性疾患が発生し、80%の二次発作率が報告されました[4,7]。水痘が同時に発生したため、症例の分類を誤った可能性があり、高い二次感染率を説明したものと思われる。しかし、この大流行により、サル痘が変異して天然痘に似てきたのではないかという懸念が生まれた[4,7]。しかし、活動中の症例から得られたサル痘の配列分析では、有意な遺伝的変化は見られなかった[13,15]。このアウトブレイクでの死亡率が全体的に5%未満であったことも、サル痘がより致死性の高いヒト病原体に変異していないことを示すものであった[7,13]。
その後、2005年から2007年にかけて行われた人口ベースのサーベイランス調査では、コンゴ民主共和国におけるサル痘の感染率が1980年代に比べて20倍も増加していることが確認された[16]。2005年から2007年にかけて、実験室で確認されたヒトのサル痘の症例は760例であった[16]。この研究は、天然痘の予防接種歴がないためにサル痘のヒトの症例が増加するという事前の懸念を確認した。天然痘の予防接種歴を持つ者は、未接種の者に比べてサル痘の感染リスクが5倍低かったのである。その他、森林地帯に居住していること、性別が男性であること、年齢が15歳未満であることなどが、感染リスクの上昇に関連していた。
2017年以降、ナイジェリアではサル痘の症例が増加しており、これは約40年間症例が報告されていなかった後に発生したものだ[17]。これらの症例の一部は、帰国した旅行者の間で発生している。2017年のアウトブレイクを評価したある研究では、関連する分離株の小さなプールが輸出された感染源である可能性が高いとされている[18]。
②米国
●2003年の発生
- 2003年5月15日から6月にかけて、6つの州で71例のヒトサル痘の発生が疾病管理予防センター(CDC)によって調査され、35例が実験室で確認された[8-10]。この症例群以前には、サル痘は西半球では発見されていなかった。
調査の結果、最近ペットのプレーリードッグを購入した患者に発熱性疾患が発症し、その後、膿疱性発疹が出現したことが明らかになった。プレーリードッグは、イリノイ州の流通センターでアフリカネズミと一緒に飼育されていたときに、アフリカネズミからウイルスを獲得したようだ。
イリノイ州、インディアナ州、ウィスコンシン州の患者10人のうち9人の皮膚病変と、死亡したペットのプレーリードッグ1匹のリンパ節組織から得られたDNA配列により、サル痘感染が確認された[8]。ヒトの症例のほとんどは、動物への直接の曝露があったが [19]、人から人への感染は除外できなかった。ウィスコンシン州で報告された症例のうち、アウトブレイクに関連したプレーリードッグに曝露された動物病院のスタッフは特にリスクが高く、その発症率は23%だった[20]。
このアウトブレイク中、サル痘は人から人への感染率が非常に低いようだった。サル痘の患者に接した57人の医療従事者を対象としたある研究では、病気の徴候や症状を報告した者はいなかった[21]。1人だけが最近のオルトポックスウイルス感染の実験室的証拠を持っていたが、これはおそらく以前の天然痘ワクチン接種による二次感染であった。対照的に、天然痘の二次攻撃率は70%にもなることがある[5,22]。
このアウトブレイクにより、その後、プレーリードッグやアフリカからの動物(ガンビアジャイアントラットに加え、ツリーリス、ロープリス、ヤマネ、ブラシテールヤマアラシ、シマネズミなど)の輸送、販売、野生への解放はCDCと米国食品医薬品局(FDA)により禁止された[10]。この禁止令の時以降、米国での発生はない。
●その後の事例
-2021年7月、テキサス州ダラスで患者がサル痘と診断された[12]。この患者はナイジェリアからの帰省中に症状を発症した。
2022 年 5 月、マサチューセッツ州で患者が確認された[23]。この患者は最近、自家用交通機関でカナダに旅行しており、アフリカに旅行したことはなかった。他の州での疑い例も報告されている[24]
③欧州
-2022年5月、ポルトガル、スペイン、英国(UK)を含む欧州で、サル痘の複数のクラスターが報告された[14]。ほとんどの症例は、男性と性交渉を持つ男性で確認された。現時点では、この集団発生の症例間に直接的な関連があるかどうかは不明ですが、一つの仮説として、性行為時の密接な接触により、特定のコミュニティ内で感染が広がっている可能性がある。
5月7日に英国で発生した最初の症例は、最近ナイジェリアへ渡航した人物から確認された。その1週間後、英国でさらに6人の患者が確認されたが、これらは流行地への最近の旅行や猿痘患者であることが知られている人との密接な接触とは関連がなかった。
英国以外でも複数の症例が報告されている。一例として、ポルトガルでは、5月18日に5例の確定患者と20例以上のサル痘の疑い患者が報告された。すべての症例は、リスボンとテージョ渓谷の若い男性だった。スペインでも8例の疑い例が報告された。他のヨーロッパ諸国における追加の症例が調査されている[24]。
2022年5月のアウトブレイクに先立ち、2018年以降、英国では7例のサル痘患者が報告されており、そのほとんどが流行国への渡航に関連するものだった。2018年には、最近サル痘の症例が報告されたナイジェリア南部から英国に渡航した患者において、2例のサル痘の症例が報告されている[25]。これらの患者のうち1人は、医療従事者にサル痘を広めたようだ[26]。
④その他の国
- ナイジェリアからの渡航に関連した散発的な症例がイスラエル [27] とシンガポール [28] で報告されている。
2022年5月、カナダ[29]とオーストラリア[30]で症例が報告された。これらの症例は流行地域への渡航に関連したものではなく、上記のヨーロッパでのアウトブレイクに関連したものと思われる。
■潜伏期
前述の米国での集団発生では、曝露から症状発現までの時間を推定することができた。患者の約半数は、感染した動物に引っかかれたり、噛まれたり、撫でられたりしたことを報告している[31]。29人の患者について、曝露から発病までの推定潜伏期間は12日であった。動物に噛まれたり引っかかれたりしたことのある人は、触覚による曝露を受けた人よりも潜伏期間が短い可能性がある(それぞれ13日対9日)[11]。
■臨床症状
アフリカにおける血清疫学的研究に基づいて、サル痘感染の大部分は無症状である。有症者の場合、サル痘は発熱、悪寒、筋肉痛などの全身疾患を引き起こし、天然痘のものと区別するために重要な特徴的な発疹を伴う。また、ウイルスの株によって臨床症状が異なることもある。
アフリカでの発生
-アフリカでは、サル痘の発疹は体幹から始まり、周辺に広がって手のひらや足の裏を侵す。病変は粘膜を侵すこともあり、通常0.5〜1cmの大きさになる。発疹は通常、黄斑および丘疹で始まり、2〜4週間かけて小水疱、膿疱、そして臍帯、かさぶた、落屑へと進行する。患者によっては、感染動物との直接の接触により、手指に限局した発疹を生じるのみである。
米国での発生
- アフリカでのサル痘に関する包括的な臨床情報は限られていますが、2003年の米国での発生により、医療記録が入手できた37人のうち34人について、この疾患の特徴をさらに明らかにすることができた[31]。主な徴候および症状は以下の通りであった。
発疹(97%)、発熱(85%)、悪寒(71%)
リンパ節腫脹(71%)
頭痛(65%) 、筋肉痛(56%)
発熱は発疹より約2日先行するが、発熱期間の中央値は発疹より短かった(それぞれ8日、12日)。米国で確認された初期症例の以下の臨床写真は、ウィスコンシン州のMarshfield Clinicで撮影されたものだ(写真2)。この米国での集団発生の発疹は、初診時に斑状丘疹と表現され、その後発疹は小水疱、膿疱へと進展し、2〜3週間の間に最終的に痂皮化した[31]。



34人の患者のうち9人は,吐き気,嘔吐,嚥下障害などさまざまな理由で入院した。最も重症の患者2名の退院時の診断は、脳症と後咽頭膿瘍であった。この症例シリーズでは,全例が支持療法により生存しており,抗ウイルス療法は行われていない.臨床検査では,アミノトランスフェラーゼの異常,白血球増加,軽度の血小板減少,低アルブミン血症などの非特異的な検査所見が複数認められた. 2022年5月に報告された症例群では、直腸炎を呈する患者や、性器や肛門周囲にのみ病変が存在する患者がいることが指摘された[23,32]。
■診断
臨床的特徴は診断に有用ですが、他の病因による疾患と鑑別するためには、実験室でサルポックス・ウイルスを確認する必要がある。診断法には、ウイルス分離(哺乳類細胞培養)、電子顕微鏡、リアルタイムポリメラーゼ連鎖反応(PCR)、酵素結合免疫吸着測定法(ELISA)、免疫蛍光抗体測定法などがある [1,33] 。電子顕微鏡では、特徴的なレンガ状のポックスウイルスビリオンが検出される。病理組織学的解析では、ケラチノサイトのバルーン状変性、顕著なスポンジ化、皮膚浮腫、および急性炎症を示すことがあるが、これらの所見は他のウイルス感染症でも見られることがある [34]。
2003年の米国での集団発生時に得られた患者の血清を使用して、疾病管理予防センター(CDC)は、最近のサルポックスウイルス感染を証明する免疫グロブリンM-捕捉法およびIgG ELISA法を開発した。血清IgM抗体とIgG抗体は、それぞれ発疹の発症から5日と8日後に検出された[35]。他の実験的な抗体および細胞ベースのアッセイも開発中であり、サル痘の前向きおよび後ろ向き診断に有用であると考えられる[22]。
サル痘の診断が検討されている場合、CDCとともに地方および州の公衆衛生当局に通知し、検体を迅速に処理する必要がある。
■鑑別診断
サル痘の鑑別診断では、水痘、単純ヘルペスウイルス、天然痘、その他のポックスウイルスなど、いくつかの感染症を考慮する必要がある。
天然痘の世界的な根絶を考えると、診断上最も可能性が高いのは水痘(水疱瘡)である。水痘の場合、診察時に小水疱の発生・治癒の段階が異なるのが特徴ですが、サル痘の場合は概ね同じ段階の病変が見られる。
バイオテロに関する懸念から、アフリカの熱帯雨林に行ったり、感染の可能性のある動物に触れたりしていない患者の鑑別診断では、天然痘の可能性を考慮することも重要である [6]。ワクチン未接種の患者の大半で観察されるリンパ節腫脹は、サル痘の重要な特徴である [10]。リンパ節腫脹は、顎下、頸部、鼠径部に生じることがある。
また、アフリカのポックスウイルスであるタナポックスも鑑別診断の対象となる。タナポックスは発熱性の前駆症状と皮膚病変を引き起こし、数週間で治癒して後遺症が残らない。コンゴ共和国で8週間チンパンジーの世話をしていたアメリカ人大学生の生検皮膚病変の電子顕微鏡検査とDNA解析(ポリメラーゼ連鎖反応検査)によりタナポックス感染症と診断されましたが、他の動物に感染した者はいなかった[36]。
オーフやウシ口炎(これもパラポックスウイルスによる)は、サル痘と同様の皮膚病変を局所的に生じるが、経験豊富な顕微鏡医であれば電子顕微鏡での形態的特徴により区別できる。パラポックスウイルスはオルソポックスウイルスよりやや小さく、オルソポックスウイルスより規則的な表面パターンを持っている。
■患者管理
支持療法
- ほとんどの患者は軽症で、医学的介入なしに回復する。脱水症の危険因子(例えば、吐き気、嘔吐、嚥下障害)を持つ患者は、水分補給のために短期間の入院が必要になる場合がある。重篤な患者には、感染から回復するまで支持療法が必要である。
抗ウイルス剤
- 猿痘の治療には、いくつかの抗ウイルス剤が有効な場合がある。これらの薬剤は、動物モデルや健康な人での投与試験に基づいて天然痘の治療に承認されているが、ヒトのサル痘に対しても同じ活性が期待される。
一般に、テコビリマットが治療法として選択されるが専門家によっては、重症の患者にはテコビリマットとブリンシドフォビルの二重療法を使用する場合もある。治療法の決定は、地域の保健所や米国疾病対策予防センター(CDC)と相談しながら行う必要がある。米国では、テコビリマットとブリンシドホビルは、米国政府の戦略的国家備蓄を通じてのみ入手可能。
テコビリマット
- 2018年7月、テコビリマットは米国で天然痘の治療薬として使用が承認された[37]。この薬剤は、非ヒト霊長類を致死的なサルポックスウイルス感染から保護し[37-39]、ヒトのこの感染に対しても有効である可能性が高い。Tecovirimat は、感染宿主内での播種に不可欠な感染性ウイルス粒子の形成に必要なオルソポックスウイルス蛋白質の強力な阻害剤である。
テコビリマットの推奨用量は、製造元の添付文書およびUpToDate内のLexicomp薬剤情報トピックに記載されているように、患者の体重によって異なる。治療期間は14日間。最も頻繁に報告される副作用は、頭痛、吐き気、腹痛。
ブリンシドフォビル
- 2021年6月、ブリンシドフォビルは米国で天然痘の治療に使用することが承認された[40]。ブリンシドホビルはシドホビルの類似品で、経口投与が可能である。
動物モデルでサル痘の治療にブリンシドホビルを使用した限られたデータしか公表されていないが[41]、他の動物モデルでは、オルトポックスウイルス感染症の有効な治療法である可能性が高いことを示している[42,43]。
シドホビル
-シドホビルは、サル痘に対してin vitroで活性があり、動物モデルで致死的なチャレンジに対して有効であることが示されている[44-46]。しかし、ヒトにおけるサル痘感染に対する有効性に関する臨床データはなく、その使用は腎毒性を含む重大な有害事象と関連する可能性がある。
■死亡率
中央アフリカでは、致死率は約10%で、死亡は一般的に発病2週目に起こる[1,47]。これとは対照的に、米国でのアウトブレイクでは死亡者はいなかった。米国におけるこれらの良好な転帰は、より健康な患者集団、より利用しやすい支援医療、および西アフリカのガーナから輸入されたより毒性の低いサル痘の株と関係があるかもしれない[31]。
■予防
天然痘ワクチンの事前接種により、感染を予防し、症状を改善することが示唆されている。天然痘ワクチンやワクシニア免疫グロブリンによる曝露後予防の役割は、後述するように不明確。
天然痘予防接種
-ワクシニアウイルスによる事前の天然痘予防接種は、サルポックスウイルスの獲得に対して大きな予防効果があり、この感染症の臨床症状を改善する可能性がある[5,22]。2019年9月、天然痘およびサル痘の予防を目的とした改良型ワクシニアアンカラ(MVA)ワクチン(商品名:イムバミューン、ジンネオスとして販売)が承認された[48]。
アフリカでは、2278人の家庭内接触者の二次攻撃率は、事前の天然痘ワクチン接種状況によって大きく変化した(ワクチン接種者と非接種者で1.3%に対し7.5%)[21]。アフリカでヒトのサル痘患者が増加していることを示した研究 [16] では、ワクチン接種者はワクチン非接種者に比べてサル痘のリスクが5倍低かった(1万人当たり0.78人対4.05人)。この研究では、天然痘ワクチン接種の遠距離歴がある人のワクチン効果は約81%と推定された。
米国の集団発生では、実験的手法を用いたさらなる調査により、サル痘に曝露する13年、29年、48年前に天然痘ワクチン接種を受けたことのある人が、さらに3人サル痘に曝露していることが確認されました[22]。これらの人々は、認識できる疾患症状がなかったため、感染したことに気づかなかった。これらの知見は、米国におけるサル痘の発生が、これまで考えられていたよりも大規模であったことを示唆している。さらに、西アフリカのサル痘に対する交差防御的な抗ウイルス免疫は、天然痘ワクチン接種後何十年も維持される可能性がある。
曝露後予防法
曝露後ワクチン接種
-サル痘への曝露後(例:個人防護具(PPE)なしで患者または患者の部屋の物品に直接接触した場合)、近接接触者の監視と隔離に加えて、MVAワクチンによる曝露後ワクチン接種を特定の患者に検討することができる[26]。この決定は、公衆衛生当局と連携して行う必要がある。イングランド公衆衛生局は、表(表1)にまとめた曝露の可能性のある人に対するリスク評価と公衆衛生上の勧告を作成した[26]。
ワクシニアウイルスによる事前のワクチン接種がサル痘感染を防ぐことから、米国疾病対策センター(CDC)は、2003年の米国での発生でサル痘に曝露した小児や妊婦を含む限られた人たちに対してワクシニアウイルスによるワクチン接種を推奨している。CDCはまた、アウトブレイクの調査に携わった人や、サル痘の患者をケアする医療従事者に対しても、曝露前のワクチン接種を推奨した[8,10]。大人28名と子供2名がこの目的のために天然痘ワクチンの接種を受けたが、これらの接種者の中にサル痘の症例は確認されなかった[10]。さらに、2003年の大流行では、妊娠中の猿痘の症例は確認されなかった。妊婦の感染で予後が異なるかどうかは不明である[49]。
ワクシニアワクチンを用いた天然痘の曝露後ワクチン接種に関する過去のデータに基づいて、サル痘の曝露後ワクチン接種の最適な時期は4日以内。しかし、CDCによれば、ワクチン接種は、密接な接触の曝露から14日まで検討することができる[50]。密接な接触とは、動物が操作された環境(例えば、診察室)で、鼻汁、咳、結膜炎などの呼吸器症状を持つ、猿痘患者の可能性が高い、または確認された動物の6フィート以内の直接暴露と定義される[50]。
ワクシニア免疫グロブリン
-ワクシニアウイルスワクチンによる免疫が禁忌であるため、曝露歴のある免疫抑制患者にはワクシニア免疫グロブリンの使用が検討されることがある[1]。
感染予防策
- サル痘と天然痘が鑑別診断に含まれるような原因不明の全身性小水疱性発疹には、接触予防策と空気感染予防策の両方が推奨される [21]。
発疹の最初の1週間は、サル痘が疑われる人は感染していると考え、すべてのかさぶたが分離し、咽頭スワブのポリメラーゼ連鎖反応(PCR)の結果が陰性になるまで隔離する必要がある [1]。
-------------------------------------------------
引用文献
WHO. Technical Advisory Group on Human Monkeypox. Report of a WHO meeting. Geneva, Switzerland, 11-12 January 1999.
United States Centers for Disease Control and Prevention. Potential exposure to person with confirmed human monkeypox infection — United States, 2021 https://emergency.cdc.gov/han/2021/han00446.asp (Accessed on July 21, 2021).
European Centers for Disease Control. Monkeypox cases reported in UK and Portugal. https://www.ecdc.europa.eu/en/news-events/monkeypox-cases-reported-uk-and-portugal (Accessed on May 19, 2022).
United States Centers for Disease Control and Prevention. CDC and Texas Confirm Monkeypox In U.S. Traveler https://www.cdc.gov/media/releases/2021/s0716-confirm-monkeypox.html (Accessed on July 21, 2021).
United States Centers for Disease Control and Prevention. CDC and health partners responding to monkeypox case in the U.S. https://www.cdc.gov/media/releases/2022/s0518-monkeypox-case.html (Accessed on May 19, 2022).
United States Centers for Disease Control and Prevention. Monkeypox in the United States. https://www.cdc.gov/poxvirus/monkeypox/outbreak/us-outbreaks.html (Accessed on May 20, 2022).
Yong SEF, Ng OT, Ho ZJM, et al. Imported Monkeypox, Singapore. Emerg Infect Dis 2020; 26:1826.
Public Health Agency of Canada. Public Health Agency of Canada confirms 2 cases of monkeypox. https://www.canada.ca/en/public-health/news/2022/05/public-health-agency-of-canada-confirms-2-cases-of-monkeypox.html (Accessed on May 20, 2022).
https://www.health.gov.au/news/monkeypox-update-from-acting-cmo-dr-sonya-bennett (Accessed on May 20, 2022).
United States Centers for Disease Control and Prevention. Monkeypox virus infection in the United States and other non-endemic Countries—2022. https://emergency.cdc.gov/han/2022/han00466.asp (Accessed on May 20, 2022).
FDA approves the first drug with an indication for treatment of smallpox. https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm613496.htm (Accessed on July 18, 2018).
US Food and Drug Administration: FDA approves drug to treat smallpox. https://www.fda.gov/drugs/drug-safety-and-availability/fda-approves-drug-treat-smallpox (Accessed on July 07, 2021).
Frey SE, Belshe RB. Poxvirus zoonoses--putting pocks into context. N Engl J Med 2004; 350:324.
US Food and Drug Administration. FDA approves first live, non-replicating vaccine to prevent smallpox and monkeypox. https://www.fda.gov/news-events/press-announcements/fda-approves-first-live-non-replicating-vaccine-prevent-smallpox-and-monkeypox (Accessed on October 23, 2019).
Updated interim CDC guidance for use of smallpox vaccine, cidofovir, and vaccinia immune globulin (VIG) for prevention and treatment in the setting of an outbreak of monkeypox infections. www.cdc.gov/ncidod/monkeypox/treatmentguidelines.htm (Accessed on September 05, 2008).
この記事が気に入ったらサポートをしてみませんか?
