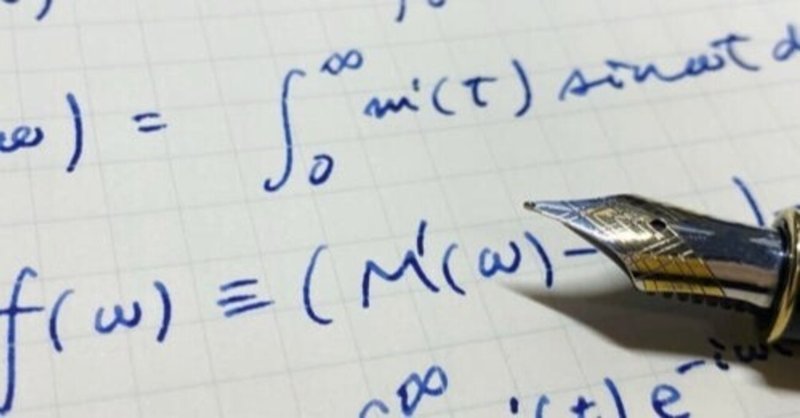2021年6月の記事一覧
モル計算のやり方②
モルの計算の基本は、大きく分けて3つです。①物質量を質量にかえる、②物質量を体積にかえる、③物質量を個数にかえる。
そして、計算のやり方は二通りしかありません。物質量から他にかえるときは「かける」、他から物質量にもどすときは「わる」になります。
本記事は、物質量と体積の変換について解説します。
(音声解説はこちらへ!
https://stand.fm/episodes/60d4fd95b22
「分子量」と「式量」の計算のやり方
原子量を足すだけです。
その名前のとおり、分子量は分子の量のことです。式量は大変分かりにくく、イオン式や組成式の量のことで、略して式量といいます。
計算のやり方CO2の分子量を求めてみます。炭素Cの原子量は12、酸素Oの原子量は16と与えられています。12➕16✖️2=44になります。
次に四つの式量を求めてみます。原子量はそれぞれC12、O16、Ca40、Al27、Cu63.5で計算します