
104)腸内細菌叢がうつ病の発症に関与する
体がみるみる若返るミトコンドリア活性化術104
ミトコンドリアを活性化して体を若返らせる医薬品やサプリメントを解説しています。
【うつ病が世界的に増えている】
うつ病は、思考、行動、感情、動機、および幸福感に悪影響を及ぼす深刻な医学的疾患です。うつ病は、特に高度に発展した国で発生する頻度が高いため、文明病と見なされています。世界では、約3億人、つまり世界人口の 4.4% がうつ病に苦しんでいます (Global Burden of Disease Study 2015)。
米国精神医学会が発行しているDSM-5(The Diagnostic and Statistical Manual of Mental Disorders-5)のうつ病診断基準によると、以下の9の症状のうち5つ以上が2週間ほとんど毎日存在し、それによって社会的・職業的に障害を引き起こしている場合にうつ病と診断されます。
①抑うつ気分
②興味または喜びの著しい低下
③食欲の増加または減少、体重の増加または減少(1か月で体重の5%以上の変化)
④不眠または過眠
⑤強い焦燥感または運動の静止
⑥疲労感または気力が低下する
⑦無価値感、または過剰・不適切な罪責感
⑧思考力や集中力が低下する
⑨死について繰り返し考える、自殺を計画するなど
その他に、疼痛、性欲減退、悲観、心気症、不安などの症状もあります。
うつ病の発症原因は正確にはよくわかっていません。精神的ストレスや身体的ストレスなどが引き金となって、感情や意欲を司る脳の働きに何らかの不調が生じているものと考えられています。性格が影響することもあります。遺伝的要因や、がんや糖尿病といった慢性的な身体疾患、妊娠出産や更年期障害などの内分泌変化も発症要因となります。
脳の中では神経細胞から神経細胞へ様々な情報が伝達されます。その伝達を担う神経伝達物質の中でセロトニンやノルアドレナリンといわれるものは、人の感情に関する情報を伝達する物質であることが知られています。
前述のさまざまな要因によって、これらの物質の機能が低下し、情報の伝達がうまくいかなくなり、うつ病の状態が起きていると考えられています。
【腸内細菌叢がうつ病の発症に関与している】
うつ病の病態生理学に関する最新の研究テーマの1つは、腸内微生物叢に焦点を当てています。腸と脳は双方向に互いの機能に影響を与え、ストレスやうつ病の発症に大きな影響を与えることが観察されています。腸内細菌叢は、神経伝達、神経新生、ミクログリアの活性化、および行動制御に関与する経路を介して脳にシグナルを伝達することが知られています。
腸と脳は腸内細菌叢を介してお互いに影響を与えていることが証明されており、腸内細菌叢-腸-脳軸(microbiome–gut–brain axis)と呼ばれています。
うつ病患者の腸内細菌叢の組成は健康な人とは異なることが注目されています。一部の細菌は、動物の神経系に見られるような神経調節物質(アセチルコリン、ドーパミン、セロトニン、GABA、ノルエピネフリン)を生成することが観察されています。
適切な量を摂取するとメンタルヘルスに有益な効果をもたらすプロバイオティクス細菌は、サイコバイオティクス(Psychobiotics)と呼ばれます。サイコバイオティクスは、腸のバリアを強化し、炎症の発生を抑制します。
サイコバイトティクスの概念は2013年の以下の論文で最初に紹介されました。
Psychobiotics: a novel class of psychotropic.(サイコバイオティクス: 新しいクラスの向精神薬)Biol Psychiatry. 2013 Nov 15;74(10):720-6.
【要旨】
ここでは、サイコバイオティクス(psychobiotic)を、適切な量を摂取すると、精神疾患に苦しむ患者に健康上の利益をもたらす生きた生物と定義する。
プロバイオティクス(probiotics)のクラスとして、これらの細菌は、脳腸軸(brain-gut axis)に作用するガンマアミノ酪酸やセロトニンなどの神経活性物質を生成および送達することができる。げっ歯類における前臨床評価は、特定のサイコバイオティクスが抗うつまたは抗不安活性を有することを示唆している。この効果は、迷走神経、脊髄、または神経内分泌系を介して媒介される可能性がある。
これまでのところ、サイコバイオティクスは、過敏性腸症候群患者の精神症状との関係で最も広く研究されており、ビフィドバクテリウム・インファンティス(Bifidobacterium infantis)を含む多くの微生物にプラスの効果が報告されている。うつ病の症状や慢性疲労症候群の緩和に効果があるという証拠が明らかになりつつある。このような利点は、特定のサイコバイオティクスの抗炎症作用と、視床下部 - 下垂体 - 副腎軸の活動を低下させる能力に関連している可能性がある。大規模なプラセボ対照試験の結果が待たれる。
腸内細菌とは、腸の中に棲み、様々な働きをしている菌のことです。腸内細菌はビタミンやミネラル、タンパク質などを合成しながら、腸の活動を調整し、人間の生命維持活動に役立っています。その腸内細菌の中で、人間の健康にとってよい働きをするものを善玉菌(有益菌)、悪い働きをするものを悪玉菌(有害菌)と呼んでいます。
腸内に善玉菌を根付かせ増やすためには、プロバイオティクスおよびプレバイオティクスの利用が有用です。
プロバイオティクス(probiotics)は「生命に有益な物質」という意味ですが、健康に有益な効果をもたらす腸内細菌(いわゆる善玉菌)を指します。「腸内フローラの善玉菌と悪玉菌のバランスを改善して動物に有益な効果をもたらす生菌添加物」のことで、乳酸菌が代表です。乳酸菌はビフィズス菌やアシドフィルス菌、ラクトバチルス、ブルガリア菌など乳酸を産生する腸内細菌です。
フルクトオリゴ糖など善玉菌の増殖を促進する物質のことをプレバイオティクス(prebiotics)と呼びます。「健康上の利益をもたらす宿主微生物(善玉菌)によって選択的に利用される物質」です。腸内の善玉菌に働いて、増殖を促進したり、善玉菌の活性を高めることによって健康に有利に作用する物質のことです。
このようなプロバイオティクスとプレバイオティクスを組み合わせると、効果的な腸内環境の改善ができます。プロバイオティクスとプレバイオティクスとを合わせたものをシンバイオティクス(synbiotics)と呼んでいます。
前述の論文では、「精神疾患に苦しむ患者に健康上の利益をもたらす生きた生物」をサイコバイオティクス(psychobiotic)と呼ぶことを提唱しています。
サイコバイオティクスの一つとして同定されたビフィドバクテリウム・インファンティス(Bifidobacterium infantis)は乳児の腸内から見つかったビフィズス菌の一種です。Infantは乳幼児のことです。ビフィドバクテリウム・インファンティスが大腸粘膜上皮のバリア機能を強化することが報告されています。ワカモト製薬のレベニンという整腸剤(乳酸菌製剤)のほか、ビフィズス菌の入ったサプリメントなどに使われています。
大腸粘膜上皮のバリア機能を強化する作用は前回(103話)紹介したアッカーマンシア・ムシニフィラ(Akkermansia muciniphila)にもあります。
【炎症はうつ病の発症を促進する】
前述の論文ではサイコバイオティクスのうつ病の改善作用において抗炎症作用の関与を示唆しています。
実際に、うつ病の発症のメカニズムとして炎症の関与の重要性が指摘されています。うつ病と炎症の関連については、以下のような点が根拠になっています。
1)多くの炎症性疾患でうつ病の発症率の増加が認められる。
2)インターフェロンなどの免疫調節剤は、うつ病を発症するリスクを増大させる。
3)うつ病患者では炎症性サイトカイン(TNF-α、IL-6、IL-1など)や炎症反応の際に肝臓から放出されるC反応性タンパク質(CRP)などの炎症性マーカーが上昇している。
4)抗炎症剤に抗うつ作用がある。
関節リウマチや全身性エリテマトーデスなどの自己免疫疾患や、感染症で入院した患者の半数くらい、あるいは半数以上がうつ病の症状を呈しているという報告があります。
関節リウマチなどのTNFαの過剰な発現によって引き起こされる様々な自己免疫疾患の治療に使われるTNFα拮抗薬は、うつ病を改善することが報告されています。
インターフェロンは動物体内で病原体(特にウイルス)や腫瘍細胞などの異物の侵入に反応して細胞が分泌するタンパク質です。ウイルス増殖の阻止や細胞増殖の抑制、免疫系および炎症の調節などの働きをするサイトカインの一種です。
医薬品としては、ウイルス性肝炎等の抗ウイルス薬として、腎臓がんや多発性骨髄腫に対する抗がん剤として用いられています。副作用としては発熱、だるさ、疲労、頭痛、筋肉痛、けいれんなどのインフルエンザ様症状、うつ病の発症があります。抑うつ症状については、インターフェロンが脳内のミクログリアを活性化することが関連しているという報告があります。
インターフェロンα(IFNα)やIL-2が免疫療法としてC型慢性肝炎やがんなどの治療に使用されています。そして、これらの治療を受けたケースではうつ病を発症するリスクが高まることが多くの論文で報告されています。IFNαによって誘発されるうつ病の有病率は10~40%と報告されています。
うつ病とサイトカインの関連を検討したメタ解析があります。
A meta-analysis of cytokines in major depression.(うつ病におけるサイトカインのメタ解析)Biol Psychiatry. 2010 Mar 1;67(5):446-57.
【要旨】
研究の背景:うつ病の有病者数は一般人口の4.4%から20%と報告されている。 多くの研究によって、うつ病は免疫系の異常および炎症反応系の活性化と関連していることが示唆されている。 我々の目的は、うつ病患者と正常者(対照)における特定のサイトカインの濃度に関するデータを定量的に解析することである。
方法:英文文献のデータベース検索(2009年8月現在)および引用文献の手動検索を行い、うつ病患者のサイトカイン濃度を測定した研究のメタアナリシスを行った。
結果:うつ病のDSM診断基準を満たす患者のサイトカインの測定を含む24件の研究をメタ解析の対象にした。
対照被験者(350人)と比較してうつ状態の被験者(438人)は、TNF-αの血中濃度が有意に高値であった。IL-6濃度も同様に、対照被験者(400人)に比べて、うつ病患者(492人)で有意に高かった。
結論:このメタ解析は、対照被験者と比較してうつ病の被験者では炎症促進性サイトカインのTNF-αおよびIL-6が有意に高い濃度を示すことを明らかにした。 個々の研究では、炎症性サイトカインとうつ病の関連において肯定と否定の両方の結果が報告されているが、このメタアナリシスの結果は、うつ病が炎症反応系の活性化を伴うエビデンスを強化している。
炎症性サイトカインが認知機能を低下することも報告されています。うつ病では、注意力や記憶力や実行機能などの認知機能の低下が報告されていますが、このような認知機能の低下は炎症性サイトカインが関係している可能性が指摘されています。
IL-1βやTNFαの血中濃度と認知機能障害が正の相関を示すことが報告されています。
炎症性サイトカインは、シナプスの可塑性や恒常性などの認知機能の制御に影響します。TNF-αなどの炎症性サイトカインの働きを阻害する薬がアルツハイマー病の治療薬として検討されています。
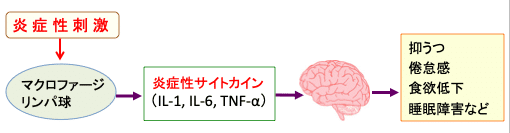
図:炎症刺激によってマクロファージやリンパ球から産生される炎症性サイトカイン(IL-1, IL-6, TNF-α)は脳に作用して、食欲低下、倦怠感、抑うつ、睡眠障害などの症状を引き起こす。
【腸管上皮細胞は粘液を産生して細菌の侵入を防ぐバリアを作っている】
大腸内には多くの微生物(腸内細菌)が棲みついています。一般に、500種類から1000種類、約100兆から1000兆個の微生物が存在すると言われています。
これらの腸内微生物は、腸内に常在しているだけでなく、食物繊維の分解によって産生される短鎖脂肪酸や、葉酸、ビタミンK、ビタミンB類などのビタミンを宿主に提供し、健康維持に大きく貢献しています。
しかし、こういった有益な腸内細菌も、体内に侵入すれば免疫システムによって外敵とみなされ排除されます。そのため腸内微生物と宿主の両者を空間的に分け隔てるメカニズムが必要であり、それを可能にするのが腸管上皮細胞によって構築される「粘膜バリア」です。粘膜バリアは物理的バリアと化学的バリアの二つに大別されます。
物理的バリアは物理的な壁となって微生物の侵入を防止するバリアであり、上皮層を被覆する粘液層、上皮細胞表面に存在する糖鎖の集合体である糖衣、細胞間接着装置である密着結合などがあります。
粘液層は腸管上皮細胞の一つである杯細胞から産生される糖タンパク質のムチンによって構成され、腸管上皮を覆うことで物理的に腸管組織への細菌侵入を防止しています。
化学的バリアは、抗菌活性を発揮することで細菌侵入を抑制する分子群です。ディフェンシンファミリー分子やReg3ファミリー分子などが含まれ,それらの分子は主として腸管上皮細胞の一つであるパネート(Paneth)細胞から産生されます。(下図)
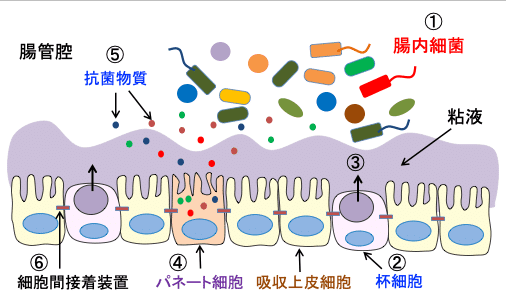
図:腸管腔には多数の腸内細菌が棲みついている(①)。杯細胞(②)から粘液が産生され、粘液層が形成される(③)。パネート細胞(④)からは様々な抗菌物質(⑤)が産生されている。粘膜上皮細胞の間には細胞間接着装置(⑥)があって、上皮間からの細菌の侵入を防いでいる。これらが腸内微生物の体内への侵入を防ぐ粘膜バリアを構築している。
【粘膜バリアを強化すると体内の炎症を抑えてうつ病を防ぐ】
抗生物質の投与や偏った食事や病原体感染などの理由によって、腸内細菌叢(微生物叢)を構成する細菌の種類や数が減少することにより,細菌叢(微生物叢)の多様性が低下した状態をディスバイオシス(dysbiosis)と言います。
何らかの原因により、腸内細菌の総菌数が著しく減少したり、その構成比が変化してしまうこと、また、通常は菌数レベルの低い菌種が異常に増加することなど、正常な細菌構成が異常になることがあります。これらの異常を総称して、ディスバイオシスと呼んでいます。
最近になって、ディスバイオシスが炎症性腸疾患、肥満、糖尿病などのさまざまな病気と密接な関わりをもつことが明らかとなってきています。
消化管粘膜上皮層は、粘膜バリアの重要な構成要素であることが知られています。健康な人では、上皮細胞間の密着結合(タイト・ジャンクション:tight junctions)が腸上皮の透過性を維持する上で極めて重要な役割を果たしています。
この上皮細胞間のタイト・ジャンクションが、消化管内に有害物質を隔離しながら栄養素の吸収を可能にしています。
さらに、腸上皮を覆う粘液層も粘膜バリア機能に寄与しています。この層は、糖タンパク質、ムチン、免疫グロブリン、および酪酸で構成されています。
たとえば、ムチン三量体は上皮細胞を内腔毒素から保護するバイオフィルムを構築し、分泌型IgAは粘液層の毒素や病原体を中和できる非常に重要な抗体です。
健康な腸内では、ラクトバチルスや連鎖球菌などのいくつかの有益な細菌が分泌型IgAの生合成を促進することが報告されています。
食物繊維の発酵によって産生される酪酸は、ムチン2(MUC2)遺伝子の発現を誘導することによってムチン合成を促進します。さらに、酪酸は腸上皮細胞から放出される抗菌ペプチドであるカテリシジン(cathelicidin)の分泌を促進することができます。
したがって、酪酸産生細菌は、健康な腸内の粘液の生理的組成を維持する上で重要な役割を果たしており、これらのプロセスにより、腸のバリアが十分に維持され、消化管内の病原体に対する宿主の防御が向上します。
しかし、様々な原因によって腸内微生物叢に異常が生じると、悪玉菌が増え、粘液層が破壊され、腸上皮の透過性が高まります。さらに、粘膜炎が発生し、バリア機能の低下によって病原菌が体内に侵入して敗血症を引きおこします。(下図)
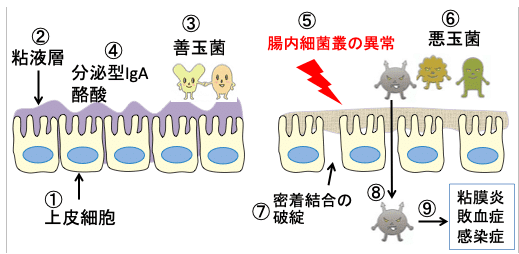
図:大腸粘膜上皮細胞(①)は密着結合(タイト・ジャンクション)によって隙間が無い状態で、粘液層(②)が厚く、善玉菌(③)が多く、分泌型IgAや酪酸の量が多い(④)。様々な原因で腸内細菌叢の異常(⑤)が起こって悪玉菌が増えると(⑥)、上皮細胞の間の密着結合が破綻して隙間ができ(⑦)、腸管内の病原菌が体内に侵入し(⑧)、粘膜炎や敗血症や全身感染症を引き起こす(⑨)。
腸内微生物叢の異常(ディスバイオシス)は、腸粘膜バリアの機能障害を引き起こします。腸内バリアが損なわれると、腸粘膜上皮の透過性の増加につながります。 細菌が体内に侵入すると慢性炎症を起こし、炎症性サイトカインの産生が増え、抑うつ、倦怠感、食欲低下を引き起こします。
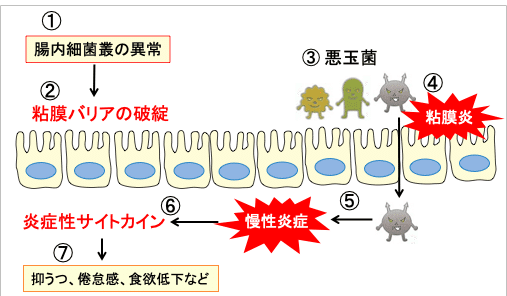
図:様々な原因によって腸内細菌叢の異常(Dysbiosis)が起こると(①)、粘膜バリアが破綻し(②)、悪玉菌が優位になって(③)、粘膜の炎症を引き起こす(④)。腸内細菌が体内に侵入して全身感染症を引き起こす(⑤)。体内の慢性炎症は炎症性サイトカインの産生を増やし(⑥)、抑うつ、倦怠感、食欲低下などの症状を引き起こす。
以上のことから、大腸粘膜バリアを強化する腸内細菌(ビフィズス菌、アッカーマンシア・ムニシフィラなど)は体内の炎症を防ぐことによってうつ症状を改善することが理解できます。
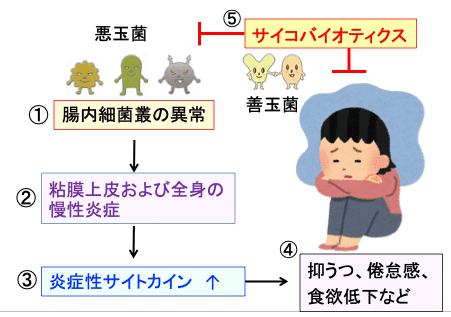
図:腸内の悪玉菌が増えて腸内細菌叢の異常が起こると(①)、粘膜バリアが破綻して、粘膜上皮や全身に慢性炎症が起こり(②)、炎症性サイトカインが増え(③)、抑うつ・倦怠感・食欲低下などの症状が起こる(④)。サイコバイオティクス作用を持った善玉菌を増やして腸内細菌叢を正常化すると抑うつ症状を改善できる(⑤)。
この記事が気に入ったらサポートをしてみませんか?
