
168)ドコサヘキサエン酸は全死因死亡率を低下する
体がみるみる若返るミトコンドリア活性化術168
ミトコンドリアを活性化して体を若返らせる医薬品やサプリメントを解説しています。
【オメガ3 系とオメガ6 系の不飽和脂肪酸はその働きに大きな違いがある】
リノール酸では、メチル基(CH3)に最も近い二重結合は、メチル基から6番目の炭素(C)にあります。この位置に二重結合を持つ脂肪酸をオメガ(ω)6系不飽和脂肪酸に分類します。
α-リノレン酸では、メチル基に最も近い二重結合はメチル基から数えて3番目のC にあります。この位置に二重結合を持つ脂肪酸をオメガ(ω)3系不飽和脂肪酸に分類します。最近ではω6の代わりにn-6 を用いてn-6系不飽和脂肪酸、そしてω3の代わりにn-3を用いてn-3系不飽和脂肪酸と呼ぶことが多くなっています(下図)。

オメガ6 系不飽和脂肪酸はリノール酸 → γ-リノレン酸 → アラキドン酸のように代謝されていき、アラキドン酸からプロスタグランジン、ロイコトリエン、トロンボキサンなどの生理活性物質が合成されます。
プロスタグランジンなどのアラキドン酸代謝産物は炎症や細胞のがん化を促進したり、がん細胞の増殖を速める作用があるのですが、体のいろんな生理作用に必要であるため、動物は食物(植物および肉類)からリノール酸を摂取しなければ生存できません。
オメガ3系不飽和脂肪酸はα-リノレン酸 → エイコサペンタエン酸(EPA) → ドコサヘキサエン酸(DHA)と代謝されていきます。オメガ3 系不飽和脂肪酸は炎症やアレルギーを抑え、血栓の形成や動脈硬化やがん細胞の発育を抑える作用があります。
リノール酸、アラキドン酸、α-リノレン酸は私たちの体内では合成できないため必須脂肪酸と呼ばれ、食事から摂取する必要があります。また、α-リノレン酸からエイコサペンタエン酸(EPA)への変換は8%程度、ドコサヘキサエン酸(DHA)への変換は0.1%以下と報告されており、EPAとDHAも食事から摂取する必要がある必須脂肪酸と考えられています。
【アラキドン酸からプロスタグランジンが産生される】
プロスタグランジン(PG)はアラキドン酸からシクロオキシゲナーゼ(COX)の働きにより合成される生理活性物質で、炎症の代表的なメディエーターです。細胞外からの種々の刺激に反応して生体膜のリン脂質にホスホリパーゼA2 (PLA2)が作用し、まずアラキドン酸が遊離し、このアラキドン酸から脂肪酸酸化酵素であるシクロオキシゲナーゼ(COX)の作用によりPGG2, PGH2へと変換され、さらに各種細胞に存在する特異的な合成酵素により生理的に重要な4種類のプロスタグランジン(PGD2, PGE2, PGF2a, PGI2)とトロンボキサン(TX)A2が合成されます。
COXにはCOX-1とCOX-2の2種類のアイソザイムが知られており、それぞれ生体内での役割が異なります。COX-1は胃や腸などの消化管、腎臓、卵巣、精嚢、血小板などに存在し、胃液分泌、利尿、血小板凝集などの生理的な役割を担います。一方、COX-2は炎症性刺激や増殖因子やサイトカインなどの刺激により、マクロファージ、線維芽細胞、滑膜細胞、がん細胞などで誘導され、炎症反応や血管新生やがん細胞の増殖を促進します。(下図)

DHAやEPAには抗炎症作用や鎮痛作用があります。実際に関節炎などの痛みを緩和し、C反応性タンパク(CRP)などの炎症マーカーを低下させる作用もあります。そのメカニズムとしては、プロスタグランジンE2などの炎症を引き起こす物質を生み出すオメガ6系のアラキドン酸がオメガ3系のDHAやEPAに置き換えられ、炎症物質ができにくくなるのが一つの理由です。
すなわち、オメガ3系不飽和脂肪酸を多く摂取すると、細胞膜中のオメガ3系不飽和脂肪酸が増加して、アラキドン酸濃度が低下するので、その結果アラキドン酸由来の炎症促進性物質の産生が抑制されるという機序です(下図)。

外傷や感染などに反応して急性炎症反応が起こりますが、異物の排除が完了すると炎症反応は速やかに消散し、組織の修復過程に移行します。炎症反応が終了することを「炎症の収束」と言います。
炎症の収束は、これまで起炎反応の減弱化によると考えられてきましたが、最近の研究で、受動的なものではなく、能動的な機構であることが明らかになっています。
急性炎症の特徴(症状)は白血球の組織への浸潤に伴う浮腫、発赤、発熱、痛みなどで、これらの反応にはアラキドン酸から生成されるプロスタグランジンやロイコトリエンなどの脂質メディエーターが関与します。これらの物質によって好中球の浸潤や活性化、血管透過性の亢進などの炎症反応が起こります。
炎症の収束過程においては炎症性サイトカインの産生が抑制され、血管透過性が正常に戻り、好中球の遊走阻止や浸出液中のリンパ球の除去や、マクロファージによる死滅した細胞の除去などが起こります。この炎症の収束過程には、EPAやDHAなどのオメガ3系不飽和脂肪酸から体内で生成されるレゾルビンやプロテクチンという抗炎症性メディエーターが関与します。
つまり、DHAやEPAはアラキドン酸と競合することで炎症性ケミカル・メディエーターの産生を阻害するだけでなく、抗炎症性(炎症収束性)の脂質メディエーターを生成することによって積極的に炎症を抑制する作用があるということです。
EPAやDHAの抗炎症作用やがん予防効果や心血管保護作用や脳神経系保護作用など多くの作用に、EPAやDHAから代謝されて生成される抗炎症性の脂質メディエーター(レゾルビンやプロテクチン)が関与しているようです。(下図)。

慢性炎症は老化を促進し、寿命を短縮することが明らかになっています。例えば、慢性炎症はテロメア短縮を促進します。
したがって、抗炎症作用のあるオメガ3系不飽和脂肪酸が老化を遅延し、炎症を促進するオメガ6系不飽和脂肪酸が老化の進行を促進することは十分に納得できます。
【現代人は食事からのオメガ6系不飽和脂肪酸の摂取が増えている】
旧石器時代は狩猟採集によって食糧を得ていました。旧石器時代の私たち祖先の食事のオメガ6(n-6)とオメガ3(n-3)の比率は1から2程度であったと言われています。しかし、現代人の食事は、このオメガ6:3の比率を10以上に増やしています。
過去100年間で、米国のリノール酸の摂取量は総エネルギー摂取量の3%未満から7%以上になりました。リノール酸はオメガ6系の不飽和脂肪酸です。米国では食事脂肪源が大豆油、トウモロコシ油、ベニバナ油などのオメガ6が豊富な種子油にシフトしたため、食事によるリノール酸の摂取量が大幅に増加したのです。
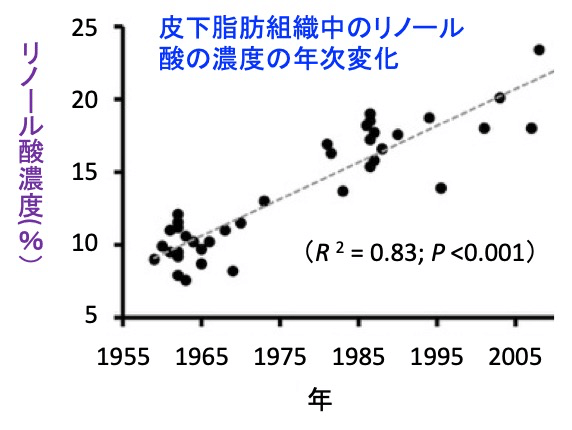
過去1世紀の間に、オメガ6の多い油の消費が増え、西欧諸国のオメガ6/3比を約4:1以下から約20:1に押し上げました。オメガ6/3比のこの約5倍の増加は、脂肪組織のリノール酸の増加に反映されています。米国のデータでは、皮下脂肪組織中のリノール酸の濃度は1950年代から半世紀の間に約2.5倍に増加しています(下図)。
オメガ6の摂取量は、主に大豆、トウモロコシ、ベニバナ油などのオメガ6が豊富な種子油の消費により増加しており、後者の2つはオメガ6/3の比率が60以上です。
日本食品成分表2022(八訂)のデータによると、ω6/ω3の比率は、大豆油が8.14、トウモロコシ油が65.13、ベニバナ油(サフラワー油)は高オレイン酸タイプで63.86、高リノール酸タイプで318.05です。
ベニバナ油(サフラワー油)の在来種はリノール酸73-82%、オレイン酸9-17%です。高オレイン酸タイプはリノール酸13-16%、オレイン酸74-79%です。オレイン酸はオリーブオイルに多く含まれる一価の不飽和脂肪酸です。リノール酸の取りすぎは健康に良くないということで高オレイン酸タイプのベニバナ油が主流になっています。
オレイン酸から、植物や微生物中で、ω6位に二重結合を作るΔ12-脂肪酸デサチュラーゼ によりオレイン酸の二重結合が一個増えてω-6脂肪酸であるリノール酸が生成され、ついでω3位に二重結合を作るΔ15-脂肪酸デサチュラーゼ によりリノール酸の二重結合が更に一個増えてω-3脂肪酸であるα-リノレン酸が生成されます。
亜麻仁油と紫蘇油(えごま油)はω6/ω3比は0.2くらいですが、その他の植物油はω6/ω3比は10以上です。中にはω6/ω3比が100を超えるものもあります。
【現代人は食事からのオメガ3系不飽和脂肪酸の摂取が減っている】
オメガ3系不飽和脂肪酸のα-リノレン酸は亜麻仁油や紫蘇油(エゴマ油)に含まれます。ドコサヘキサエン酸(DHA)とエイコサペンタエン酸(EPA)は魚や微細藻類など水産物に多く含まれます。
α-リノレン酸は人体では合成できないので、食事から摂取する必要があるので必須脂肪酸です。α-リノレン酸からEPAやDHAに体内で合成されることになっていますが、α-リノレン酸からEPAへの変換は10%以下、DHAへの変換は0.1%以下とほとんど起こらないことが明らかになっています。
つまり、亜麻仁油や紫蘇油を多く摂取しても、血液中のEPAは少し上昇しますが、DHAはほとんど増えません。α-リノレン酸(炭素数18、二重結合3個)からEPA(炭素数20、二重結合5個)と DHA(炭素数22、二重結合6個)に変換するのに必要な脂肪酸の鎖の長さを延ばす酵素と二重結合を作る(不飽和化する)酵素の活性が極めて低いからです。
したがって、最近はEPAとDHAも必須脂肪酸と同様の扱いになっています。つまり、食事やサプリメントでEPAとDHAを摂取しないと不足するのです。(下図)

世界の人口のほとんどは、ドコサヘキサエン酸(DHA)やエイコサペンタエン酸(EPA)のような海洋由来のオメガ-3多価不飽和脂肪酸が不足していることが指摘されています。特に、ドコサヘキサエン酸(DHA)は、脳と目(網膜)の発達に重要であるため、DHAの摂取不足は神経・精神機能と視力に悪い影響を及ぼします。
一方、脂ののった魚には100グラム当たり数グラムから20グラム程度の脂肪が含まれ、オメガ3系多価不飽和脂肪酸が1〜6グラム程度含まれています。DHA/EPAも数百mgから4グラム程度含まれています。脂ののった魚を1日100〜200g程度食べることはがんや心臓疾患の予防や治療に効果が期待できます。
【現代人の食事はオメガ6:オメガ3比が上昇している】
人間は、ほぼ同量のオメガ3およびオメガ6系の不飽和必須脂肪酸を含む食事を摂取して進化しました。動物の生命はオメガ3が豊富な環境で進化した可能性があります。
過去100〜150年の間に、トウモロコシ、ヒマワリの種、ベニバナの種、綿実、大豆からの植物油の摂取量が増加したため、オメガ6系不飽和脂肪酸の消費量が大幅に増加しました。
すなわち、食事中の不飽和脂肪酸のオメガ6:オメガ3比は、狩猟採取で食糧を確保していた旧石器時代の人類の食事では1〜2程度でしたが、近代における西洋型食事ではオメガ6:オメガ3比は20程度まで上昇しています。
アメリカ人の食事はω6:ω3の比が10~20になると報告されています。一方、伝統的な日本食(大豆と魚の豊富な食事)ではその比は1~2.8にあると言われています。しかし、日本でも食事の欧米化によってω6:ω3の比が高くなっています。
さらに動物性の飽和脂肪酸の摂取量も増えています。このような食事中の脂肪酸の組成の変化が、がんや心臓病、メタボリック症候群、炎症性疾患、自己免疫疾患の発症を促進していると考えられています。
ω6:ω3の比を1~2以下にするためには、肉類は減らし、野菜はバランス良く摂取し、ω3不飽和脂肪酸の多い青背の魚(いわし・あじ・さば・さんま・まぐろなど)を食べます。野菜にはリノール酸などのω6脂肪酸が多いので、ω3不飽和脂肪酸のα-リノレン酸の豊富なシソ油か亜麻仁油をドレッシングとして使用するのが有効です。DHAやEPAは高熱で酸化しやすいので、魚は揚げ物や焼き魚は避け、生(刺身)か煮付けで食べることが大切です。
魚が苦手な人はDHAやEPAのサプリメントを利用します。極端にω3脂肪酸を多くとると、血液が固まりにくくなるという副作用が出ますが、DHA/EPAのサプリメントを1日2~4グラム程度で、食事の内容を変えてω3不飽和脂肪酸を増やすのであれば、問題はありません。
【不飽和脂肪酸のオメガ6とオメガ3の比率が高いほど死亡率が高くなる】
血液中の不飽和脂肪酸のオメガ6系とオメガ3系の比率が高いほど、死亡率が高くなることが大規模な疫学調査で明らかになっています。以下のような報告があります。
Higher ratio of plasma omega-6/omega-3 fatty acids is associated with greater risk of all-cause, cancer, and cardiovascular mortality: A population-based cohort study in UK Biobank(血漿中のオメガ6/オメガ3脂肪酸の比率が高いほど、全死因死亡、がん死亡、心血管疾患死亡のリスクが高まる:英国バイオバンクの人口ベースのコホート研究) Elife. 2024 Apr 5:12:RP90132.
血液中のオメガ3およびオメガ6の多価不飽和脂肪酸は、様々な慢性疾患の罹患率や死亡率と関連しています。
この報告では、大規模な前向きコホートである英国バイオバンク(UK Biobank)において、血漿中のオメガ3およびオメガ6不飽和脂肪酸の比率と、全死因死亡率および死因別死亡率との関係を調査しました。
UKバイオバンク研究は、英国における前向きな人口ベースのコホート研究です。2006年から2010年の間に、英国全土の22の評価センターで、40~69歳の502,384人の参加者候補が研究のために募集されました。身体情報は、タッチスクリーンによる自己記入式質問票、コンピュータアシスタントによる簡単な面接、身体機能測定、評価訪問時の血液、尿、唾液採取を通じて収集されました。
85,425 人の解析対象者のうち、追跡調査中に 6,461 人が死亡し、そのうち 2,794 人ががん(癌)、1,668 人が心血管疾患で死亡しました。
オメガ 6/オメガ 3 多価不飽和脂肪酸の比率が増加するにつれて、全死因死亡、がん死亡、心血管死亡のすべてのリスクが増加しました。
最高 5 分位と最低 5 分位を比較すると、オメガ 6/オメガ 3 多価不飽和脂肪酸の比率が低い下位5分の1のグループに比べて、オメガ6/オメガ3比率が高い上位5分の1のグループの全死因死亡率は 26% (95% 信頼区間:15-38%)、がん死亡率は14% (95%信頼区間:0-31%)、心血管死亡率は 31% (95%信頼区間:10-55%) 高い結果でした。
つまり、血液中のオメガ6/オメガ3 多価不飽和脂肪酸の比率が高いほど、全死因死亡率、がん死亡率、心血管死亡率が高くなることが明らかになりました。
上記の英国の人口ベースのコホート(UKバイオバンク)を使って、ドコサヘキサエン酸と死亡率の関連を解析した報告があります。
Circulating Docosahexaenoic Acid and Risk of All-Cause and Cause-Specific Mortality(循環ドコサヘキサエン酸と全死因死亡および死因別死亡リスク)Mayo Clin Proc. 2024 Apr;99(4):534-541.
この報告では、2007年4月から2021年12月までの12.7年間の追跡調査でベースラインの血漿ドコサヘキサエン酸(DHA)レベルが測定された117,702人の被験者を含むUKバイオバンクのデータを分析しました。
血中 DHA 濃度の最低5分位と最高5分位を比較すると、血中DHA濃度が高い上位5分の1のグループの全死因死亡率は 21% 低下しました (ハザード比0.79、95% 信頼区間:0.74 ~ 0.85、P<.0001)。
さらに、UK バイオバンクの調査結果と、DHA と死亡率の関連性を調べた 17 件の前向きコホート研究などを統合してメタ分析が行われました。
累積サンプル人口には 160,404 人が含まれており、中央値 14 年の追跡期間中に 24,342 人が死亡しました。 DHA の最低五分位と最高五分位を比較し、関連するリスク因子の多変量調整を行った後、全死因死亡率は 17% 低下し (95% 信頼区間:0.79 ~ 0.87、P<.0001)、心血管疾患による死亡率は 21% 低下し (95%信頼区間:0.73 ~ 0.87、P<.001)、がんによる死亡率は 17% 低下(95%信頼区間:0.77 ~ 0.89、P<.0001)しました。
つまり、DHA レベルが高いと、全死亡率の大幅なリスク低下と、心血管疾患、がん、その他すべての原因による死亡リスクの低下が関連していました。この結果は、海洋由来のオメガ 3 である DHA が心血管の健康と寿命をサポートする可能性があるという仮説を支持しています。
多くの疫学研究で、血中のドコサヘキサエン酸の濃度が高いと認知症のリスクが低下することも明らかになっています。
Circulating polyunsaturated fatty acids, fish oil supplementation, and risk of incident dementia: a prospective cohort study of 440,750 participants(循環多価不飽和脂肪酸、魚油サプリメント、認知症発症リスク:440,750人の参加者を対象とした前向きコホート研究)Geroscience. 2023 Jun;45(3):1997-2009.
UK バイオバンクの認知症のない 440,750 人の参加者を対象に、さまざまな種類の多価不飽和脂肪酸の血漿レベル、魚油サプリメント、および認知症リスクとの関連性を包括的に調査しました。結果を総合すると、血漿多価不飽和脂肪酸レベルが高いことと魚油サプリメントを摂取していることは、認知症の発症リスクが低いことと関連していました。
【ドコサヘキサエン酸はテロメア短縮を抑制する】
「ドコサヘキサエン酸(DHA)の継続的摂取が寿命を延ばす」、「血中のDHA濃度が高いと長生きする」、「DNAはテロメアを延ばす」といった報告が増えています。例えば、以下のような論文があります。
Association of omega-3 and omega-6 fatty acid intake with leukocyte telomere length in US males.(米国男性におけるオメガ3およびオメガ6脂肪酸摂取と白血球テロメア長との関連)Am J Clin Nutr. 2022 Dec 19;116(6):1759-1766.
この論文では、DHA の摂取量が多く、マグロの缶詰の消費量が多いほど、白血球テロメア長が長くなることを示しています。
白血球テロメア長は、オメガ3(n-3)不飽和脂肪酸やオメガ6(n-6)の総摂取量では無く、ドコサヘキサエン酸(DHA)の摂取量が多いほど長いという結果です。テロメアが長いほど、残された寿命が長いと一般に考えられていますので、DHAの摂取あるいはDHAを多く含むマグロの缶詰の摂取量が多いと、長生きするという結果です。以下のような報告もあります。
Effect of plasma polyunsaturated fatty acid levels on leukocyte telomere lengths in the Singaporean Chinese population.(シンガポールの中国人集団における白血球テロメア長に対する血漿多価不飽和脂肪酸レベルの影響)Nutr J. 2020 Oct 30;19(1):119.
シンガポールの中国人を対象としたこの前向きケースコントロール研究です。血漿オメガ6:オメガ3比と白血球テロメア長および 冠動脈疾患リスクとの逆相関が観察されました。この関連は、オメガ6不飽和脂肪酸ではなく、オメガ3不飽和脂肪酸の摂取量の増加によって引き起こされました。特定の n-3不飽和脂肪酸と白血球テロメア長との関連性を調べると、EPA と DHA の両方の血漿レベルが高いほど、白血球テロメア長が長くなり、冠動脈疾患リスクが低下することがわかりました。
油に多く含まれるオメガ3系多価不飽和脂肪酸のドコサヘキサエン酸(DHA)やエイコサペンタエン酸(EPA)がテロメアの短縮を抑制して寿命を延ばす効果は多数報告されています。以下のような報告もあります。
Telomere shortening in elderly individuals with mild cognitive impairment may be attenuated with ω-3 fatty acid supplementation: a randomized controlled pilot study(軽度認知障害のある高齢者のテロメア短縮は、オメガ3脂肪酸の補給で軽減される可能性がある:ランダム化比較試験)Nutrition. 2014 Apr;30(4):489-91.
エイコサペンタエン酸(EPA)やドコサヘキサエン酸(DHA)を1日2g程度摂取すると、テロメアの長さが延長することはありませんが、加齢に伴うテロメアの短縮を抑制する効果が認められたという臨床試験の結果です。
テロメアの短縮と心血管系の罹患率および死亡率との強い関連性がいくつかの集団で報告されています。以下のような報告があります。
Association of Marine Omega-3 Fatty Acid Levels With Telomeric Aging in Patients With Coronary Heart Disease(冠状動脈性心臓病患者における海洋オメガ3脂肪酸レベルとテロメア老化との関連)JAMA. 2010 Jan 20; 303(3): 250.
この研究では、オメガ3脂肪酸の血中濃度と、生物学的年齢のマーカーであるテロメア長の時間的変化との関連を調査しています。
2000年9月から2002年12月までに募集され、2009年1月まで追跡された安定した冠状動脈疾患を有する608人の外来患者の前向きコホート研究(追跡期間中央値は6.0年;範囲5〜8.1年)です。患者はカリフォルニア州サンフランシスコのベイエリアの外来クリニックから募集されました。
追跡開始時と5年間のフォローアップ後に白血球テロメアの長さを測定しました。追跡開始時のオメガ3脂肪酸(ドコサヘキサエン酸およびエイコサペンタエン酸)の血中濃度と5年間のテロメア長の変化との関連を調査しています。
中央値6年の追跡期間中に、276人の参加者(45%)がテロメア長の10%を超える減少を示しました。そして、追跡開始時のDHAとEPAの血中濃度が高いほど、テロメアの短縮率が低下することが明らかになりました。
白血球テロメアの長さは、心血管疾患の患者の罹患率と死亡率を独立して予測する生物学的年齢のマーカーとして知られています。この研究では、海洋オメガ3脂肪酸(DHAとEPA)のベースラインレベルが、5年間にわたるテロメアの減少と関連していることを示しています。
つまり、オメガ-3脂肪酸が冠状動脈性心臓病の患者の細胞老化を防ぎ、死亡率を低下させる可能性を示唆しています。
オメガ3脂肪酸は抗炎症作用や抗酸化作用があり、全身の酸化ストレスを軽減することによってテロメア短縮を抑制する可能性が指摘されています。
さらに、テロメラーゼ活性を高める作用も指摘されています。最近まで、テロメラーゼの発現は生殖細胞、幹細胞、およびがん細胞に限定されると考えられていました。しかし、現在、末梢血単核細胞で低レベルのテロメラーゼ活性が実証されています。1日3gのオメガ3魚油の補給を含む包括的なライフスタイルの変更の採用は、正常な成人の白血球におけるテロメラーゼ活性の有意な増加と関連することが報告されています。
対照的に、培養した結腸直腸がん細胞を使った実験では、EPAとDHAはテロメラーゼ活性を抑制し、テロメラーゼレベルを低下させました。(Biochim Biophys Acta. 2005 Oct 15;1737(1):1-10.)
つまり、オメガ3脂肪酸は、細胞の状況に応じてテロメラーゼに双方向の影響を与える可能性があると推測されます。がん細胞ではテロメラーゼ活性を抑制して増殖を抑制し、正常組織ではテロメラーゼ活性を高めて寿命を延ばす可能性があります。
したがって、DHAとEPAはテロメアの老化を標的とする抗老化療法において、非常に有用な栄養成分と言えます。1日2gから5g程度のDHAやEPAを摂取して、血中のDHA/EPA濃度を高めることは寿命を延ばす効果が期待できます。がん治療にも有効です。
人間の死亡率は100%です(他の生き物も同じです)。いずれ何らかの原因(病気や老衰や事故など)で必ず死にます。「ドコサヘキサエン酸(DHA)が死亡率を減らす」というのは、「ある一定期間の死亡確率が低下する」ということです。
血清中のDHA濃度が高い上位5分の1のグループの人は、DHA濃度が低い下位5分の1に比べて、死亡確率が20%くらい低くなることが示されています。これは、60歳の人の集団で、DHA摂取が少ないグループの余命が20年とすると、DHAの摂取が多いグループではそれが4〜5年程度延びるというレベルの差になります。
日頃から、1日にDHAを2gから5g程度摂取することは認知症を予防し、健康寿命を延ばす効果が期待できます。
