
91)糖質制限は老化細胞を除去して、がん細胞の発生を抑制する
体がみるみる若返るミトコンドリア活性化術91
ミトコンドリアを活性化して体を若返らせる医薬品やサプリメントを解説しています。
【加齢とともに体内に老化細胞が増えていく】
私たちの体は正常な機能を維持するために、多数の細胞がお互いに制御しあっています。
このような正常な細胞の集まりの中で、加齢とともに異常な細胞が出現してきます。一つはがん細胞で、もう一つは老化細胞です。
がん細胞は、増殖と細胞死の正常な制御ができなくなって、正常細胞や正常組織を侵略するように数を増やしていきます。がん細胞が多く増えると、正常組織が破壊され、宿主は死亡します。
老化細胞は、増殖を停止した細胞です。一見、周りの正常細胞や組織に悪影響を与えないかのように思われますが、実際は、老化細胞が組織に蓄積すると、様々な悪影響を及ぼすのです。すなわち、老化細胞はサイトカイン、成長因子、ケモカイン、プロテアーゼなどの多くの成分を分泌しています。これらの因子は老化関連分泌表現型(senescence-associated secretory phenotype :SASP)と呼ばれ、老化細胞の周囲の組織に炎症や機能障害を引き起こす可能性があります。つまり、老化細胞が蓄積すると老化関連分泌表現型(SASP)の産生によって、その組織の機能が障害されるのです。

図:加齢とともに、正常組織の中にがん細胞と老化細胞が出現する。がん細胞は増殖して正常細胞や組織を破壊する。老化細胞は増殖を停止しているが、老化関連分泌表現型(senescence-associated secretory phenotype :SASP)と呼ばれる様々な因子(サイトカイン、成長因子、ケモカイン、プロテアーゼなど)を産生して、周りの正常細胞や組織の機能を障害する。
【老化細胞の蓄積を阻止するとがん細胞の発生を抑制できる】
遺伝子が損傷した細胞の異常増殖を避けるために、様々な細胞障害に応答して永久的な細胞増殖停止を引き起こすメカニズムが細胞内に発達したと考えられています。これが細胞老化という現象です。細胞老化はがん細胞の発生を阻止するためのメカニズムと理解されています。
細胞老化が抗腫瘍メカニズムとして作用するにもかかわらず、老化細胞が腫瘍形成の素因となり、促進する可能性があるという説得力のある証拠があります。
老化細胞自体は増殖能力を失っているため、がん細胞に変化することはありませんが、それらに隣接する細胞が危険にさらされる可能性があります。これは、老化細胞が老化関連分泌表現型 (SASP) として知られる炎症誘発性の細胞間シグナル伝達に関与する多数の因子の合成および放出を増加するからです。これらの因子の中には、腫瘍形成を促進できるさまざまな炎症性分子と細胞外小胞があります。
老化した繊維芽細胞からの SASP は、がん細胞の発生や増殖や腫瘍形成を促進することが示されています。
このように、老化細胞を選択的に排除する薬物、あるいはSASPを標的とする薬剤の開発が注目されています。
老化細胞を選択的に排除する薬物をsenolytic drugと言います。「seno=老化」と 「lytic = 溶解」を組み合わせた用語です。「老化細胞除去薬」という意味です。
老化細胞除去作用のある天然物としてフィセチンとケルセチンが注目されています。
フィセチンは、イチゴ、キュウリ、リンゴ、ブドウ、玉ねぎなどの果物や野菜に含まれる生理活性フラボノール分子です。フィセチンが細胞の老化を抑制することやマウスの寿命を延ばすことが報告されています。
フィセチンは、PI3K / mTOR経路を含む複数のシグナル伝達キナーゼを阻害し、抗がん剤としても注目されています。
ケルセチン(quercetin)はフラボノイドの一種で、配当体(ルチン、クエルシトリンなど)または遊離した形で柑橘類、タマネギ、そばをはじめ多くの植物に含まれるフラボノイドの一種です。ケルセチンは複数のキナーゼを阻害します。
老化細胞のアポトーシスを抑制している遺伝子をターゲットにして、アポトーシスを誘導して老化細胞を除去しようという方法です。
老化関連分泌表現型 (SASP) の作用を抑制する薬をSenomorphic drug(老化細胞阻害薬)と言います。mTOR阻害薬のラパマイシン(Rapamycin)、AMPK賦活剤のメトホルミン(Metformin)、JAK阻害剤のルキソリチニブ(Ruxolitinib)などが有用視されています。
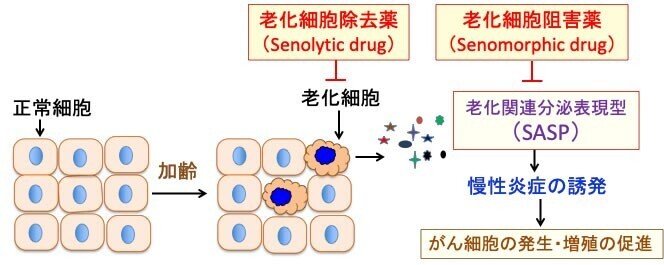
図:加齢とともに、正常組織の中に老化細胞が出現する。老化細胞は老化関連分泌表現型(senescence-associated secretory phenotype :SASP)と呼ばれる様々な因子(サイトカイン、成長因子、ケモカイン、プロテアーゼなど)を産生して、周りの正常細胞や組織 に慢性炎症を誘発し、がん細胞の発生や増殖を促進する。老化細胞を除去する老化細胞除去薬(Senolytic drug)や老化細胞阻害薬(Senomorphic drug)はSASPの産生を阻害してがん細胞の発生と増殖を抑制する。
【p16INK4aは細胞老化のマーカー】
体の組織は組織幹細胞が細胞分裂によって細胞を補うことによって正常に維持されますが、加齢とともに組織幹細胞も老化によって次第に再性能(細胞分裂能)を失い、やがて死滅し、数が減っていきます。その結果、組織の細胞量が減少し機能が低下していきます。
この老化の速度は個人差があり、遺伝的要因や生活要因や環境要因によっても影響をうけます。
老化の程度や速度を評価するには「老化のマーカー」が必要です。これは、老化に伴って細胞内量が増えるか減るような(細胞の老化の程度と相関するような)細胞内物質が候補になります。
生化学的なマーカーとしては細胞老化関連ベータ・ガラクトシダーゼ(senescence-associated β-galactosidase)があります。老化した細胞はこの酵素の活性が高くなっており、X-galを使って老化細胞を染色することができます。
senescence(細胞老化)というのは、増殖促進刺激に対して応答しなくなり、安定的に細胞周期が停止した状態の細胞です。細胞分裂できなくなった細胞です。
老化の分子マーカーとしてよく使われているのがp16INK4aというタンパク質です。P16INK4aは細胞の老化にともなって指数関数的に増加することが知られています。
細胞内のp16INK4aの量は16.7年で2倍になるという報告があり、この倍加時間で倍々になっていきます。つまり、細胞内のp16INK4aの発現量が多いほど、その細胞は老化していると評価されています。
p16INK4aタンパク質はサイクリン依存性期キナーゼ(cyclin dependent kinase: CDK)4と6(CDK4とCDK6)に結合する分子量が約16000ダルトン(16kDa)のタンパク質です。
p16INK4aはCDK4とCDK6に結合することによって、CDK4とCDK6がサイクリンD(cyclin D1, D2, D3)と結合することを阻害します。
CDK4とCDK6は細胞が分裂をスタートするときに必須の働きを行うので、このサイクリン依存性期キナーゼ(CDK4/6)が阻害されると細胞は分裂できません。
細胞が分裂して数を増やしていくとき、細胞周期は4 つの段階に分けられます。すなわち、DNA複製前のG1(Gap1) 期、DNA複製期(S期)、細胞分裂前のG2(Gap2)期、および最後の細胞分裂期(M) 期に分けられます。増殖を休止した状態の細胞はG0期にあると定義されます。
がん抑制遺伝子のRBタンパク質はE2Fに結合してE2Fの転写活性を阻害しています。細胞周期がG1期からS期に移行するとき、RBタンパク質がサイクリン依存性キナーゼ(CDK)でリン酸化されます。RBタンパク質がリン酸化されると転写因子のE2Fと結合できなくなり、フリーになったE2Fは増殖に関連する遺伝子の発現を促進して細胞周期を回します。
サイクリン依存性キナーゼ(CDK)はサイクリン依存性キナーゼ阻害因子というタンパク質によって機能が阻害されます。このサイクリン依存性キナーゼ阻害因子にはp16INK4a やp21Waf1/Cip1/Sdi1などのタンパク質が知られています。
(下図)

図:G1期にRBタンパクはE2Fという転写因子に結合して、E2Fの活性を抑えている(①)。E2Fは転写因子で細胞の増殖にとって重要な多くの遺伝子の発現を亢進する(②)。したがって、RBが結合してE2Fの活性を抑えていると、細胞は増殖サイクルに入れない。しかし、サイクリン依存性キナーゼ(Cdk4あるいはCdk6)とサイクリンDの複合体によってRBがリン酸化されると(③)、RBタンパクはE2Fから解離し、E2Fが活性な転写因子となって増殖関連遺伝子の発現を引き起こす(④)。その結果、細胞はDNA複製を開始して増殖サイクルを回し出す(⑤)。p16INK4aはサイクリン依存性キナーゼのCdk4とCdk6と結合することによって阻害する(⑥)。Cdk4/6の活性が阻害されると、RBはリン酸化されないので、細胞周期はストップした状態に維持される(⑦)。老化した細胞(分裂能を喪失した細胞)ではp16INK4aの発現量が増えており、p16INK4aは細胞の老化のマーカーとして知られている。
細胞の老化(senescence)というのは、細胞が不可逆的に分裂を停止する(細胞分裂能を喪失する)事です。細胞にダメージが蓄積して老化してくると、サイクリン依存性キナーゼ阻害因子のp16INK4aの発現量が増えてきて、細胞周期が回らないようにすると考えられます。したがって、老化した細胞ほどp16INK4aの発現量が増えており、細胞老化のマーカーとなるのです。
p16INK4aを発現する細胞を任意のタイミングで選択的に除去できる遺伝子改変マウスを用いた実験で、老化細胞(p16INK4aを多く発現する細胞)の除去によって老化の進行を抑制できることが示されています(Nature. 2011 Nov 2;479(7372):232-6.)
【糖質制限は正常細胞のp16INK4αの発現を抑制して老化速度を遅くする】
p16INK4αが増えた細胞は老化した細胞で、このタンパク質の量があるレベルを超えると細胞分裂能を喪失すると考えられます。したがって、細胞内のp16INK4αの発現量は「細胞の老化の程度」と評価するマーカーになります。一方、p16INK4αの遺伝子発現の抑制は細胞の寿命を伸ばすことにつながります。以下のような論文があります。
p16(INK4a) suppression by glucose restriction contributes to human cellular lifespan extension through SIRT1-mediated epigenetic and genetic mechanisms.(グルコース制限によるp16INK4a遺伝子発現の抑制は、SIRT1-介在性のエピジェネティックあるいはジェネティックなメカニズムでヒト細胞の寿命延長に貢献する)PLoS One. 2011 Feb 24;6(2):e17421. doi: 10.1371/journal.pone.0017421.
【要旨】
カロリー制限が様々な動物において寿命を延長することが確認されているが、そのメカニズムについては十分に解明されていない。
培養液中のグルコースの濃度を減らすことによってカロリー制限と類似の状況を作り出す培養細胞の実験モデルを使って、細胞分子レベルでカロリー制限(グルコース制限)の作用メカニズムを検討した。
正常のヒト肺線維芽細胞(WI-38, IMR-90, MRC-5)においては、正常のグルコース濃度で培養した細胞と比べて、グルコースの量を減らした(グルコース制限)培養液で培養した細胞では、老化速度が抑制され、細胞の寿命が顕著に延長した。
さらに、検討した全ての細胞株において、グルコース制限は老化関連遺伝子として知られているp16INK4aの発現量を減少させた。
グルコース制限を行っている細胞(老化が抑制されている細胞)にp16遺伝子を過剰発現させると、細胞分裂が早期に停止し細胞老化が促進された。この結果は、グルコース制限による細胞寿命の延長にp16が重要な役割を担っていることを示している。
p16の発現抑制は、グルコース制限によってヒストン・アセチル化によるクロマチン再構成とp16遺伝子のプロモーター領域のメチル化が関与していた。
グルコース制限はNAD依存性のヒストン・脱アセチル化酵素であるSIRT1(サーチュイン1)の発現を増やした。SIRT1はカロリー制限による寿命延長と関連していることが知られている。
SIRT1の発現亢進はAkt/p70S6K1シグナル伝達系の活性を促進する。SIRT1遺伝子を欠損させた細胞では、グルコース制限によるp16発現の抑制とAkt/p70S6K1シグナル伝達系の活性化は起こらなかった。
これらの結果は、SIRT1はヒストンの脱アセチル化による直接作用とAkt/p70S6K1シグナル伝達系を介する間接的な作用によってp16遺伝子の発現を抑制することを示唆している。
複雑なメカニズムですが、簡単にまとめると「正常細胞に対してグルコース制限はp16INK4aの発現を抑制して、細胞の老化を遅らせる」ということです。そのメカニズムとしてSIRT1やヒストンアセチル化などが関与しているという話です。
【糖質制限はがん細胞のp16INK4αの発現を亢進して増殖を抑制する】
前述のように老化のマーカーであるp16INK4aを指標にした研究で糖質制限が正常細胞のp16INK4aの発現量を減少させて老化速度を遅くするという報告があります。
さらに、グルコース制限はがん細胞に対しては、正常細胞とは逆の応答をするという報告があります。以下のような論文があります。
Glucose restriction can extend normal cell lifespan and impair precancerous cell growth through epigenetic control of hTERT and p16 expression.(糖質制限はhTERT遺伝子とp16遺伝子の発現をエピジェネシスによる制御を介して正常細胞の寿命を延ばし、前がん細胞の増殖を抑制する)FASEB J. 24(5): 1442-1453, 2010年
【要旨】
がん細胞はグルコースの取込みと代謝が亢進しており、そのためグルコースの制限に対して正常細胞に比べて増殖や生存に対する影響が大きい。しかしながら、正常細胞とがん細胞のグルコース制限に対する影響の違いに関する分子メカニズムは十分に解明されていない。
正常な胎児肺線維芽細胞WI-38と、WI-38にがん遺伝子を導入して不死化したWI-38/S細胞を用いてグルコース制限に対する影響を検討した。その結果、不死化したWI-38/Sではグルコース制限によって増殖阻害とアポトーシスの誘導が認められたが、正常細胞のWI-38ではグルコース制限は寿命を延ばした。
さらに、WI-38/S細胞では、グルコース制限によってhTERT(human telomerase reverse transcriptase; ヒト・テロメラーゼ逆転写酵素)の発現が減少し、がん抑制遺伝子のp16INK4aの発現が増加した。
正常細胞のWI-38細胞では、hTERT遺伝子とp16遺伝子の発現に対するグルコース制限による影響は逆であった。(WI-38細胞では、グルコース制限でhTERT遺伝子の発現は増加し、p16INK4a遺伝子の発現や減少した)
このようなWI-38とWI-38/S細胞の遺伝子発現の違いは、hTERT遺伝子とp16遺伝子のプロモーター領域におけるDNAのメチル化やクロマチン再構成(chromatin remodeling)におけるグルコース制限による変化がWI-38とWI-38/Sとで異なることが関与していると思われた。
さらに、グルコース制限によるhTERT遺伝子とp16遺伝子の発現量の変化はWI-38の方がWI-38/S細胞より明らかであり、これはエネルギー低下によるストレスで誘導される遺伝子のエピジェネシスによる制御が正常細胞と前がん細胞で異なっていることを示唆している。
以上の結果から、食事による遺伝子のエピジェネシスによる制御が、がんの治療法と抗老化の手段となりうることを示している。
真核生物の染色体には端っこにテロメアと呼ばれる配列があり、細胞が分裂するたびにこのテロメアが減っていきます。このテロメアがある程度短くなると細胞は分裂できなくなります。つまり細胞分裂能の喪失(=老化)ということになります。
短くなったテロメアをもう一度伸ばしてくれる酵素が「テロメラーゼ」でこのタンパク質をコードしている遺伝子がhTERT遺伝子です。hTERT遺伝子の発現が増加するというのは、細胞の分裂する回数を増やすことができます。
普通の正常細胞ではテロメラーゼはほとんど発現していないため、細胞分裂の回数に限界があります。
一方、多くのがん細胞では、テロメラーゼが発現し、活性が亢進しています。その結果、無限に増殖できることになります。

図:染色体DNAの末端部分にはTTAGGGという配列が多数繰り返されたテロメアという構造が存在する(①)。正常細胞では細胞分裂のたびにテロメアが短縮し(②)、その短縮が限界に達するとDNAの複製ができなくなり、細胞はもはや分裂することが出来ず、細胞死を引き起こす(③)。多くのがん細胞ではテロメラーゼの発現と活性が亢進しておりテロメアを再生できる(④)。その結果、がん細胞は無限の細胞分裂能(不死化)を獲得している(⑤)。
この論文の結果では、がん細胞ではグルコース制限によってhTERTの発現が減少し、がん抑制遺伝子のp16INK4aの発現が増加し(=細胞が老化の方向に向かう変化)、正常細胞では逆に、グルコース制限でhTERT遺伝子の発現は増加し、p16INK4a遺伝子の発現が減少しました(=細胞が老化を抑える変化)。
培養細胞での検討ですが、糖質制限はがん細胞の老化を促進し、正常細胞の老化を抑制する可能性を示しています。
正常細胞の培養液にグルコースの量を増やすと老化が促進されることが報告されています。逆にがん細胞の場合は、グルコールの取込みと利用が亢進しているので、グルコースの量を増やすとがん細胞の増殖が促進されます。
つまり、正常細胞とがん細胞では、グルコース濃度に対する対応が全く異なります。
生体でも、高血糖はがん細胞の増殖を促進し、正常細胞の老化を促進します。したがって、糖質制限はがん細胞の増殖を抑制し、正常細胞の老化を抑制することになります。
がんの治療や再発予防やがんサバイバーにおける長期的な副作用(老化促進や2次がんなど)の予防に糖質制限が役立つことを示唆する研究結果だと思います。
この記事が気に入ったらサポートをしてみませんか?
