
85)がんと寿命のトレードオフ: がんになりにくい人は寿命が短い?
体がみるみる若返るミトコンドリア活性化術85
ミトコンドリアを活性化して体を若返らせる医薬品やサプリメントを解説しています。
【がんと老化のリスク要因は共通するものが多い】
加齢はがん発生と体の老化(様々な生理機能の低下)の最も大きな発症要因です。
組織幹細胞の遺伝子変異は加齢とともに蓄積していくので、老化に伴ってがん細胞の発生が増えます。神経細胞も、虚血や酸化ストレスなどによってダメージを受けた神経細胞が少しづつ脱落していくので、歳を取るほど神経細胞の数が減っていき、認知症が増えてきます。心臓や腎臓や筋肉も加齢とともに機能が低下します。
がんと老化を促進する原因として加齢以外にも共通の要因が多数あります。遺伝子(DNA)や細胞にダメージを与える要因、例えば、酸化ストレスや慢性炎症を引き起こすような要因はがんも老化も促進することになります。高糖質食、肥満、糖尿病、メタボリック症候群、喫煙、酸化障害、慢性炎症などはがんと老化を促進します。
したがって、これらを防げば、がんと体の老化を同時に予防できます。これが、適切な食生活や運動や禁煙などががんの発症と老化の促進を抑制できる根拠です。(下図)
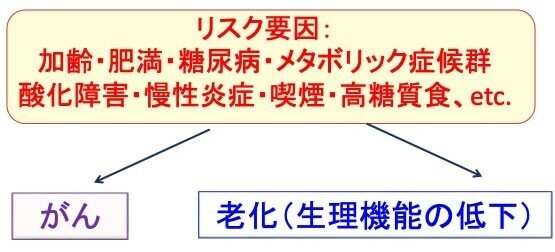
図:加齢はがんと老化(様々な生理機能の低下)の最大のリスク要因であるが、さらに肥満・糖尿病・メタボリック症候群・酸化障害・慢性炎症・喫煙・高糖質食などもがん発症と老化を促進する。これらのリスク要因を減らせば、がんと老化の両方の予防に効果がある。
例えば、糖尿病やメタボリック症候群や慢性炎症の改善効果がある地中海食は、がんとアルツハイマー病の両方を予防する効果が報告されています。地中海食は新鮮な野菜や果物や魚介類が豊富で、オリーブオイルを多く使う料理でがんやアルツハイマー病だけでなく心臓病の発生率を減らす効果も報告されています。
糖質制限食やケトン食ががんと老化性疾患の両方の予防と治療に有効であることも知られています。適度の運動もがんと老化の進行を抑制します。つまり、がんと老化の発症リスクがかなり共通しているので、がんを予防することは他の老化性疾患の予防にもつながると言えます。
【がんと寿命のトレードオフ】
トレードオフ(trade-off)とは、一方を追求すれば他方を犠牲にせざるを得ないという状態・関係のことです。
前述のように、がんと老化のリスク要因は共通点が多いので、「がんになりにくい人は老化の進行も遅く寿命が長い」という関係が成り立つように予測できます。しかし生物学的には逆のようです。「がんになりにくい」という体質や遺伝的素因を獲得した人は、「寿命」や「アルツハイマー病に対する抵抗性」を犠牲にせざるを得ない、というような研究結果が多数報告されています。
生命現象におけるトレードオフの関係では「寿命と生殖活動の関係」が有名です。すなわち、「生殖は寿命を切り詰める」ということは多くの証拠によって示されています。
カロリー制限や去勢や遺伝子改変によって生殖活動を弱めると寿命が延びます。繁殖能の高いマウスは短命で、成熟のプロセスがゆっくりで繁殖率が低い動物(ゾウや人間など)は寿命が長いのも「生殖と寿命のトレードオフ」の1例だと考えられています。
繁殖能の高い生物は、親が早く死ぬ(寿命が短い)方が種の保存と繁栄に有利になるからです。
がんと寿命の間にもトレードオフの関係があることが指摘されています。これは「がんにかかりにくい体質を持っていると寿命が短くなる」、つまり「がんにかかりにくい体質を得るためには寿命が短くなるという犠牲が必要」という関係です。
がん細胞は細胞増殖が亢進しアポトーシス(細胞死)が起こりにくくなった細胞です。一方、老化は細胞の増殖活性が低下し細胞が死にやすい(アポトーシスが起こりやすい)と促進されます。したがって、体内の細胞の増殖活性が低下しアポトーシスが起こりやすいと、がんの発生を防ぐ効果がありますが、老化を促進することになります。
細胞に寿命があるのはがん細胞の発生を防ぐ目的があるという考えもあります。細胞ががん細胞になるのを防ぐために、細胞は自ら死ぬアポトーシスのメカニズムを持ち、寿命があるという考えです。
【寿命はプログラムされている】
一般的に、多細胞生物では寿命がプログラムされています。例えば、1年草は花をつけて実がなると直ぐに枯れます。ほとんどの昆虫類は産卵すると一生を終えます。魚のサケは排卵後にある種のホルモンを分泌して死ぬようにプログラムされています。
哺乳類や鳥類の場合は、子供を産んでもすぐ死なずに子育ての期間を生きますが、子育ての期間を終了するころには死を迎えるようになっています。成長に必要な内分泌系や免疫システムも、子育てが終わる頃、あるいは生殖能力を失うころ(更年期)には、体を壊す方法に作用しだします。
たとえば、性成熟に必要な女性ホルモンや男性ホルモンは乳がんや前立腺がんの発生や進展を促進し、体の発育に必要な様々な成長因子や増殖因子はがん細胞の増殖に加担します。免疫細胞は病原菌やがん細胞から体を守るのが本来の役割ですが、その制御に異常が起こって自己の細胞を攻撃して自己免疫疾患を引き起こし、体を壊す方向に動き出します。
細胞には分裂の回数に限界を設けるテロメアが存在し、酸素呼吸をすることにより発生する活性酸素が遺伝子や脂質やタンパク質を酸化し、がんや動脈硬化の原因となります。活性酸素による組織のダメージは加齢とともに蓄積していきます。
したがって、加齢とともに老化が進み、諸臓器の機能が徐々に低下し、がんや心臓病などの病気に罹らなくても、多くは90~100歳で老衰によって亡くなる運命にあります。
【死なない生物はいずれ絶滅する】
生物に寿命があるのは、固体が無制限に増えると食糧の確保などで生存が困難になることや、変化する環境に適するように種を進化させて繁栄させるためには、子孫(新しい種)を残したら親(古い種)は消滅させた方が有利だからです。
食糧の枯渇や飢餓など生存に厳しい状況において、個々の細胞や個体が他の細胞や個体のために利他的に死ぬことができる集団は、全ての細胞や個体が利己的に生きる集団よりも進化の過程でのメリットがあります。
例えば、酵母を使った実験で、プログラム細胞死が働く通常の酵母(利他的なグループ)と、プログラム細胞死が起こらなくした酵母(利己的なグループ)を培養するとどうなるかという実験があります。プログラム細胞死が起こらない利己的グループは個体数を増やす速度が早いので、種の繁栄に有利ですが、そのうち、過剰に増殖するとスペースも食糧も無くなって、生存と繁栄ができなくなります。
集団から老化した個体が排除される(=死ぬ)ことは、若い世代や適応した世代を生き残らせる効果があります。医学が発達する前は、ヒトは生殖年齢を終えると歯が弱り視力が低下して、次第に生活が困難になって早めに死を迎えます。しかし、医学の進歩によって生殖年齢を超え、子育てを終えても、さらに30年以上も生存することが可能になっています。これは死を恐れる脳が医療を発達させているためです。
寿命が延びることは、人類の種としての繁栄にはマイナスに作用することになります。これは、現代の先進国における少子高齢化の進行による人口減少の実例からも明らかです。
総務省発表の人口推計によれば、2021年10月1日時点の日本の総人口は1億2550万人で、前年より64万人減少しています。日本の総人口は2008年の1億2808万人をピークに減少しており、減少ペースは年々加速しています。
人口が高齢化すると、若年者の負担が増え、出産率が低下するのは、生物学的には当然の結果と言えます。種の繁栄にマイナスになることを理解しても、人類(正確には「脳」)は寿命を延ばすことを熱心に研究しています。
【細胞分裂に限界があるから老化は避けられない】
老化という現象が起こる理由には、幾つかの説があります。一つは「老化はプログラムされている」という説です。私達の体の中では毎日約200分の1の細胞がアポトーシス(プログラム細胞死)で死んで、残った細胞が分裂して補っています。新しい細胞に交代することによって組織や臓器の若返りを行なっているのです。
細胞にはキズを修復する機能があるのですが、時間が経つとつぎはぎだらけの古い(老化した)細胞になって機能が落ちます。ある程度古くなると自分で細胞死のスイッチをいれて自殺(自滅)し、新しく生まれた若い細胞にまかせた方が組織全体の機能を良い状態に維持する上では都合がよいので、アポトーシスの仕組みが生物の進化の過程で発達したようです。「細胞交代型の若返り」といえます。
しかし、体の正常な細胞は分裂できる回数に限りがあります。1960年代にアメリカの生物学者ヘイフリックは、培養した正常の細胞には寿命があることを発見しました。人間の胎児から取り出した線維芽細胞を培養すると次第に分裂の速度が落ちて、約50回の分裂回数が限界で、いくら栄養物質や増殖を促進する物質を加えても分裂することはできずに最後は死んでしまいます。
一方、おとなの人間から取り出した線維芽細胞の分裂できる回数はその年齢に応じて減少していることも明らかになっています。すなわち、細胞の中には細胞の分裂した回数をきちんと数える装置があって、ある回数を過ぎると細胞は死を向かえるプログラムが働き出すのです。

図:ヘイフリックの実験。赤ん坊や成人や老人の皮膚から線維芽細胞を採取してシャーレで培養すると、年齢が若い個体から採取した細胞ほど多く分裂できる。赤ん坊の細胞の方が老人より多く分裂できるが、赤ん坊の細胞もやがて細胞分裂を停止して死滅する。細胞の分裂回数はヒトの場合は約50回が限界で、これ以上は分裂できない。これをヘイフリック限界という。
細胞の分裂回数を記録する機構として、テロメアという染色体の末端にある特殊な構造が重要な働きを担っています。染色体とは細胞が分裂するときに核の中にみられる棒状や糸状の構造体で、DNAとタンパク質からできています。DNAにはA,G,C,Tという4種類の成分が並んでいてタンパク質を作り出す情報が書き込まれています。DNAは遺伝物質の本体であり、細胞が機能するための命令を出す指令塔のようなものです。細胞が分裂する前には、DNAのコピー(複製)が作られて子の細胞に同じものが渡されます。その染色体DNAの末端部分にはTTAGGGという配列が多数繰り返された構造がみつかりテロメアと名付けられました。
細胞が分裂するとき、つまりDNAが複製されるとき末端の部分はちゃんと複製されないので、分裂のたびにテロメアが失われることが明らかになりました。テロメアの長さには限りがあるのでやがて使い尽くされると、細胞老化のシグナルが発動してしまいます。
テロメアとは回数券のようなものであり、分裂する度に回数券を一枚づつちぎって使い、やがて使い切ってしまうと細胞の寿命がくるというわけです。体の新陳代謝のためには細胞の若返りが必要ですが、それが次第にできなくなることが老化の原因となるのです。(下図)
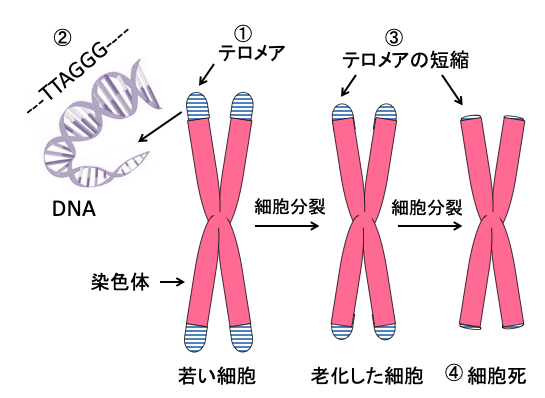
図:染色体の末端にはテロメアという構造があり(①)、この部分のDNAはTTAGGGという配列が多数繰り返されている(②)。細胞分裂するたびに、このテロメア部分のDNAは短くなり(③)、テロメアが無くなった時点で、細胞はそれ以上に分裂することができなくなり、細胞は死滅する(④)。
生殖細胞や幹細胞(骨髄細胞や消化管粘膜上皮細胞のように細胞回転が早い細胞を供給している細胞)やがん細胞のように無限に分裂できる細胞もありますが、これはテロメアを延ばすことができるテロメラーゼという酵素が働いて、テロメアの長さを維持しているからです。普通の細胞にはテロメラーゼ活性はほとんどありません。
テロメラーゼの活性が高いと細胞の老化を防げますが、がん細胞の発生を促進することになります。抗老化(アンチエイジング)の研究領域ではテロメラーゼ活性を高める薬を開発しており、反対にがん治療の研究領域ではテロメラーゼ活性を阻害する薬を探索しています。

図:染色体の末端のテロメア(①)は細胞分裂するたびに短縮する(②)。テロメアがなくなると、細胞は分裂を停止し、細胞死が起こる(③)。テロメアの長さを維持するテロメラーゼの活性を亢進すると(④)、細胞を不死化できる(⑤)。テロメラーゼの活性を高めることは、寿命を延長できるが、がん発生を促進する(⑥)。このように、寿命とがん発生はトレードオフの関係にある。
【テロメアが長い人は寿命が長いががんになりやすい】
ヒトは他のほとんどの哺乳動物種と比較してテロメアの長さが短く、体細胞組織におけるテロメラーゼの活性が低いことが知られています。
白血球のテロメアの長さは個人差があり、遺伝性があります。性別 (女性は男性より白血球のテロメアが長い) 、人種 (アフリカ系アメリカ人やサハラ以南のアフリカ人はヨーロッパ系の個人よりもテロメアが長い)、受胎時の父親の年齢(年長の父親の子孫は、若い父親の子孫よりもテロメアが長い) など多くの要因が白血球テロメア長に影響します。また、社会経済的地位を含む環境要因、喫煙、座りっぱなしのライフスタイル、過剰栄養、精神的ストレスなどもテロメア短縮に影響することが報告されています。
テロメアの長さが長いほど寿命が長くなることが知られています。さらに、テロメアが長いほど、発がんのリスクが高くなることも報告されています。つまり、生物学的には、がん発生と寿命の間にはトレードオフの関係があり、その理由の一つがテロメアの長さやテロメラーゼ活性です。
がんと寿命のトレードオフは、古くなった個体を様々なメカニズムで集団から排除したいと考えている遺伝子の企みと言えます。脳は遺伝子のこの企みを阻止する方法を研究しています。
【がんと寿命のトレードオフを解消する方法】
生物学的には「がんと寿命」の間にトレードオフの関係があります。がんになりにくい人は寿命が短いという関係です。しかし、人為的介入によってこのトレードオフの関係を解消し、がんの発生を予防し、寿命を延ばすことは可能です。
最初に述べたように、がん発生と老化の両方を促進する要因(肥満、糖尿病、メタボリック症候群、高糖質食、喫煙、酸化障害、慢性炎症など)を減らせば良いことになります。
カロリー制限が寿命を延ばし、がんの発症を減らすことが明らかになっています。カロリー制限は栄養障害を起こさないで摂取カロリーを30~40%減らす食事です。
食糧が減少すれば、物質合成するための栄養素やエネルギー(ATP)が減少するので、細胞の増殖は抑制されます。そのため、生体は、細胞の増殖を促進する増殖因子や蛋白同化ホルモン(男性ホルモン)の産生を抑制します。これらの因子(増殖因子や蛋白同化ホルモン)は老化を促進し、がんの発生を促進します。したがって、カロリー制限は老化とがんの発生を抑制することになります。
カロリー制限は寿命を延長し、がんを予防する最も確実な方法です。このカロリー制限はAMP活性化プロテインキナーゼ、サーチュイン、PGC-1α(ペルオキシソーム増殖因子活性化受容体γコアクチベーター1α)を活性化してミトコンドリの数と機能を高めることによって抗老化作用を発揮しています。
カロリー制限模倣薬と言われるメトホルミン、レスベラトロール、プテロスチルベン、スペルミジン、ニコチンアミド・モノヌクレオチド、ニコチンアミド・リボシルなどを服用すると、カロリー制限を実践しなくても、抗老化とがん予防と寿命延長の効果が得られます。
リチャード・ドーキンスの利己的遺伝子の考えでは「体は遺伝子を次の世代に引き渡すための乗り物に過ぎないので、生殖年齢が過ぎれば生かしておく必要は無い」と遺伝子は考えています。 それに対して、脳は死にたくないので、遺伝子の企みに逆らって、不老長寿の達成のためにいろいろと考えています。体が死ぬと、脳も死ぬためです。
脳と遺伝子の戦いは、脳が遺伝子の企みに気づいてきたので、最近は脳の方が優勢のようです。しかし、寿命を延ばしたいという脳の願望は、人類の種としての繁栄にはマイナスに作用している可能性もあります。
この記事が気に入ったらサポートをしてみませんか?
