ワクチン接種するも後遺症になる率は変わらない(査読前)
ワクチン接種後のSARS-CoV-2感染による
6ヵ月間の後遺症:10,024人のブレークスルー感染の
レトロスペクティブ・コホート研究
ORCID プロフィールを見るMaxime Taquet, ORCID プロフィールを見るQuentin Dercon, ORCID プロフィールを見るPaul J Harrison
doi: https://doi.org/10.1101/2021.10.26.21265508
この記事はプレプリントであり、査読を受けていません(どういう意味でしょうか?]まだ評価されていない新しい医学研究を報告しているため、臨床診療の指針として使用するべきではありません。
概要
ワクチン接種は、SARS-CoV-2への感染、COVID-19発症後の死亡や入院に対して有効であることが証明されている。しかし,COVID-19の他の急性期および急性期後の転帰に対するワクチン接種の効果についてはほとんど知られていない。データはTriNetX電子医療記録ネットワーク(主に米国の8100万人以上の患者)から入手した。後方視的コホート研究と時間対事象分析を用いて,SARS-CoV-2 感染の少なくとも 2 週間前に COVID-19 ワクチン(米国で使用が承認されている)を接種した人と,傾向スコアをマッチさせた COVID-19 のワクチン接種を受けていないがインフルエンザワクチンを接種した人の間で COVID-19 転帰の発生を比較した.アウトカムは、SARS-CoV-2感染確定後6か月間(2021年1月1日から8月31日の間に記録)に記録されたCOVID-19後遺症を表すICD-10コードであった。ワクチンの接種回数(1回 vs. 2回)および年齢(60歳未満 vs. 60歳以上)との関連性を評価した。SARS-CoV-2感染のワクチン接種者10,024人のうち、9479人をワクチン未接種対照者とマッチングさせた。COVID-19ワクチンを少なくとも1回接種したことは,呼吸不全,ICU入室,挿管/換気,低酸素血症,酸素要求量,高凝固障害/静脈血栓塞栓症,発作,精神障害,脱毛(それぞれ競合リスクを考慮し,死亡との複合エンドポイントにした;HR 0.0)のリスクを著しく低下させていた.70-0.83、ボンフェローニ補正p<.05)であったが、長期のCOVID特徴、腎臓病、気分、不安、睡眠障害などの他のアウトカムは含まれなかった。2 回のワクチン接種を受けることは,ほとんどの転帰のリスクを低下させることと関連していた.ワクチン接種歴とSARS-CoV-2感染の転帰との関連は,60歳未満で顕著であったが,60歳以上では強固な関連は観察されなかった.以上より,COVID-19ワクチン接種は,SARS-CoV-2感染者のCOVID-19後遺症のいくつかのリスクの低下と関連するが,すべてではない.ワクチン接種の効果は,若年者では明らかであったが,60歳以上では認められなかった.この知見は、サービス計画への情報提供、ワクチン接種プログラムの公衆衛生上の影響の予測に貢献し、COVID-19後遺症に対する追加的な介入を特定する必要性を強調するものである可能性がある。
紹介文
COVID-19のワクチン接種後にSARS-CoV-2に感染する可能性があるという観察(いわゆるブレークスルー感染)は、懸念を呼んでいる(Nixon and Ndhlovu, 2021)。これらの懸念は、重篤なCOVID-19疾患のリスク(入院、集中治療室への入院、および死亡率によって代用される)がワクチン接種によって軽減されるという豊富な証拠によって軽減される(Agrawal et al,2021; Antonelliら, 2021; Bahlら, 2021; Buttら, 2021; Cabezasら, 2021; Glatman-Freedmanら, 2021; Haasら, 2021; Hyamsら, 2021; Mateo-Urdiales ら, 2021; Roestら, 2021)があります。ある症例対照研究では、ワクチン接種者と非接種者908組を対象に、自己申告によるSARS-CoV-2感染と28日以降の自己申告症状との関連を調べた(Antonelliら、2021年)。それによると、ワクチン未接種者と比較して、ブレークスルー感染者は28日以降の症状のリスクが低いことがわかった。
しかし、COVID-19のワクチン接種がSARS-CoV-2感染の広範な後遺症にどのように影響するかは、依然として不明である。特に、SARS-CoV-2感染後の静脈血栓塞栓症、虚血性脳卒中、精神神経系合併症、長期COVID提示、およびその他の急性期後の後遺症のリスクがワクチン接種者と非接種者で同じであるかは不明である。さらに、未接種者はワクチン接種のためらいに関連した健康行動を持っている可能性があり(Latkin et al.、2021)、この潜在的なバイアスの原因はこれまでの研究で対処されていない。
電子カルテに基づく本コホート研究では,COVID-19ワクチンを接種した人(としなかった人)のSARS-CoV-2感染の6か月間の転帰を比較した.複数の身体システムにわたって,COVID-19 との関連が証明されているさまざまな転帰(急性期および急性期後)を調査した.
メソッド
データおよび研究デザイン
本研究では、米国を中心とする59の医療機関(HCO)、総患者数8100万人の匿名化データを記録するEHRの連携ネットワークであるTriNetX Analyticsを使用しました。利用可能なデータは、人口統計、診断(ICD-10コード)、処置(Current Procedural Terminology [CPT]コード)、測定(血圧など)です。HCOは、プライマリーケアセンター、病院、専門家ユニットが混在しています。保険加入者だけでなく、未加入者のデータも提供されます。データの非識別化は、HIPAA プライバシー規則のセクション 164.514(b)(1) に定義される有資格専門家による正式な決定を受け、証明される。この正式な決定は、TriNetXの欧米のIRB(Institutional Review Board)からの免除に取って代わるものである。TriNetXのユーザーインターフェースを使って、コホートを作成し、交絡変数についてマッチングを行い、指定された期間において関心のある結果について比較します。TriNetXの詳細については、付録1-2ページをご参照ください。
コホート
プライマリーコホート、コントロールコホートともに、2021年1月1日から2021年8月31日の間に、SARS-CoV-2感染が確認されたすべての患者とし、COVID-19(ICD-10コードU07.1)の確定診断またはSARS-CoV-2のPCR検査が初めて陽性となったと定義している。一次コホートでは、SARS-CoV-2感染が、米国で使用が承認されているCOVID-19ワクチン(すなわち、BNT162b2「Pfizer/BioNTech」、mRNA-1273「Moderna」、またはAd26.COV2.S「Janssen」)の投与記録後少なくとも14日以内に起こった患者のみが対象とされた。対照コホートでは、SARS-CoV-2感染前にCOVID-19に対するワクチンの記録がない場合、およびインフルエンザに対するワクチンの接種歴がある場合のみ、患者を対象とした。米国では、疾病管理予防センター(CDC)は、生後6ヶ月以上のすべての人に毎年のインフルエンザワクチン接種を推奨している。このため、明らかにワクチン接種を躊躇している患者(いわゆる「アンチワクチナー」)は、COVID-19のアウトカムとの関連を混乱させる可能性のある他の健康関連行動と相関があるため、この対象基準では除外した(Latkinら、2021年)。詳細は付録2-4頁に記載。
共変量
COVID-19およびより重症のCOVID-19疾患の確立された危険因子および疑われる危険因子のセットを使用した(de Lusignan et al, 2020; Taquet et al, 2021c; Williamson et al.)。2020):年齢、性別、人種、民族、肥満、高血圧、糖尿病、慢性腎臓病、喘息、慢性下気道疾患、ニコチン依存、物質誤用、虚血性心疾患およびその他の心臓疾患、社会経済的剥奪、癌(特に血液癌)、慢性肝疾患、脳卒中、認知症、臓器移植、関節リウマチ、ループス、乾癬および免疫機構に関わる疾患などです。これらの危険因子を患者さんの健康記録から把握するために、55の変数が使用されました。ICD-10コードを含む詳細は、付録のpp.4-5に記載されています。以下に述べるように、これらの変数すべてについてコホートをマッチングさせた。さらに,コホートはSARS-CoV-2感染日によって2か月ごとに層別化し(2021年1月1日から2月28日,2021年3月1日から4月30日,2021年5月1日から6月30日,2021年7月1日から8月31日),各期間で独立して照合を行った(照合コホートは,2か月ごとにできるだけ多くの患者がSARS-CoV-2を発症したことが保証される)。
成果
電子カルテに基づく4つの大規模研究(Al-Alyら、2021年、Daughertyら、2021年、Taquetら、2021b、2021a)においてCOVID-19との有意な関連が示されているすべての急性および急性後遺症の6カ月間の発生率を調査した、すなわち、。
入院
集中治療室(ICU)入室率
死亡
気管内挿管/換気
呼吸不全
低酸素血症
酸素要求量
長い COVID 機能(文献 18 に定義された以下のいずれか、およびそれぞれ)。
- 腹部症状
- 呼吸の異常
- 不安・抑うつ
- 胸・のどの痛み
- 認知症状
- 疲労感
- 頭痛
- 筋肉痛
- その他の痛み
高血圧症
不整脈
心不全
心筋症
心筋炎
冠動脈疾患
高凝固性疾患/深部静脈血栓症(DVT)/肺塞栓症(PE)
虚血性脳卒中
脳出血
末梢神経障害
発作
2型糖尿病
肝疾患
腎臓病
間質性肺疾患
蕁麻疹
睡眠障害
胃食道逆流症(GORD)
脱毛
高脂血症
関節痛
肥満
アノスミア
神経・神経根・神経叢の障害
筋神経接合部/筋疾患
精神障害
気分障害
不安障害
各アウトカムは、COVID-19との関連を示した原著論文で規定された、対応するICD-10、CPT、VA Formularyコードの集合として定義された。競合リスクとしての死亡を考慮し、したがって生存者バイアスに対処するために、各アウトカムは、死亡を他の構成要素とする複合アウトカムの一部として分析された(Manja et al.)生存者バイアスに対処するために必要ではあるが、このアプローチは、死亡そのものよりもはるかに稀なアウトカムのリスクに対する洞察を提供する可能性は低い。解析は2021年10月12日に実施された。詳細、および ICD-10/CPT/VA Formulary コードは、付録の pp.5-6 に記載されている。
二次分析
過去のワクチン接種とSARS-CoV-2感染の転帰との関連が、受けたワクチン接種回数や感染時の年齢によって緩和されるかどうかを評価した。これは,一次コホートを,(i)感染14日前までにワクチン投与を1回のみ受けた者,(ii)感染14日前までにワクチン投与を2回受けた者,(iii)60歳未満,(iv) 60歳以上に限定することで達成された.後者の2つのサブグループ解析では、対照コホートもそれぞれ60歳未満および60歳以上に限定された。
統計解析
傾向スコアマッチング(TriNetXネットワーク内で実施)を用いて、ベースライン特性をマッチングさせたコホートを作成した(Austin, 2011)。傾向スコア1:1マッチングは、傾向スコアの対数の0.1プール標準偏差のキャリパー距離で、貪欲な最近傍アプローチを使用した。コホート間の標準化平均差(SMD)が0.1より小さい特性は、よくマッチしているとみなされる(Haukoos and Lewis, 2015)。各アウトカムの発生率の推定には、Kaplan-Meier推定法を用いた。ハザード比(HR)と95%信頼区間はCoxモデルを用いて算出し、コホート間の差がないという帰無仮説はlog-rank検定を用いて検定した。比例ハザードの仮定は一般化シェーンフェルド法を用いて検定した。この仮定が破られた場合、対数累積ハザードにフィットした自然三乗スプラインを用いて時間変動するHRが推定された(Royston and Parmar, 2002)。複合エンドポイント(死亡をもう一つの構成要素とする)内での関心のある個々の結果の寄与は、イベントの総数に対する関心のあるイベントの数(例えば、呼吸不全の数に対する呼吸不全または死亡の数)として報告された。
COVID-19ワクチンの接種歴とSARS-CoV-2感染の転帰の関連が年齢によって緩和されるかどうかを統計的に検証した。同様に、ワクチン接種回数による緩和は、感染時に1回接種した人のHRと2回接種した人のHRの比が1から統計的に有意に異なるかどうかを検定することによって達成された。
詳細は付録P.7に記載しています。統計解析は、TriNetXで実施したlog-rank検定を除き、Rバージョン3.6.3で実施した。統計的有意性は両側p値<0.05とした。一次解析では45のアウトカムを同時に評価するため、多重比較のためのボンフェローニ補正が適用された。RECORD(REporting of studies Conducted using Observational Routinely-collected health Data)ステートメントを完成させた(付録参照)。
結果
COVID-19に対するワクチンの初回接種から2週間以上経過した時点でSARS-CoV-2感染を記録した合計10,024人(感染時の平均[SD]年齢:57.0[17.9]歳,女性59.4%)を特定した。そのうち65.1%がBNT162b2「Pfizer/BioNTech」,9.0%がmRNA-1273「Moderna」,1.6%がAd26.COV2.S「Janssen」,24.4%が特定できないサブタイプで接種されていた.このうち9479人は,SARS-CoV-2感染前にCOVID-19ワクチンを接種していないSARS-CoV-2感染者9479人とマッチングされた。両コホートの主な人口統計学的特徴と併存疾患を表1にまとめた(追加のベースライン特性は付録の18-19頁に示した)。すべての比較とベースライン特性およびすべてのサブグループについて、適切な傾向スコアマッチング(標準化平均差<0.1)が達成された(付録pp.18-27)。
インラインで見る
表1
傾向スコアマッチング前後のワクチン接種群および非接種群のベースライン特性および主要アウトカム。マッチング後に全体の有病率が5%を超えた特性のみをここに示す。その他のベースライン特性については付録18-19頁を参照。
SARS-CoV-2感染後に発生する確率が高いと以前から報告されている様々な健康イベント(死亡と組み合わせた複合エンドポイント)の感染後6ヶ月以内の発生に対するHRを推定した。図1および図2(すべてのKaplan-Meier曲線は付録9-12頁、要約表は28-29頁参照)に見られるように、ワクチン未接種者と比較して、SARS-CoV-2感染時にワクチンを接種した者は死亡および呼吸不全の複合転帰のリスクが著しく低かった(HR0.70, 95% CI 0.63-0.78, Bonferroni-corrected p<0.0001),挿管/換気(HR 0.72, 95% CI 0.61-0.84, Bonferroni-corrected p=0.0024),低酸素症(HR 0.72, 95% CI 0.65-0.78, Bonferroni-corrected p<0.0001)であった.80、ボンフェローニ補正p<0.0001)、発作(HR 0.73、95%CI 0.62-0.86、ボンフェローニ補正p=0.0057)、ICU入院(HR 0.75、95%CI 0.65-0.85、ボンフェローニ補正p<0.0001)、精神障害(HR 0.75、95%CI 0.63-0.89、ボンフェローニ補正 p=0.013.036)、脱毛(HR 0.75、95%CI 0.64-0.88、Bonferroni-corrected p=0.024)、高凝固性または静脈血栓塞栓症(HR 0.81、95%CI 0.72-0.91、Bonferroni-corrected p=0.014)、酸素要求量(HR 0.83、95%CI 0.75-0.92、Bonferroni-corrected p=0.011)である。一方、死亡とあらゆるlong-COVID特徴の複合(HR 1.01, 95% CI 0.96-1.05, p=0.83, Bonferroni-corrected p=1.0)、2型糖尿病(HR 0.91、95% CI 0.75-0.92, Bonferroni-corrected p=0.011) など他の多くのアウトカムのリスクに有意差はみられなかった。97, 95% CI 0.90-1.05, p=0.45, Bonferroni-corrected p=1.0)、気分障害(HR 1.05, 95% CI 0.96-1.15, p=0.27, Bonferroni-corrected p=1.0 )、不安障害(HR 1.06, 95% CI 0.97-1.15, p=0.20, Bonferroni-corrected p=1.0 )等であることが示された。45のアウトカム中35のアウトカムについて比例性の仮定に違反はなかった(他の10のアウトカムについての時変HRは付録p30-31、p13)。他の10個のアウトカム(死亡を含む)のほとんどについて、時変HRはフォローアップウィンドウの早い段階で1より有意に低かった(ワクチン接種の有無との関連性が強いことを示す)。

図1
COVID-19ワクチン接種者と非接種者のSARS-CoV-2感染後6カ月以内の転帰に関するハザード比。1より低いHRは、ワクチン接種者では転帰が少ないことを示す。横棒は95%信頼区間を示す.各アウトカムは,競合リスクに対応するため,死亡を構成要素とする複合エンドポイントである.複合エンドポイントの全体的な発生率に対する目的のアウトカムの寄与は,色で示されている.
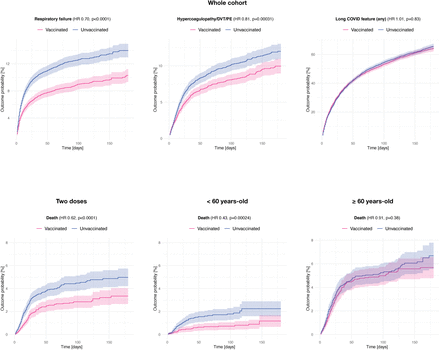
図2
全コホートにおけるワクチン接種者と非接種者のSARS-CoV-2感染による転帰の発生率(上)および異なるサブグループにおける死亡の発生率(下)のKaplan-Meier推定値。95%信頼区間は網掛けで示した。全コホートにおける他のすべての転帰のKaplan-Meier曲線については、付録の9-12頁を参照のこと。DVT=深部静脈血栓症。PE=Pulmonary embolism(肺塞栓症)。
一次解析でワクチン接種との有意な関連が示された転帰以外に、SARS-CoV-2感染時に2回のワクチン接種を受けていた人は、筋肉痛、心筋炎、脳出血、間質性肺疾患、じんま疹、アノスミア、筋神経接合部/筋疾患(それぞれ死亡との複合エンドポイントとして)、死亡リスクも著しく低かった(図3、付録14ページ、32-33参照)。ワクチンを1回しか接種していない人では、HRは同様のパターンを示したが、概して1に近かった(図3および添付資料15、34-35ページ)。いずれのアウトカムにおいても、2回接種者のHRは1回接種者のHRと統計的に有意な差はなかった(付録:36-37ページ)。

図3
SARS-CoV-2感染後6ヶ月以内の転帰について、ワクチン1回接種者(対非接種者)、ワクチン2回接種者(対非接種者)、60歳未満の接種者対非接種者、60歳以上の接種者対非接種者のハザード比を示した。1より低いHRは、ワクチン接種者においてより一般的でないアウトカムを示す。横棒は95%信頼区間を示す。各アウトカムは、競合リスクに対応するため、死亡を構成要素とする複合エンドポイントである。複合エンドポイントの全体的な発生率に対する目的のアウトカムの寄与は、色で示されている。代表的なアウトカムのサブセットのみが表示されている。すべてのアウトカムを表示した同じ図を付録のpp.14-17に示している。
我々は、年齢が結果に与える実質的な影響を見いだした。ワクチン接種と有意に関連するアウトカムでは、若年者(60歳未満)のHRの多くが全般的に低い(つまり、ワクチン接種がより好ましい)ことがわかった(図3、付録16、38-39ページ)。これらの低いHRは、若年者ではほとんどのアウトカムで絶対リスクが低いことを背景として観察された(付録38-39頁)。一方、60歳以上では、ほとんどの傾向が若年層と同様であったが、ボンフェローニ補正後、いずれのHRも1から統計的に有意な差はなかった(図3、付録17、40-41ページ)。一次解析のワクチン接種状況に関連する1つのアウトカムを除くすべてのアウトカムで、高齢者群のHRは若年者群のHRより有意に高かった(つまり、ワクチン接種がより好ましくない)(付録pp.42-43)。例えば、死亡または呼吸不全の複合アウトカムのHRは、60歳未満では0.48(95%CI 0.39-0.60)、60歳以上では0.85(95%CI 0.76-0.96)だった(両者の比:1.77、95%CI 1.38-2.26, p<0.0001 )。唯一の例外は,死亡と高凝固性疾患/DVT/PEの複合であった(高齢者群のHR 0.93,若年者群のHR 0.72,両者の比 1.30,95% CI 1.00-1.70,p=0.054 )。
ディスカッション
ワクチン接種がCOVID-19による入院、ICU入室、死亡から保護することが確立されている(Agrawalら、2021;Antonelliら、2021;Bahlら、2021;Buttら、2021;Cabezasら、2021。2021; Glatman-Freedman et al., 2021; Haas et al., 2021; Hyams et al., 2021; Mateo-Urdiales et al., 2021; Roest et al., 2021)しかし、破たんSARS-CoV-2感染の他の結果についてはあまり知られていなかった。本研究で提示された大規模な電子健康記録ネットワークからのデータは、ワクチン接種が画期的なSARS-CoV-2感染後の死亡とICU入室を防ぐことを確認し、一般集団におけるこれらのアウトカムに対するHRの推定値を提供している。また,本研究では,COVID-19 に対するワクチン接種が,これまでの研究で評価されていなかった追加の転帰,すなわち呼吸不全,低酸素血症,酸素要求量,高凝固性または静脈血栓塞栓症,発作,精神障害,脱毛のリスクの低下と関連していることが示された.
一方、過去のワクチン接種は、COVID-19のいくつかの既往の結果、例えば、長いCOVIDの特徴、不整脈、関節痛、2型糖尿病、肝臓疾患、睡眠障害、気分・不安障害に対して予防的ではないようである。信頼区間が狭いため(COVID後のこれらの転帰の発生率が高いことに関連)、これらの否定的な知見が単に統計的検出力の不足の結果である可能性は排除される。これらの転帰の複合エンドポイントに死亡が含まれていることから、生存率バイアスを説明することはできない。むしろ、これらの否定的な所見は、これらの転帰が、事前のワクチン接種によって影響を受ける転帰とは異なる病態生理学的メカニズムによって生じることを示唆しているのかもしれない。例えば、不安や抑うつについては、ワクチンによる防御効果が、ワクチンを接種したにもかかわらず感染しているという追加的なストレス要因によって打ち消されるという、拮抗する力が働いているのかもしれない。
COVID-19のこれらの後遺症の高い発生率と負担を考えると、長いCOVIDの特徴に対する保護効果がないことは懸念される(Taquetら、2021a)。しかし、いくつかの個々のlong-COVID特徴のリスクは、ワクチン接種歴と有意に関連していた(ただし、多重比較のための補正を受けなかった):筋肉痛(HR 0.78, 95% CI 0.67-0.91 )、疲労(HR 0.89, 95% CI 0.91)、疲労(HR 0.89, 95% CI 0.91)、疲労(HR 0.89, 95% CI 0.91)。呼吸異常(HR 0.89, 95% CI 0.81-0.98)および認知症状(HR 0.87, 95% CI 0.76-0.99)に対するワクチン2回目投与後の追加予防の可能性もあった。個々のlong-COVIDの特徴の発生率の相対的な違いは、ワクチン接種がlong-COVID症状に対して全体的に保護的であることを示唆するアプリベースの調査結果との違いを説明するかもしれない(Antonelliら、2021年)。他の理由でもこの違いを説明できるかもしれない。第一に、本研究では、自己選択した個人ではなく、一般集団からルーチンに収集されたデータを使用した。第二に、本研究は大きなサンプルサイズを使用し、記録された幅広い併存疾患についてコホートをマッチングさせている。さらに選択バイアスを減らすために、本研究の対照コホートは、インフルエンザワクチンの接種を受けた人の中から選ばれており、そのため、ワクチンの接種をためらうことや関連する健康行動の交絡の影響をコントロールするのに役立つ(Latkin et al.、2021年)。第三に、自己報告ではなく、医療記録から抽出した症状や診断を用いることで、本研究では最も重篤な症状の提示を捉えることができ、これらは需要特性や他の形態の検出バイアスの影響を受けにくい可能性がある。最後に、2つの研究間で使用されたワクチンの種類に違いがある可能性がある。特に、我々の研究では、ChAdOx1 nCov-19 ('Oxford/AstraZeneca') ワクチンは使用されていない(このワクチンは米国では使用されていないため)。
SARS-CoV-2に対するワクチン接種がCOVID-19の急性期後の転帰のいくつかに対して防御しないという知見は、これらの転帰を防ぐ最善の方法はそもそもSARS-CoV-2感染を防ぐことなので、ワクチン接種は集団レベルでこれらの転帰に対する重要な防御因子であり続けるという事実を不明瞭にしてはいけない。これは60歳以上でも同様である(Polack et al.,2020)。しかし、我々の結果は、SARS-CoV-2の急性期以降の転帰の一部(特に長時間のCOVID提示)は、集団のワクチン接種が成功しても、ブレークスルー感染が起こる限り、持続する可能性が高いことを浮き彫りにしている。これらの知見は、必要なサービス提供を決定するのに役立つ。また、このようなCOVID-19の後遺症の影響を軽減するために、他の予防的または治療的介入を特定することが急務であることを強調している。
死亡は、競合リスクに対処するため、関心のある各アウトカムとの複合エンドポイントに含められた(Manja et al.、2017)。このことは、死亡よりもはるかに稀なアウトカム(調査したアウトカムの中では少数派)については、HRは関心のあるアウトカムではなく、死亡によって引き起こされる可能性があることを示唆している。例えば、ワクチン未接種コホートにおける精神病性障害の6ヶ月発生率は1.11%であったが、このコホートにおける死亡率は4.5%であった。したがって、死亡と精神病性障害の複合エンドポイントのHRが0.75であるのは、死亡率の差に起因する部分がある。興味のあるアウトカムを単独で(すなわち、死亡と複合していない)観察することは、それが1より低い限り有益である。1より低いHRは、生存バイアス(本研究ではHRが増加する)にもかかわらず、興味のあるアウトカムの割合が低いことを示唆している。HRが1より大きい場合、その転帰がワクチン接種者に多いのか、生存者バイアスの結果なのかを知ることは不可能である。すべての転帰を分離した場合のHRは、一次解析および二次解析の付録pp.44-53に記載されている。例えば、単独で測定した精神病性障害のHRは0.79であり、この転帰の発生率はワクチン非接種者よりもワクチン接種者で実際に低く、その有意なHRは単に死亡率の差に起因しない可能性があることを示唆している。
重要なことは、急性重症感染症および急性後遺症に対するワクチンの予防効果は、主に60歳未満の人に影響するようであることです。このグループでは、効果は大きく、強固であったが、60歳以上のグループでは、効果は小さく、統計的に強固でなかった。この年齢に関する知見は、若年サブグループと高齢サブグループのサンプルサイズがほぼ同じであり(それぞれ4633人と4657人)、一般に高齢サブグループの方が転帰がより頻繁なので、統計的検出力の差によって説明することができない。むしろ、若年者と高齢者では、ブレイクスルー感染症の病態生理学的経路の寄与が異なることに起因する可能性がある。若年者では,ワクチン接種による効果的なB細胞反応が,抗体の中和活性が低い亜種への感染に続いて起こる可能性がある(Wuら,2021).高齢者では、ワクチン接種に対するB細胞反応自体が無効であり(Siegrist and Aspinall, 2009)、ワクチン未接種者の感染と同様の臨床症状を呈する可能性がある。いずれにせよ、SARS-CoV-2感染症の重症度と後遺症に対するワクチン接種の効果は、一見年齢制限のあるものであり、公衆衛生上の意義は明らかである。
本研究には、記録の完全性が不明であること、診断の検証が行われていないこと、社会経済的要因やライフスタイルに関する情報が乏しいことなど、EHRを用いた研究(Caseyら、2016;Taquetら、2021b)に特有の限界(付録P2に要約)以外にもいくつかの限界があります。まず、個々の患者がどのSARS-CoV-2亜型に感染していたかは不明であり、これはワクチンの防御効果に影響を与える可能性がある。懸念の変種は、ブレイクスルー感染で過剰に発現しているという証拠がある(McEwenら、2021年)。そのような変種はより悪い転帰と関連する傾向があるので(Nybergら、2021)、ブレークスルー感染におけるそれらの濃縮は、本研究で示されたいくつかのHRが保守的な推定値であるかもしれないことを意味する。第二に、ワクチン接種の有無が、特に重症度の低い転帰について、医療機関の受診や治療を受ける確率に影響する可能性がある。第三に,本研究では,SARS-CoV-2に感染したが,検査もCOVID-19の診断も受けなかった患者の転帰については何も語っていない.第四に,本研究では,ワクチン接種の有無とSARS-CoV-2感染の転帰との関連が,感染に対するワクチン接種のタイミングによって緩和されるかどうかは調査していない.第5に,大多数がPfizer/BioNTechワクチンを接種していたため,異なるワクチン同士の比較はできなかった.最後に、観察研究であるため、因果関係を推論することはできない(ただし、ある結果と他の結果との関連性の特異性と用量反応関係は、因果関係を説明するものとして支持される)。
以上より,本データは,COVID-19の接種歴,特に2回接種後が,高齢者ではなく若年者において,COVID-19のすべての結果ではないが,多くの結果のリスクを有意に減少させることを示した.また、COVID-19の後遺症に対する予防的・治療的介入をさらに特定・開発することが緊急に必要であることが明らかになった。
データ提供
TriNetXシステムは、これらの分析結果をcsvファイルとして返し、ダウンロードし、アーカイブした。本論文および付録で紹介したデータは、[公開時に追加されるURL]で自由にアクセスすることができる。また、TriNetXは、研究者が特定の懸念を持っている場合、アクセスを許可します(第三者契約オプションを使用)。
資金提供者の役割
資金提供者は、研究デザイン、データの収集・分析・解釈、報告書の執筆、論文の投稿の決定において、いかなる役割も担っていない。
貢献者
MTとPJHは、研究のコンセプト立案、資金獲得、方法論の定義、プロジェクトの管理・監督に関与した。MTとQDはデータを精査し、正式な分析を行い、調査結果の妥当性を確認した。MTは可視化資料を作成し、原案を執筆した。MT、QD、PJHが原稿のスタイルと内容を確認し、編集を行った。PJHとMTは研究目的でTriNetX Analyticsのネットワークに無制限にアクセスでき、分析の実施や出版の決定に制約を受けることはない。対応する著者は本研究の全データにアクセスし,解析を行い,データの完全性とデータ解析の正確性に責任を持つ。
利害関係者の宣言
著者は利益相反がないことを宣言する。
データ共有
TriNetXシステムは、これらの分析結果をcsvファイルとして返し、ダウンロードし、保存した。本論文と付録で紹介したデータは、[出版時にURLを追加]で自由にアクセスできる。また、TriNetXは、研究者が特別な懸念を抱いている場合、アクセスを許可する(第三者契約オプションを利用)。
謝辞
この研究は、国立衛生研究所(NIHR)オックスフォード・ヘルス生物医学研究センター(助成金BRC-1215-20005)の支援を受けています。MTはNIHR Academic Clinical FellowおよびNIHR Oxford Health BRC Senior Research Fellowである。QDはMedical Research Council(SUAG/077 G101400)およびAXA Research Fund Fellowship(G102329)の支援を受けている。記載された見解は著者のものであり、必ずしも英国国民保健サービス、NIHR、または英国保健省のものではありません。
以下略
この記事が気に入ったらサポートをしてみませんか?
