
CDC論文の批評
Dr. Geert Vanden Bossche 2024年2月8日(Voice For Science and Solidarity)
Critique to CDC Publications
2月9日投稿(Substack)
Sending the CDC back to the drawing board...
の翻訳です。
原文を参照の上ご利用ください。
以下に論じるCDC研究に対する私の批評は、COVID-19ワクチン、特にmRNAワクチンの、安全性と有効性の欠如に関するユニークな概説を補足するものである(https://pubmed.ncbi.nlm.nih.gov/38274635/)。その概説は、オミクロン期となっても、COVID-19ワクチンは(重篤な)COVID-19疾患に対する防御効果があると主張する主流の説を問題にしている。
私の批評を十分に理解するためには、次のことを認識しておくことが極めて重要である。COVID-19ワクチン接種者は、過去、初期のオミクロン子孫株にワクチン・ブレークスルー感染した時も、そして現在、最近のオミクロン子孫株にワクチン・ブレークスルー感染した時も、ほぼ(重篤な)COVID-19疾患から守られているが、その防御は、免疫再集中と、その後に起こる免疫逃避を代償としてもたらされている。
改良された/更新されたCOVID-19ワクチンに美辞麗句が並べ立てられているにも関わらず、オミクロンの出現と、その子孫の着実な進化が高度にCOVID-19ワクチンを接種された集団に対する重大な脅威である理由はこれである:オミクロンの出現以来、殆どのCOVID-19ワクチン接種者の感染緩和を主に担っているのは高度に抗体特異的なウイルス中和抗体ではない。他方、COVID-19ワクチン接種者でウイルス感染細胞の排除を担い、疾患(症状)を抑制しているのは抗原特異的CD8陽性記憶T細胞ではない。SARS-CoV-2の自然感染、もしくは、COVID-19ワクチン接種によって交差反応性細胞傷害活性が誘導されたという報告は、いまだかつてないからである。そうではなく、接種者の(重症)疾患予防能力は、主として、ワクチン・ブレークスルー感染の間に誘導された、短寿命の変異株非特異的多反応性非中和抗体と、ワクチン・ブレークスルー感染によって引き起こされた免疫再集中の結果産生された変異株非特異的細胞傷害性T細胞が担っていると考えることが合理的である。したがって、更新型のCOVID-19ワクチンが、そのような短寿命の代替的獲得免疫反応を引き起こし続け、新たなオミクロン変異株に対する防御を維持できるという保証はない。現在流行しているオミクロン子孫株(JN.1の一族を含む)は、ウイルス固有の感染性が高いため、接種者の重症COVID-19疾患に対する防御に対する脅威が増しつつある(以下の図を参照して欲しい)。
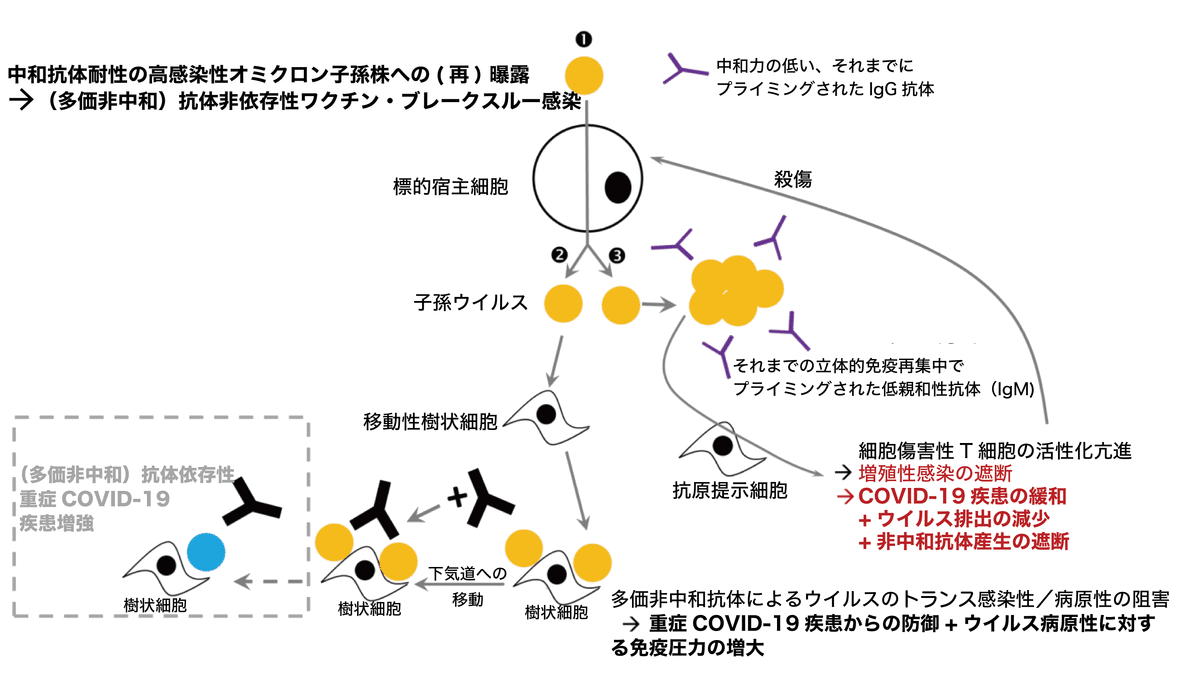
図:新たに出現した、非常に感染性の高いオミクロン子孫株は、標的宿主細胞に感染するのに、多価非中和抗体を必要としない(❶)。非常に感染性の高いオミクロン子孫株は複製(増殖)して、組織常在樹状細胞への吸着が促進されるような免疫環境を作り出す。吸着した子孫ウイルスに多価非中和抗体が大量に結合した状態で、樹状細胞は肺や他の遠隔臓器に移動する(❷)。この、樹状細胞に吸着したウイルスと、病原性抑制性の多価非中和抗体との結合の促進と、抗体産生の減少が相まって、高度にCOVID-19ワクチンを接種された集団では、ウイルス病原性に対する免疫選択圧力が上昇していく。それまでの立体的免疫再集中でプライミングされた抗体は、非常に感染性の高い、抗原的に遠い変異株に対して低親和性のため、大きな抗体-ウイルス複合体が形成され、巡回する抗原提示細胞に取込まれる(❸)。抗原提示細胞による大きな抗体-ウイルス複合体の取込みが亢進すると、細胞傷害性T細胞の強力な活性化が起こる。それによって、ウイルスに感染した宿主細胞が排除されるが、ヘルパーT細胞の働きが妨げられ、それまでの立体的免疫再集中でプライミングされた抗体のブーストが弱まる。以前にプライミングされた抗スパイク抗体のブーストが弱まると、多価非中和抗体の産生が減少する。本文で説明したように、抗原提示細胞によるウイルスの取り込みが促進されると、高感染性子孫ウイルスの樹状細胞への吸着が遅くなり、それによって多価非中和抗体産生の減少による多価非中和抗体濃度の低下が緩和される。従って、集団における多価非中和抗体濃度の減少は、多価非中和抗体によるウイルスのトランス感染抑制というブレーキを広く解除するほど、急速には進まない可能性がある。しかし、より感染性の強いBA.2.86の子孫(すなわちJN.1一族)が出現し、急速に流行が拡大しているため、高度にCOVID-19ワクチンを接種された集団は、ウイルスの病原性に対する免疫選択圧力を着実に高めている。 このため、高度にCOVID-19ワクチンを接種された集団では、多価非中和抗体依存性の重度のCOVID-19疾患増強による高病原性ワクチン・ブレークスルー感染を引き起こす能力を持つ新たな変異株が選択されると考えられる。
CDC(とCDCの盲目的信者)は初心に戻れ
著者 Geert Vanden Bossche (https://www.voiceforscienceandsolidarity.org/; Independent Research) ,
Kris Denhaerynck (Epidemiology and Biostatistics, Independent Research, Basel, CHE)
「免疫正常成人における同時流行中のオミクロン変異株による症候性SARS-CoV-2感染に対する2023-2024年COVID-19ワクチン(一価XBB.1.5)有効性の初期評価——2023年9月-2024年1月の期間のIncreasing Community Access to Testing Program研究、アメリカ合衆国」という論文を読んだ。本論文は、安全性についてのあらゆる懸念を無視して、“有効な防御”なるものを主張し、ワクチンを推進しようという保健当局のさらなる企てである。
Early Estimates of Updated 2023–2024 (Monovalent XBB.1.5) COVID-
19 Vaccine EffectivenessAgainst SymptomaticSARS-CoV-2 Infection Attributable to Co-Circulating Omicron Variants Among Immunocompetent Adults — Increasing Community Access to Testing Program, United States,September2023–January2024)(https://www.cdc.gov/mmwr/volumes/73/wr/pdfs/mm7304a2-H.pdf)
しかし、統計学的考察と免疫学的考察のみにもとづいても、CDCの結論と推奨は根拠のないものである。
統計学的考察
この種の研究デザインでは、政策提言を導くのに十分な強い証拠が得られない理由はいくつかある。
後ろ向きの症例対照研究は、研究対象者のリクルートという点では効率的かもしれないが、多くの交絡要因を調整しても納得のいく形で修正できないバイアスを持ち込むという欠点がある。
症例対照研究デザインを用いるもう一つの欠点は、相対リスクで有効性を評価できないことである。オッズ比は、有病率が小さい場合には相対リスクの近似値とみなすことができる。しかし、本研究のように有病率が高い場合、オッズ比は相対リスクよりも高い値を示す傾向がある。表2で示された1.78という粗オッズ比は、更新型ワクチンの追加接種を受けた人にとって好ましいものであるが、バイアスがかかりやすい研究デザインであることを考えると、説得力のある強い関連とは考えられない。
さらに、49%や60%というワクチン有効率は素晴らしいように聞こえるかもしれないが、これは単にオッズ比を数学的に変換したものに過ぎず、このようなパーセンテージが本当に何を表しているのか疑問が残る。さらに、信頼区間が比較的狭いことも、これらの推定値を印象的なものにしている。ロバスト推論を用い、データ収集地点が生み出す可能性のある余分なばらつきを解析に取り入れるべきだった。
さらに、対象者を有症状者のみとすることは、「有症状疾患に対するワクチンの有効性」を評価することを困難にする。症状のある患者のみを抽出することで、特定の層では有意な関係が認められるが、集団全体では認められないという層別化バイアスが生じる可能性がある。
さらに根本的な批判は、生物学的生命が複雑な適応システムとして機能しているという事実に関わるものである。システム全体に介入すると、その動的平衡が予測不可能な形で乱される可能性がある。短期的な利益よりも長期的な結果の方が悪いというリスクは、有効性推定値の信頼区間には反映されていない。なぜなら、これらの信頼区間は、介入に対する反応のばらつきを生み出す根本的なプロセスが互いに独立していると仮定しているからである。しかし、複雑系がそうであるように、全てが全てに関連している場合、普遍的な介入で全てに影響を与えることは、現在の統計的不確実性の推定では捉えられないシステムの擾乱につながる可能性がある。ワクチン・ブレークスルー感染の可能性はそのような事象の一例であり、システムはある動的平衡から別の平衡へと変化する。
免疫学的考察
以前報告したように(https://www.trialsitenews.com/a/the-conclusions-drawn-from-scientists-molecular-stamp-collection-exercises-create-false-expectations-for-addressing-the-continuous-emergence-of-sars-97944a34)[和訳]、更新型XBB.1.5対応1価mRNAワクチンはワクチン・ブレークスルー感染で引き起こされた立体的免疫再集中によって、これまでに誘導された交差反応性B細胞を活性化する可能性が高い。抗原特異性と親和性が低下しているため、これらの新しい抗体は不完全な中和力しか持たない。したがって、その中和効果は短期間しか持続せず、ウイルスの感染性に不十分な免疫圧力をおよぼすことになり、免疫逃避を促進する。
ワクチン・ブレークスルー感染をした人の中に、初めはPCRや家庭用検査キットで陰性であったが、数日後に陽性となる人がいるのは、この不十分なウイルス中和が原因かもしれない(https://www.msn.com/en-us/health/other/is-the-new-covid-variant-jn1-too-smart-for-home-tests-here-s-what-science-has-to-say/ar-BB1hjvBf)。さらに、これまでのワクチン接種後にワクチン・ブレークスルー感染を繰り返したり、更新型ワクチンの追加接種を繰り返すと、抗体-ウイルス複合体の形成が促進されて抗原提示細胞へより多く取込まれるようになり、変異株非特異的な細胞傷害性T細胞反応が活性化すると考えられる(https://www.trialsitenews.com/a/the-conclusions-drawn-from-scientists-molecular-stamp-collection-exercises-create-false-expectations-for-addressing-the-continuous-emergence-of-sars-97944a34)[和訳]。細胞傷害性T細胞反応によって、ウイルス感染細胞が迅速に排除されるため、発症して数日後には、再びPCRテストが陰性となることもある。したがって、発症数日後に初めて検査をして陰性であったとしても、その症状の原因はSC-2であったということは大いにあり得る。
上記の免疫学的動態の説明だけでも、CDC所属の著者らが行ったように、症候性SC-2感染に対するワクチン有効性を、症例-対照間の更新型C-19ワクチン接種者と非接種者のオッズの比較で計算してはならないことは明らかである。さらに、最後の接種からの期間(の中央値)が増すにしたがって、または、BA2.86/JN.1系統を示すSGTF解析[1]に基づいた推定結果で、ワクチン有効性(と主張されているもの)が減少する理由も上述の説明から明らかである[2]。さらに著者らは、解析結果は「ワクチン接種で誘導された免疫、感染で誘導された免疫、またはハイブリッド免疫を超えて、更新型COVID-19ワクチン接種することで増えた利益として解釈することができる」などと主張している。しかし、ワクチン・ブレークスルー感染の繰り返しはそれ自体、症候性感染に対する暫定的な防御をもたらすものであり、感染して発症すれば、非常に多くの接種者にとって、それは更新型ワクチンを受ける動機になるかもしれないことを考えれば、更新型C-19ワクチンの追加接種が臨床的利益を増すなど、証明できるはずもない。
結論
本研究結果は、更新型COVID-19ワクチンの追加接種を受けた者を含め、非常に感染性の高いSARS-CoV-2変異株に繰り返し曝された(すなわち、高度にCOVID-19ワクチンを接種された集団の)COVID-19ワクチン接種者の場合、症状発現早期と数日後の両方の時点でPCR検査を行うことの重要性を裏付けている。免疫反応を、広範に交差反応性だが親和性の低い抗体に移行させる、立体的免疫再集中の役割を理解していないと、PCR陰性の意味を誤解し、症候性SARS-CoV-2感染に対する更新型ワクチン追加接種の有効性を過大評価することにつながる。さらに、立体的免疫再集中は更新型mRNAワクチン接種だけではなく、ワクチン・ブレークスルー感染によっても起こる(https://www.trialsitenews.com/a/the-conclusions-drawn-from-scientists-molecular-stamp-collection-exercises-create-false-expectations-for-addressing-the-continuous-emergence-of-sars-97944a34)[和訳] ことも、本研究が更新型ワクチン追加接種の有効性を過大評価する要因となっている。
本研究が示唆するのは、検査の1週間から4ヶ月前の期間に更新型ワクチンの追加接種を受けた者の場合、検査を受けるきっかけとなった症状はSARS-CoV-2感染によるものではなく、他の疾患によるものである可能性が高いが、更新型ワクチンを受けていない者では、SARS-CoV-2感染による可能性が高い、ということである!
第1に、本研究で採用された方法は、更新型COVID-19ワクチン接種と症候性SARS-CoV-2感染からの防御の因果関係を示すことができるものではない。第2に、著者らは立体的免疫再集中で増えた抗体のウイルス中和に関わるウイルス結合特性や、(抗体-ウイルス複合体形成と、その内在化の結果としての)ウイルス感染細胞に対する細胞傷害活性の影響を調べていない。したがって、更新型1価COVID-19ワクチンが、流行と進化を続けているBA.2.86/ JN.1や他の免疫逃避系統からの症候性感染に対する防御に貢献し続けるという彼らの結論には科学的基盤が欠如している(参考記事:everydayhealth.com「更新型COVIDワクチンはJN.1変異株に極めて効果的(Updated COVID Vaccine Offers Strong Protection Against Dominant JN.1 Variant)」)。もし本研究で示されたワクチン有効性が本物、もしくは、少なくとも信頼に足るものであるならば、著者らは更新型ワクチンの追加接種が、かつてないほどの免疫逃避能力を持つSARS-CoV-2変異株による感染を排除するメカニズムについての説明を提示できなければならない。以前にも述べたように、ワクチン・ブレークスルー感染による免疫再集中によって誘導される抗体がこのウイルス排除効果をもたらしているのであるが、この抗体は非ACE2競合性結合部位に対して強いアビディティを示す。そのため、この抗体は、安定した持続的な中和効果を示すことはなく、ウイルス子孫が産生された後、細胞傷害性T細胞によるウイルス排除を短期間、促進するだけである(https://www.voiceforscienceandsolidarity.org/scientific-blog/unfortunately-its-not-over)[和訳]。
COVID-19様の症状を報告したCOVID-19ワクチン接種者が更新型COVID-19ワクチンを追加接種したこととPCR検査陰性の間の因果関係を示す説得力のある統計的証拠がないこと、COVID-19ワクチン接種に伴う重大な副作用、COVID-19ワクチンは長期間持続する抗原特異的な免疫防御をもたらすことはできないため、非常に感染性の高い免疫逃避変異株の蔓延を促進し、細胞性自然免疫の活性化を妨げていること、以上を踏まえれば、6ヶ月以上のすべての者に対して更新型ワクチンを含め、最新のCOVID-19ワクチン接種の継続を推奨するCDCの勧告は科学を冒涜しているだけでなく、倫理的に無責任なものである (https://www.voiceforscienceandsolidarity.org/scientific-blog/what-happens-if-a-pandemic-involving-a-virus-naturally-causing-acute-self-limiting-infection-fails-to-generate-herd-immunity)。
注記:
最近CDCは、小児および若年者に対してのCOVID-192価mRNAワクチンの有効性について、同じく誤解を招くような研究を発表した(https://jamanetwork.com/journals/jama/fullarticle/2814536)。
著者らは、2価ワクチンの感染予防2対する有効性を比較するために、研究対象者がSARS-CoV-2感染を起こすまでの推定ハザード比を算出した。上記と全く同じ統計学的考察に基づき、彼らが使用した計算モデル(すなわち、Cox比例ハザードモデル)では、SARS-CoV-2感染予防におけるCOVID-19 2価mRNAワクチンの有効性を確実に評価することはできない。
その計算モデルが適切でないことはともかく、著者らは、パンデミックの進化の軌跡をせいぜい「ずさんなスナップショット」で示したに過ぎない。この研究が対象としたパンデミックの期間においては、BA.2/ 5によるワクチン・ブレークスルー感染と2価ワクチン追加接種の両方が、体液性免疫応答を広範な中和抗体に方向転換させる役割を担ってきた。既に報告されているように、この抗体の中和活性は短命である(https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9793397/)。したがって、本研究で示された2価ワクチンの検査で確認された感染に対する有効性の「スナップショット」は、2価ワクチン接種後の平均観察期間を2ヶ月以上とし(そして十分にサンプル数を増やしていれば!)、有意に減少していた可能性がある。
COVID-19ワクチン接種者における免疫再集中は、2価ワクチン接種前、あるいは接種後に起こったワクチン・ブレークスルー感染によって、研究開始よりも前に起こった可能性があるため、このような以前の曝露が、2価ワクチンに起因するとされたワクチン有効性の主な要因であった可能性は否定できない。オミクロンBA.4/5の時期にはワクチン・ブレークスルー感染が頻繁に起こっていたため、(新しい抗体の惹起による)(短期間の)ウイルス中和によって、本研究で報告された2価ワクチンの有効性は著しく過大評価となった可能性がある。これは「ワクチン更新」研究にはよくあることである。このような研究では、そのような感染が自己申告、あるいは親から申告されることはあまり一般的でなかった可能性があるためである。本研究結果では、実際に(著者らが研究の限界として述べた範囲において)新たなSARS-CoV-2感染に対する2価ワクチンの見かけの有効性に、SARS-CoV-2感染の既往が有利に作用していたことを示唆するように見えるため、このことは重要である。
しかし、より重要なことは、本研究の著者らが、立体的免疫再集中によって誘導された抗体の中和力が長期にわたって低下することによって、高度にCOVID-19ワクチンを接種された集団はウイルスの感染性に強い免疫選択圧力をかけることになり、その結果、新たな、より感染性の高い免疫逃避変異株の出現を促進し、多反応性非中和抗体依存性ウイルス感染増強のために細胞性自然免疫系が十分に訓練されていない全てのCOVID-19ワクチン接種者を危険に曝しているということを理解していないように思われることである。このことは、もちろん、2価ワクチンの追加接種を受けた接種者にも当てはまる。多反応性非中和抗体による病原性抑制効果を克服するSARS-CoV-2変異株が選択されれば、彼らは、重篤なCOVID-19疾患を起こす危険性が高い。
以上に述べた全てと、C-19ワクチンに伴う重大な副作用を考えれば、CDCがこの研究から導きだした結論は、正当化されるものではない。彼らの勧告(「対象となる全ての小児および若者は、常に、推奨される最新のC-19ワクチン接種を受け続けるべきである」)は絶対に受け入れられない。
脚注
[1] RT-PCRにおけるスパイクタンパク質遺伝子の増幅の減少または失敗を、JN.1感染の代替指標とする解析。
[2] この研究は更新型ワクチン接種後7-59日と60-119日のワクチン有効性の統計学的に比較するには検出力が十分ではない。
いただいたサポートは一般社団法人ワクチン問題研究会に寄付されます。
