がん新薬誕生 第3回 化合物選択
取材・執筆:下山進
船橋のつくった独特の評価系で選んだ化合物が臨床治験へと進む。E7080と名づけられたその化合物はしかし、周回遅れのランナーだった。他社の化合物が次々と承認をとる。
プロジェクト名をHOPEと名づけた2000年4月の段階で、すでに化合物は絞られつつあった。
船橋泰博はプロジェクトリーダーであったが、最終的な化合物選択は、合成のチーム長であった鶴岡明彦にまかせることになる。
というのは、翌年の9月に船橋はコロンビア大学の産婦人科に留学することになっていたのだ。船橋は、ここで、新しい作用機序の薬をつくるつもりだったが、船橋のもとで働いている研究所の所員が、どうしても労働過重になってしまうことから、船橋を筑波の研究所から離した、という見方をする人もいた。
船橋に悪気はないが、下でやっていくのは大変だったのだ。
船橋が4年をかけてつくった評価系によって化合物は3つにまで絞られてきていた。これを、人間の肝細胞がんをヌードマウスの腹膜に移植したモデルをつかって、全生存期間(OS)をみる試験の際には、船橋はニューヨークに去り、鶴岡がかわりにプロジェクトリーダーとなっていた。
鶴岡は、化合物の合成では天才的なセンスを見せるが、管理職としても有能な常識人だ。
プロジェクトリーダーの最後の務めは、安全性評価や、薬物動態のチームとも連携をとりながら、薬を臨床までもっていくことだ。
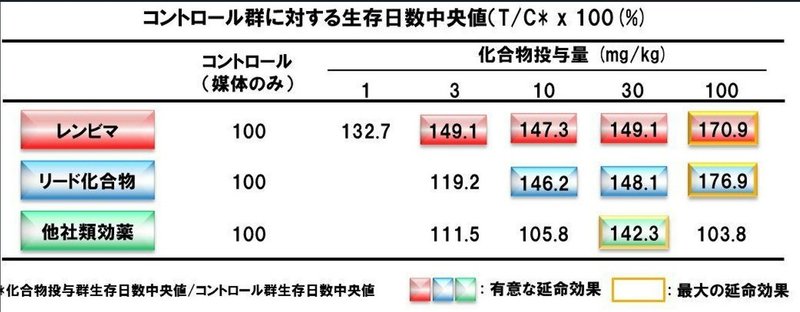
その鶴岡のもとで、評価系のチームがこのマウスのモデルをつかい、リード化合物、化合物661番、そして他社が特許登録をした類効薬を、それぞれ最長9週間、連続投与してその全生存期間を比較したのである。
後にレンバチニブ(商品名レンビマ)と名づけられる661番は、3ミリグラムという少ない投与量で、全生存期間が149.1日と、他の化合物を、1カ月以上上回っていることに、鶴岡は着目した。
これは少ない容量で、効くということだ。容量が少なければ副作用も少ない。100ミリグラム投与の群でこそ、元のリード化合物に、全生存期間で、6日負けているが、臨床に進むとすれば、この661番しかない。
GCCを通過する
エーザイでは、新規の化合物を臨床の治験進めるか否かの会議を1996年からグローバルで行うことになっていた。アリセプトの時代では、筑波の研究所の会議がその「関門」の会議にあたっていた。アリセプトの成功で一気にグローバル化したエーザイは、アメリカや欧州にも研究拠点をもち、臨床治験もグローバルな規模でやらなければならない、ということで、この「関門」の会議も日米欧にまたがる会議となっていた。
新規テーマの開発内定および既存テーマの開発中止など具体的な臨床研究計画についてはGlobal Clinical Committee(GCC)の審議を通過する必要がある。
2002年8月6日の会議は、日本は筑波で、欧州はロンドン、米国はニュージャージー州のティーネックにあったエーザイのアメリカの拠点で、テレカンフェレンスで行われた。時間は三極にあわせるとなると、米国が朝の7時、日本が夜の8時、ロンドンが昼の12時が開始時間となる。
この会議でもアメリカの臨床チームから、「いまさらミーツーをやっても面白くない」という意見がでた。すでに、血管新生阻害剤は、他社のいくつかの薬が治験に入り、効果がないとドロップされている状態だった。
鶴岡は、ここで、化合物661番は、他のメガファーマとは違う独自の評価系で選ばれた化合物なのだということを強調した。
実際にシャーレの中で臍帯の内皮細胞をつかった系を使っているために、化合物661番は、複数の血管新生因子を阻害することがわかっていた。
VEGFをもっとも強く阻害し、FGFをある程度阻害する。複数の血管新生の因子を阻害していること、しかも、FGFが「ある程度」ということが重要だと鶴岡は考えていた。両方ともに、強く阻害していたらば、毒性が強すぎてしまっただろう。VEGFの阻害の5分の1程度FGFも阻害する。後にエーザイのがんグループを常務執行役として率いることになる大和隆志はこれを「神の配合」と呼んでいた。
このようにして、化合物661番は、GCCを通過し、臨床開発(治験)の番号がふられることになった。
エーザイでは、四桁の番号で治験に進んだ化合物を表す。神経領域の薬は2000番台で、アリセプトはE2020の番号をふられた。がんの分野は7000番台。化合物661番はこの会議から、E7080と呼ばれることになる。
コロンビア大学に留学していた船橋は、661番が選ばれたことや、GCCを通過したことは、評価グループの後輩からのメールで知った。船橋のコロンビア大学への留学は結局6年の長きにわたることになる。
次々と他社に出し抜かれる
薬の治験は、通常三段階をへる。フェーズ1では、安全性と適性容量を見る。フェーズ2で小規模の集団で、比較盲検試験をして、たとえばプラセボ群や先行薬との比較をみる。ここで、効果が発揮できなければ、開発は中止となる。すでにがんグループでは、E7820という血管新生阻害剤の第一世代が臨床治験に入っていたが、フェーズ2で効果が認められず、事実上の開発中止状態においこまれていた。
のちのレンビマ「E7080」はフェーズ1に入る。しかしこのフェーズ1をやっている最中に、血管新生阻害剤の分野で、初めて承認される薬が出てくる。
アバスチンである。
これは、VEGFという物質の抗体だ。抗原であるVEGFにくっつくことで無力化し、血管新生を阻害、がん細胞の成長を抑えるというメカニズムである。スイスのロシュ社が開発した。まず大腸がんへの承認が、米国で2004年2月26日におりた。
現代の薬はおおきくわけて二種類ある。抗体薬と低分子薬だ。血管新生阻害剤の分野で、“ファースト・イン・クラス“と呼ばれる一番手は、抗体薬が制したのである。
ついで低分子薬も、つぎつぎに承認を得る薬が出てくる。
バイエル薬品のソラフェニブが2005年、ファイザーのスニチニブが2006年に腎細胞がんで承認される。
低分子薬の利点は、抗体薬にくらべて製造原価が安価ですみ、経口剤としてあつかいやすいという点になる。抗体薬の場合、点滴や注射で人体に与えるのが普通だ。
その低分子薬の分野でも、ファースト・イン・クラスは他社にとられてしまったことになる。
新しい作用機序の薬が、あるがんで承認をされると、それが標準治療となる。ここに参入しようと思えば、その薬との比較の治験をくまなければならない。それはとても難しい。
エーザイのがんグループは、他社の血管新生阻害剤の承認のニュースを重苦しい空気の中で聞いた。
船橋、鶴岡らの90年代からの苦労は水の泡になるのか?
特許の崖の前で
祖母を第一世代の抗がん剤の副作用で失ったことが理由で、エーザイに1991年に入社した大和隆志は、2000年代後半になると、がん研究のグループの幹部としてメキメキ頭角を現してきた。
そのころのエーザイは、「アリセプト」の成功で、2009年には、全社の売上が、8032億円にもなった。しかし、アリセプト以降、新薬を上市できていない。
新薬の特許の存続期間は申請後20年と決まっていた。
アリセプトの特許は、米国でまず2010年に切れ、日本でも2011年そして欧州では2012年に切れることになっていた。
新薬の特許が切れると、ジェネリックの専門メーカーや他社が、いっせいにアリセプトのジェネリックをつくり、安価で販売を始める。そうなれば年間3000億円を越えていたアリセプトの売上は急激に収縮するだろう。
会社は売上にしたがって、人や設備を増やしている。特許切れにともなう急激な売上の縮小を「特許の崖」と呼んで、製薬会社は恐れていた。
エーザイは、崖のふちまできていたのである。
大和は、そうしたなか、がんグループから上市を狙えるとすれば、E7080しかないと思っていたが、社内外の評判はよくなかった。
2009年7月に、大和は、米国ニュージャージー州に赴任していたが、アメリカの製薬会社の人たちと話すと、「もう低分子薬が二薬も承認されているんだから、何十億かけて治験をやるのはクレージー」とあきれられた。社内でも、「かりに承認されても売り物にはならないだろう」と非難される。
エーザイでがん研究が始まってから、23年がすぎようとしていたが、がんグループは、まだひとつの薬も市場に送り出していなかった。
大和は鶴岡や船橋に一年遅れた91年入社だが、東大で薬学博士をとってから、エーザイに入社しているから、鶴岡や船橋よりも年上だった。
大和も、鶴岡と同様に、船橋の異様ともいえる4年のこだわりの末にできた評価系をかいくぐった化合物なのだから、欧米の合理主義でつくった薬には負けないと思っていた。
製薬の世界では、ファースト・イン・クラスという言葉の他に、ベスト・イン・クラスという言葉がある。一番手としてその疾病に承認された薬がファースト・イン・クラス、ベスト・イン・クラスとは、一番手にならずとも、結果的にもっともよいパフォーマンスで、その疾病の標準治療として定着する薬のことだ。
たとえば、エーザイの「アリセプト」は、ファースト・イン・クラスではなかった。その前にワーナーランバートの「タクリン」という薬が承認されていた。しかし、この薬は、肝臓に対する毒性が強く、「アリセプト」が承認されると、一気に「アリセプト」におきかわっていった。「アリセプト」はベスト・イン・クラスとしてグローバルな売上をあげるようになったのである。
大和は、「E7080」がベスト・イン・クラスになればいい、と考えていたのだ。
「崖の年」がくる
フェーズ3をどのがん種でやるかが問題だった。
がんはアルツハイマー病とは違って、すでに手術、放射線治療、抗がん剤の標準治療が存在する。したがって、狙うとすれば、これらの標準療法では対処できない難治性のがんしかない。
そうでなければ、プラセボ群を用意するような治験はそもそも成立しないし、患者はわざわざ、標準治療との比較で効くかどうかわからない新薬の治験に参加しないからだ。
大和が考えたのが、悪性黒色腫(メラノーマ)だった。このがんは、放射線治療も手術も難しく、抗がん剤もきかない。1975年に承認されたダカルバジンという抗がん剤があったが、15~20パーセントの奏効率しかなく、生存期間の延長には効果がなかった。
E7080は、フェーズ2の治験で、メラノーマでも効果をあげていた。
2009年7月、プロジェクトHOPEの国際チームの臨床部門の責任者ジム・オブライエンとともに、大和は、メラノーマでフェーズ3を行うよう、会社に提案され承認される。
年があけて、アリセプトの特許がきれる「崖の年」2010年がきた。
「タイムラインを変えたらくびだ」
エーザイでは、決算説明会とは別にCEOの内藤晴夫が、記者やアナリストに大枠の方針を説明し、懇親をするインフォメーション・ミーティングという会を毎年3月にもうけていた。その直前に大和は内藤にこう聞かれる。
「おい、E7080、フェーズ3はなんのがんでやるんだ?」
「メラノーマでやることに決めました」
「インフォメーション・ミーティングで言うぞ」
このようにして、3月のインフォメーションミーティングで、E7080のフェーズ3はメラノーマでやることが発表され、5月の決算説明会でも、同様の説明が内藤によってなされた。
ところが、その一カ月後の6月、アメリカ臨床腫瘍学会で衝撃的な発表を大和は目にすることになる。
イピリムマブという他社開発の薬が、すでにメラノーマに対して成果をおさめつつあるという報告だった。さらに、ベムラフェニブという薬の治験で、治験に参加した医師たちが、成果をおさめつつあると興奮をもって語っているという報告も入ってきた。
となると、そもそも、E7080はメラノーマで治験に入ることは無理ということになる。
実際、ベムラフェニブのフェーズ3の結果が、翌年アメリカ臨床腫瘍学会で発表になるが、これをみれば、E7080の治験の計画は根本から崩れていたことがわかる。
がんの薬の治験の評価項目は、全生存期間(OS)やがんの進行がとまっている期間を見るPFSなどの指標があるが、ベムラフェニブは、1975年承認のダカルバジンとの比較試験の結果ではっきりと優位性を示していた。
がんの薬は、まず難しいがんで承認をとったあと、その適応範囲を広げていくことで販路を広げるのだが、その入口としていたメラノーマの門が閉じたことを大和は知ったのである。
大和はあわてて、内藤に報告する。
内藤はこう言った。
「どんながんでもいい。とにかく治験に入れ」
「タイムラインは変えるな。変えたらくびだ」
「今ならば対象群はプラセボだ」
それから、大和は、さまざまながんの学会に顔をだし、E7080をどのがんで治験をしたらばいいかを探った。
3カ月後の2010年9月のパリ。国際甲状腺学会にジム・オブライエンや「HOPE」国際チームのメンバーと一緒に参加したときのことだ。
この学会で、大和は、すでに腎細胞がんと肝細胞がんで承認をとっていた血管新生阻害剤のソラフェニブが、甲状腺がんでもフェーズ3に入っているという情報をキャッチする。
甲状腺がんは、他のがんにくらべて患者数は多くはない。しかし、放射性のヨウ素をのませるくらいしか治療法がなく、放射線耐性をつけてしまったがんにはもうお手上げだった。
だから、甲状腺がんとめぼしをつけてその学会に出たのだが、ソラフェニブが承認をとってしまえば、もうチャンスはなくなる。
甲状腺がんの学会は、パリ南大学にある難治性甲状腺がん関連センターのマルティン・シュルンベルジェが理事長としてしきっていた。シュルンベルジェは、チェルノブイリ原発事故後の子どもの甲状腺がんの発症について、現地で調査をしたこともある、甲状腺がんの世界的権威だ。
初日の休憩時間のことである。ジム・オブライエンは、このシュルンベルジェのところに近づいていって「これうちが開発中の薬です。見てくれませんか」と資料を渡そうとした。
最初の反応はつれなかった。「VEGFをターゲットにした低分子薬ならば、もうソラフェニブがフェーズ3に入っているじゃないか、何をいまさら」という感じだった。
しかし、ジムが「ハンドアウトだけでもうけとってくれませんか」というと受け取ってくれた。
諦めていたが、翌日、シュルンベルジェから連絡があったのである。
「モンパルナスの高層ビルのうえにワインをのませるところがあるが、そこにきてくれれば、話を聞く」
パリ南部にある59階建ての高層ビルトゥール・モンパルナス。その56階には、「Le Ciel de Paris」というフレンチのレストランがあった。
パリの街を360度でみおろすことのできるそのレストランに、シュルンベルジェはやってきた。
大和とジム・オブライエンは緊張してテーブルに座っている。
料理とワインを頼むと、シュルンベルジェは前日のE7080の資料をテーブルのうえにバサッとおいた。そしてにやっと笑ったのである。
「これ面白いな」
「ソラフェニブが甲状腺がんでフェーズ3に入っているのは知っているな。もし君たちが今、甲状腺がんでフェーズ3をやるというのなら、やってもいいぞ」
「今ならば、対象群はプラセボだ」
つづく
証言者 主要参考文献
大和隆志、船橋泰博、鶴岡明彦、Martin Schlumberger
Phase I Dose-Escalation Study of the Multikinase Inhibitor Lenvatinib in Patients with Advanced Solid Tumors and in an Expanded Cohort of Patients with Melanoma, David S. Hong, Razelle Kurzrock, Jennifer J. Wheler1, Aung Naing, Gerald S. Falchook, Siqing Fu, Kevin B. Kim, Michael A. Davies, Ly M. Nguyen, Goldy C. George, Lucy Xu,Robert Shumaker, Min Ren, Jennifer Mink, Cynthia Bedell, Corina Andresen,Pallavi Sachdev, James P. O'Brien4, and John Nemunaitis, American Association for Cancer Research. June 6, 2016.
Phase 1b study of lenvatinib (E7080) in combination with temozolomide for treatment of advanced melanoma, David S. Hong, Razelle Kurzrock, Gerald S. Falchook, Corina Andresen,Jennifer Kwak, Min Ren, Lucy Xu, Goldy C. George, Kevin B. Kim, Ly M. Nguyen,James P. O’Brien, John Nemunaitis, Oncotarget , October 15, 2015,
