高校無機化学#9(16族)~酸素~
どうも。今回からは、16族元素(O, S)について。まずは、Oから。
①O₂(酸素)
(性質)
酸素は、沸点-183℃の無色気体である。Oの電気陰性度が大きいため、反応しやすく、酸化物を作る反応が起こりやすい。
(製法)
1つ目の製法は、液体空気の分留。空気中の成分として存在する物質は、液体空気を分留することで得られる。
次に、化学反応を用いてO2を作る場合、

5個のうちの、自己酸化還元反応の2つ目と3つ目である。1つめは、#1の塩素と水の反応であった。残念ながら、自己酸化還元反応は暗記せざるを得ない。(半反応式に分けて書けないため。)
また、MnO2が無機触媒として利用される2つの反応であることも覚えておきたい。
さらに、下の反応で加熱が必要なのは、KClO3が固体だからである。固体は放っておいても反応しないので加熱してやる必要がある。
②O₃(オゾン)
(性質)
オゾンは酸素の同素体である。同素体を持つのは、「S, C, O, P」元素である。
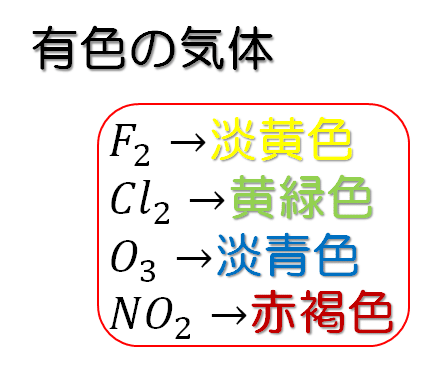
オゾンは淡青色の有毒気体である。ここで、#1でみたように、有色の気体は、フッ素:淡黄色、塩素:黄緑色、オゾン:淡青色、二酸化窒素:赤褐色の4つのみである。
オゾンは、酸化剤として働き、中性条件下での半反応式は次のようになる。

(補足)半反応式の作り方の方法に従って、半反応式を作ると、

という風に書くことが出来る。
この反応式を別の見方で書くことを考えてみる。
まず、オゾンの電子式は次のようになる。

非共有電子対の反発によりオゾンは非常に不安定である。したがって、次の(1)反応のように酸素分子と酸素原子に分かれる。

Oは電気陰性度が大きいため、酸素原子は2価の陰イオンとなる次の(2)反応が起こる。

(1)+(2)より、

ここで、酸化物イオンO2-は水中では水と反応して、水酸化物イオンに変わる反応(4)が起こる性質があるから、

(3)+(4)より、

となって、同じように半反応式を作ることが出来た。この半反応式は、ヨウ素滴定でよく出てくる。
また、有機化学では、オゾンによって、アルケンを酸化し、二重結合の場所を特定するのに使われる。
(製法)
実験室では、酸素中で無声放電を行うことにより生成する。
また、地球の上空にあるオゾン層は、大気の酸素に強い紫外線が当たってできる。

酸素はこれだけでOK.お疲れサマー。
この記事が参加している募集
この記事が気に入ったらサポートをしてみませんか?