
6-5. 中和滴定(1)
こんにちは、おのれーです。
今回は、酸と塩基が中和するときの量の関係を利用して、濃度の分からない溶液の濃度を求める方法について見ていきたいと思います。
■酸と塩基がちょうど中和するときの量って?
そもそも中和ってどのような反応だったでしょうか?
↓
↓
↓
6-3.中和反応 でも確認したように、中和反応とは、酸のH+と塩基のOH-が反応して、水H2Oができ、互いの性質を打ち消し合う反応です。
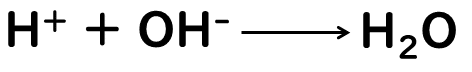
水H2Oを1個作るには、H+とOH-がそれぞれ1個ずつ必要です。なので、酸と塩基がちょうど中和するためには、「酸から出たH+の数=塩基から出たOH-の数」という関係になる必要があります。
化学で、粒子の数を数える時に使う単位と言えば、物質量[mol]。
ということで、上の文章を言い換えると、酸と塩基がちょうど中和するためには、「酸から出たH+のmol=塩基から出たOH-のmol」という関係になる必要がある、ともいうことができます。
では、酸から出たH+のmolや、塩基から出たOH-のmolは、どのようにして求めればよいのでしょうか?
例えば、塩酸HClは、次のように電離して、HCl 1個につき、H+を1個出すことができます。

言い換えると、1 molのHClは、H+は1 molを出すことができるということができます。
また、硫酸H2SO4は、次のように電離して、H2SO4 1個につき、H+を2個出すことができます。

言い換えると、1 molのH2SO4は、H+ 2molを出すことができるということができます。
このように、酸1個当たり何個のH+を出すことができるかを表したものを、「酸の価数」といっていました。塩酸HClは1価の酸、硫酸H2SO4は2価の酸です。
つまり、もともとの酸の個数(mol)に、この価数をかけてあげれば、酸から出たH+のmolを求めてあげることができます。これは、塩基についてもいえることです。
したがって、中和点における「酸から出たH+のmol=塩基から出たOH-のmol」という関係は、次のように表すことができます。

ここで、ちょっと問題に挑戦してみましょう。

それぞれの酸や塩基の化学式がかけて、何価の酸・塩基なのかが分かれば、さほど難しくないと思います。ここでもやはり、化学式が書けることが大事なのです。
■水溶液同士の中和反応で考えてみると?
アレニウスの酸と塩基の定義を覚えていますか?

この定義には「水溶液中で電離して」という言葉が入っており、酸と塩基の反応が水溶液中で起こることが前提とされています。
必ずしも中和反応が水溶液どうしの反応とは限らないのですが、水溶液どうしで起こる反応であることは非常に多いです。
そこで、中和点での「酸から出たH+のmol=塩基から出たOH-のmol」という関係を、水溶液どうしの反応について考えてみたいと思います。
水溶液は、その中に何molの溶質が溶けているかは "モル濃度[mol/L]" で表されます。モル濃度とは、"溶液1 Lに何molの溶質が溶けているか" を表したものですので、molを知るためには、同時に溶液の体積[L]も分かっている必要があります。
モル濃度から、molを求めるには、モル濃度×体積をしてあげればOKです。

というわけで、中和点での「酸から出たH+のmol=塩基から出たOH-のmol」という関係は、次のように表すこともできます。

ではここでも、少し問題に挑戦してみましょう。

■濃度が分からない溶液の濃度を求めてみよう!
「酸から出たH+のmol=塩基から出たOH-のmol」の関係を利用すると、酸と塩基、どちらか一方の濃度がわかっていれば、もう一方の水溶液の濃度を求めることができます。このような操作のことを中和滴定とよんでいます。
中和滴定は次のような手順で行います。
① 濃度が分からない酸(または塩基)の水溶液を、ホールピペットで一定体積はかりとり、コニカルビーカーに入れ、指示薬を加える。

② メスフラスコを使って、濃度の分かっている塩基(または酸)の標準溶液をつくる。

③ ビュレットに濃度の分かっている塩基(または酸)の水溶液を入れ、コニカルビーカーに滴下する。

④ 中和点までに滴下した溶液の量(体積)を求める。

⑤ 「酸から出たH+のmol=塩基から出たOH-のmol」の関係から、濃度を求める。

ちなみに、濃度が分からない溶液をビュレットに、濃度が分かっている溶液をコニカルビーカーに入れて滴定する場合もあります。
では、ここで問題を解いてみましょう。

■中和点はどうやったら分かるのか?
中和滴定のとき、ただ酸と塩基の溶液を混ぜ合わせただけでは、どの程度中和が起こっているかは分かりません。では、どうすれば中和点を見極めることができるのでしょうか?
中和点を見極めるためには、「指示薬」と呼ばれる薬品を使います。
指示薬は、pHによって色の変わる薬品です。
例えば、BTB溶液であれば、酸性が黄色、中性が緑色、塩基性が青色です。フェノールフタレイン溶液は、酸性・中性では無色、塩基性では赤色ですし、メチルオレンジ溶液は、酸性で赤色、中性・塩基性では黄色です。
中和点の前後では、pHが大きく変化するので、指示薬の色の変化によって、中和点がどこかを知ることができます。実際に実験をしてみると、1滴でも色が大きく変化してしまうくらい繊細な変化です。
ちなみに、中和で生じる塩の種類によって、中和点は酸性側、中性、塩基性側に分かれるので、それに応じた指示薬の選択が必要です。
中和滴定において、加えた酸または塩基の水溶液の体積と、混合した後の水溶液のpHとの関係を表したグラフを滴定曲線(中和滴定曲線)といいます。これと、指示薬がどこのpHで変色するのかを重ね合わせて考えてみると、どの指示薬を選択すればよいか、わかりやすいかと思います。
・強酸+強塩基の場合:中和点は中性、中和点前後のpHの変化は大きい
→フェノールフタレインもメチルオレンジも両方使える

・強酸+弱塩基の場合:中和点は酸性、中和点前後のpHの変化は大きい
→メチルオレンジのみ使える

・弱酸+強塩基の場合:中和点は塩基性、中和点前後のpHの変化は大きい
→フェノールフタレインのみ使える

・弱酸+弱塩基の場合:中和点は中性、中和点前後のpHの変化は小さい
→指示薬での判定は難しい

滴定曲線の形と、指示薬の変色域をイメージできると、どの指示薬が使えるかどうかはわかりやすいかなと思います。覚えておきましょう。
今回はここまでです。お疲れさまでした。
最後にワンポイントチェック
1.酸と塩基がちょうど中和するときの量的関係はどうなっている?
2.中和滴定とはどのような操作か?
3.中和滴定に使う器具の中で、共洗いして使わなければいけない器具を2つあげるとすると?
4.強酸+強塩基のときに使える指示薬は?
5.強酸+弱塩基のときに使える指示薬は?
6.弱酸+強塩基のときに使える指示薬は?
次回は、中和滴定の応用問題を扱っていきたいと思います。お楽しみに!
この記事が気に入ったらサポートをしてみませんか?
