
6-6. 中和滴定(2)
こんにちは、おのれーです。
前回は、酸と塩基の中和点における量的関係を使って、濃度の分からない酸(もしくは塩基)の溶液の濃度を求める方法、「中和滴定」について確認しました。
今回は、その中和滴定の応用編を見ていきたいと思います。
■中和点がいくつも存在する反応がある??
ふつう、酸と塩基が反応するときには、ちょうど中和する量(=中和点)は1つだけですが、中和滴定を行う際、複数の中和点が存在する反応があります。
1番有名なのは、炭酸ナトリウムNa2CO3と塩酸HClの反応です。炭酸ナトリウムは、炭酸H2CO3(弱酸)と水酸化ナトリウムNaOH(強塩基)からなる塩なので、塩基性を示します。なので、強酸である塩酸とは中和反応をします。
このとき、反応は次のように2段階で起こります。
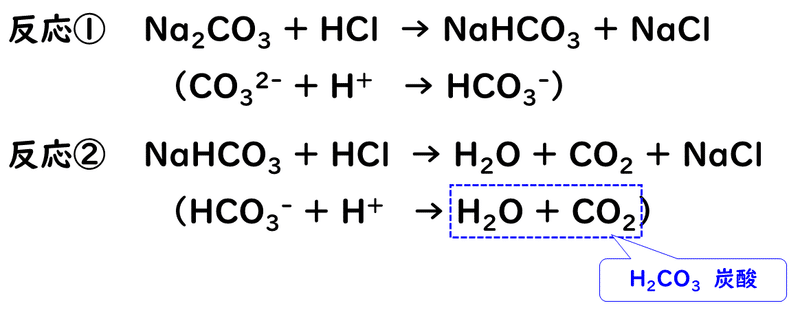
このとき、反応①と反応②は異なるpHの領域で起こるため、中和滴定曲線は、次のようになります。
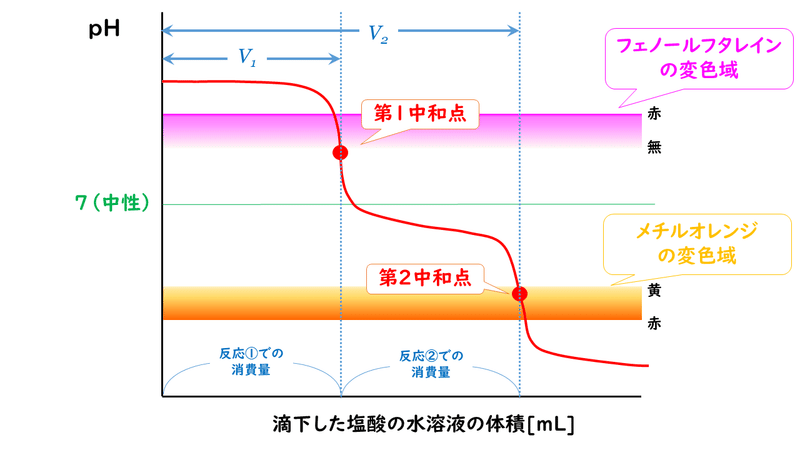
反応①がちょうど起こるところを第1中和点、反応②がちょうど起こることろを第2中和点とすると、第1中和点ではフェノールフタレインの色の変化が、第2中和点ではメチルオレンジの色の変化が見られることで、中和点を判断することができます。
また、反応①では、化学反応式の係数比が Na2CO3:HCl:NaHCO3=1:1:1となるので、仮にNa2CO3がa [mol]反応したとすると、Na2CO3とちょうど反応したHClもa [mol]、生成したNaHCO3も a [mol]になります。
反応②のNaHCO3は、反応①で生じたものですので、a [mol]あることになります。反応②でも、化学式の係数比がNaHCO3:HCl=1:1であるので、a [mol]のNaHCO3が反応したとすると、ちょうど反応したHClもa [mol]になります。
つまり、第1中和点までに滴下したHClの量 V1と、第2中和点までに滴下したHClの量 (V2-V1) は等しいといえます。
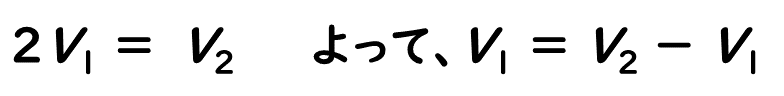
■塩基を使って、塩基のmolを求める方法とは?
普通の中和滴定は、酸(または塩基)に、塩基(または酸)を滴下していって、最終的に中和点での量的関係から、未知の溶液の濃度を求めるということが多いです。
しかし、アンモニアNH3や二酸化炭素CO2など、気体の物質を使って中和滴定をする時には、コニカルビーカーやビュレットに一定量の気体をはかり取ることはできませんから、少しまわりくどい方法で調べる必要があります。
例えば、発生したアンモニアのmolを特定するときに、どのように調べればよいのかを考えてみます。
アンモニアは塩基性を示す気体ですので、まず酸性の水溶液にすべて吸収させてしまいます(中和反応)。
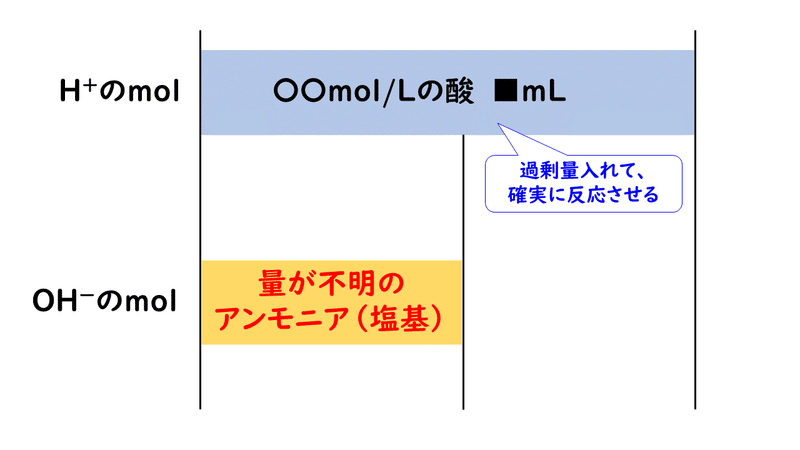
ただしこのとき、アンモニアをすべて反応させるために余裕なだけの酸を加える必要があるので、アンモニアを吸収させた後の溶液は、酸が過剰な状態になっています。
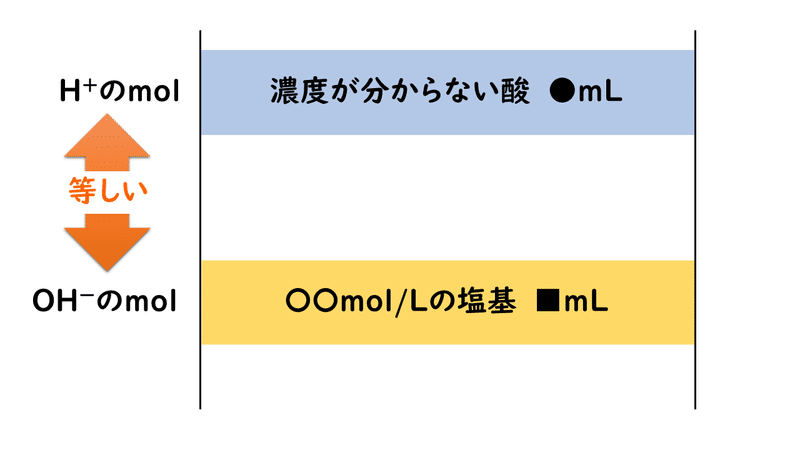
そこで、この過剰量の酸を、別の濃度が分かっている塩基の水溶液を使って中和滴定します。
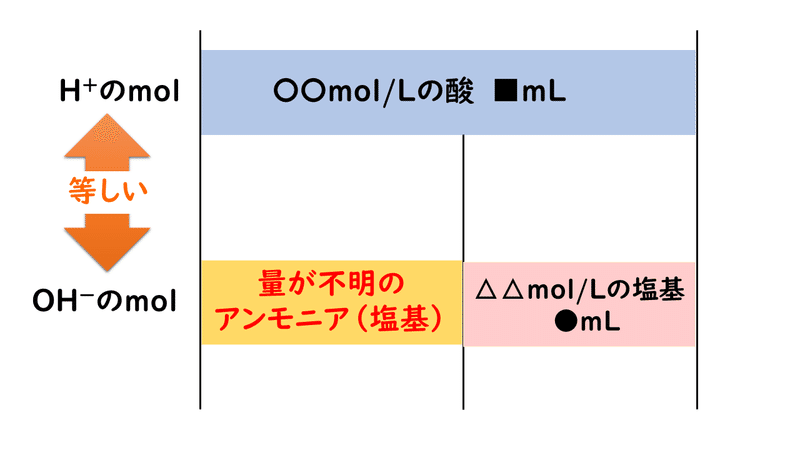
すると上図にあるように、結果として、1種類の酸を2種類の塩基で中和したことになるので、次のような関係式を立てることができ、これによりアンモニアの量を特定することができます。

この方法は、タンパク質中の窒素Nの量を求めるときなどに利用され、逆滴定と呼ばれています。
では実際に、問題を考えてみましょう。
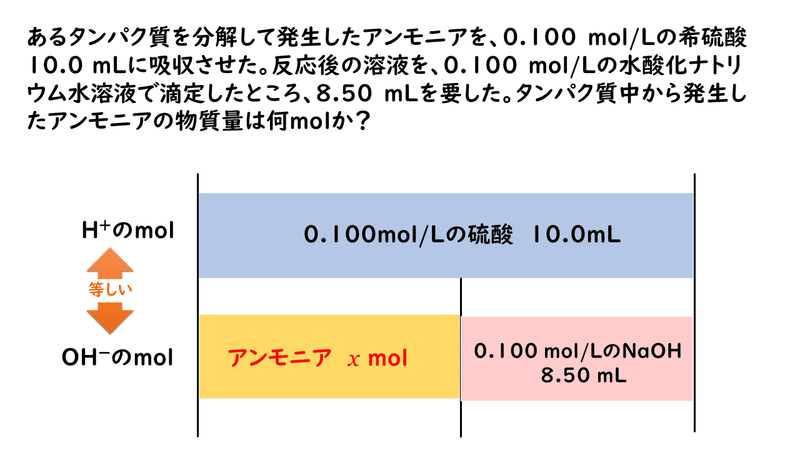

いろいろ応用していくと、便利なこともあるのですね。
少し複雑に感じるところもあると思いますが、使いこなせると楽しいと思うので、頑張りましょう!
今回はここまでです。
これで6章も終わり。次回からはいよいよ最終章「酸化還元反応」に突入です。お楽しみに!
この記事が気に入ったらサポートをしてみませんか?
