
6-4. 塩とその性質
こんにちは、おのれーです。
前回は、酸と塩基を反応させると、水と塩(えん)が生じて、互いの性質を打ち消し合う、中和反応とよばれる反応が起こることを確認しました。
今回は、この塩に注目をしていきたいと思います。
■塩って"しお"のことではないの?
「塩」という文字を見ると、「しお」と読みたくなるのですが、化学では「えん」と読みます。
では、そもそも「塩」とはどのようなものなのでしょうか?
化学の世界で「塩」というものは、”酸が電離して生じた陰イオンと塩基が電離して生じた陽イオンがイオン結合してできた化合物"のことを指します。
たとえば、塩酸HClと水酸化ナトリウムNaOH水溶液の中和反応では、次のような反応によって、水のほかに、塩化ナトリウムNaClという塩ができます。
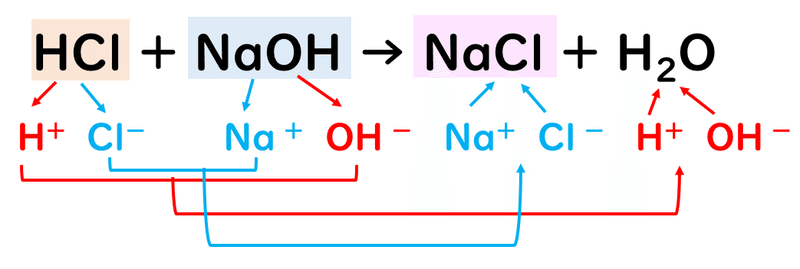
んん??
塩化ナトリウムって、食塩のことですよね。なんだ、塩(しお)じゃん。と思うかもしれないですが、ここは、塩(えん)でお願いします。
というのも、塩化ナトリウムも、塩酸が電離して生じたCl-という陰イオンと、水酸化ナトリウムが電離して生じたNa+という陽イオンがイオン結合によって結びついてできた物質ですので、塩(えん)の定義に当てはまっているからです。
塩(しお)と言ってしまうと、「塩化ナトリウム」だけを指してしまいがちですが、塩(えん)というと、もう少し対象が広がるんだ、と思ってみて下さい。
例えば、次の2つの反応で、塩に当てはまる物質は何でしょうか?
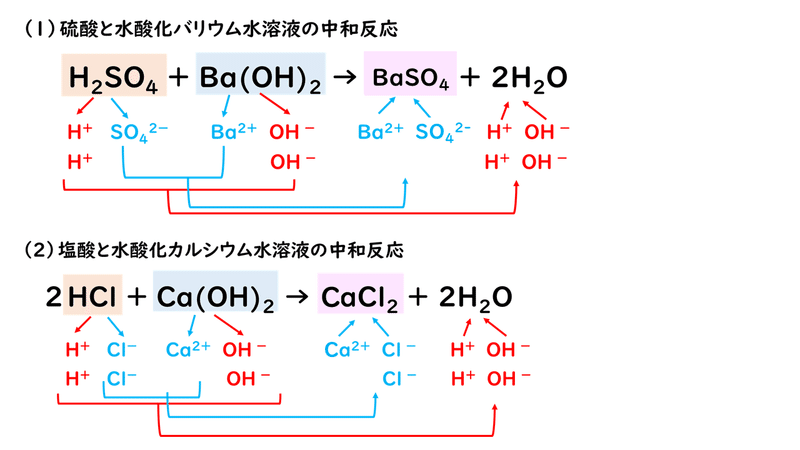
答えは、(1)が硫酸バリウムBaSO4、(2)が塩化カルシウムCaCl2です。中和反応によってできる塩の場合は、水じゃない方の生成物、と考えてもよいかもしれませんね。
■塩の種類には3つある!
化学はグループ分けが好きな学問なのですが、塩についても3つのグループに分けることができます。
1つ目は、酸性塩です。硫酸水素ナトリウムNaHSO4のように、化学式中に酸のHが残っている塩のことをいいます。
2つ目は、塩基性塩です。塩化水酸化マグネシウムMgCl(OH)のように、化学式中に塩基のOHが残っている塩のことをいいます。
この2つにあてはまらないものを、正塩といい、塩化ナトリウムのように、化学式中に酸のHも塩基のOHも残っていない塩のことをいいます。
単純に、化学式を見た時に、余計なHやOHが残っていないかを見ることで、判別可能です。
ただし、この名前ですが「酸性塩」「塩基性塩」など、あたかも水に溶かしたらそれぞれ、酸性、塩基性になる塩と思いがちですが、必ずしもその水溶液が酸性になったり、塩基性になったりすることはありません。あくまでこの名称は、塩が何でできているのかを考えてつけられたもので、水溶液の性質には関係しないと思っておいてください。
例えば、炭酸水素ナトリウムNaHCO3は酸性塩ですが、酸性を示すどころか、弱い塩基性を示します。
■中和点で中性以外になることがある??
前回、「中和点でも中性にならないことがある」というお話をしました。なぜ、中和することで酸と塩基の性質がそれぞれ打ち消し合われているはずなのに、中性にならないのでしょうか?
実は、それには酸と塩基の強弱の組合せが関係しているのです。
下図のように、強酸と強塩基からなる塩の水溶液は中性、強酸と弱塩基からなる塩の水溶液は酸性、弱酸と強塩基からなる水溶液は塩基性を示します。
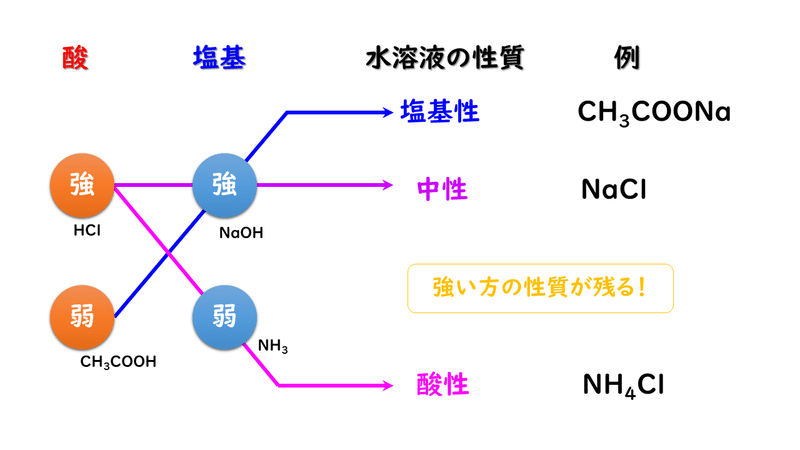
かんたんにいってしまうと、「強い方」の性質が勝つ!と言えるかと思います。
では、なぜこのようなことが起こるのでしょうか?
塩は、先ほど確認したように、「酸から出た陰イオンと塩基から出た陽イオンが結びついてできた物質」です。実は、塩の材料となっている酸が弱酸の場合は陰イオン、塩基が弱塩基の場合は陽イオンが、中和点での性質を中性にさせない原因となっています。
では、具体例をあげて考えてみましょう。
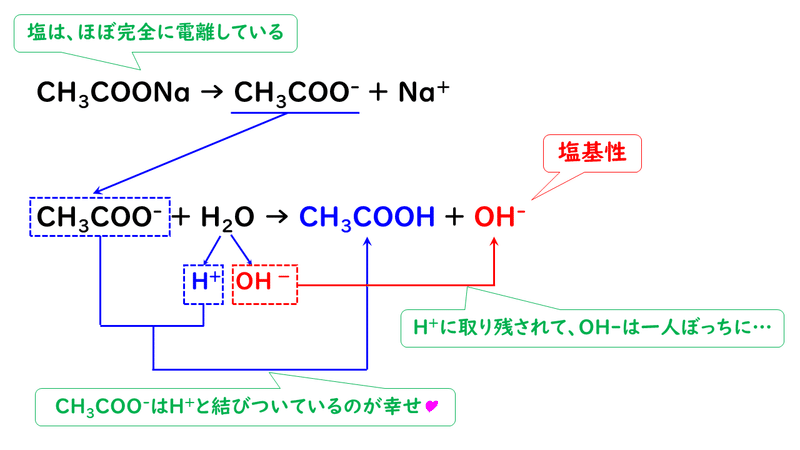
酢酸CH3COOHと水酸化ナトリウムNaOHを反応させると、酢酸ナトリウムCH3COONaという塩ができます。
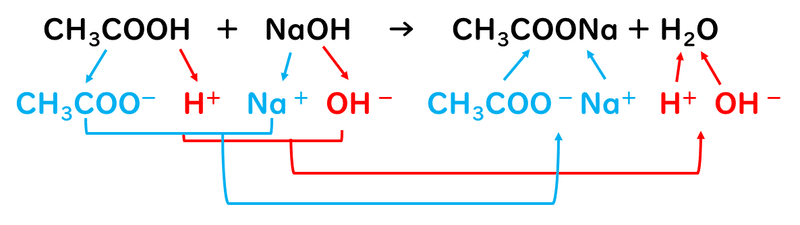
生じた酢酸ナトリウムは、イオン結合でできている物質であり、水に溶けるとほぼ完全に電離して、酢酸イオンCH3COO-とナトリウムイオンNa+に分かれます。
このとき、ナトリウムイオンは水溶液中で電離してイオンのまま存在しますが、酢酸イオンはイオンでいるよりも、H+と結びついて酢酸CH3COOHでいる方が幸せなので、水H2OからH+を奪って酢酸になってしまいます。これは、水酸化ナトリウムが強塩基で電離度が大きいのに対し、酢酸は弱酸で電離度が小さく、イオンでいるよりも分子でいたいという物質だからです。
水は、H+を奪われてしまうと、水酸化物イオンOH-だけが残ってしまいます。よって、水溶液中にOH-が多い状態になるので、酢酸ナトリウム水溶液は塩基性になります。なので、中和点であっても中性ではなく、塩基性になってしまうのです。
もう一つ、例をあげて考えてみましょう。
塩酸HClとアンモニアNH3を反応させると、塩化アンモニウムという塩ができます。
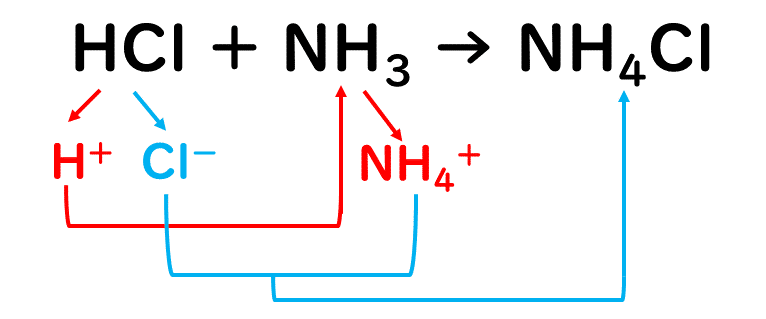
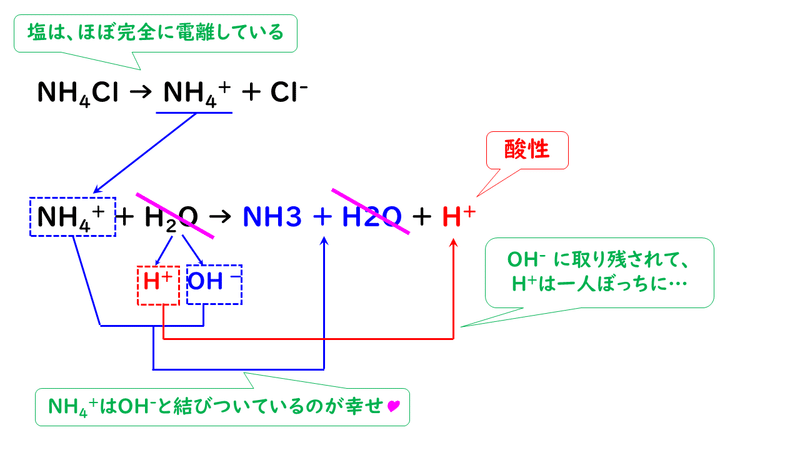
生じた塩化アンモニウムは、イオン結合でできている物質であり、水に溶けるとほぼ完全に電離して、アンモニウムイオンNH4+と塩化物イオンCl-に分かれます。
このとき、塩化物イオンは水溶液中で電離してイオンのまま存在しますが、アンモニウムイオンはイオンでいるよりも、OH-と結びついてアンモニア水NH3+H2Oでいる方が幸せなので、水H2OからOH-を奪ってアンモニア水になってしまいます。これは、塩酸が強酸で電離度が大きいのに対し、アンモニアは弱塩基で電離度が小さく、イオンでいるよりも分子でいたいという物質だからです。
水は、OH-を奪われてしまうと、水素イオンH+だけが残ってしまいます。よって、水溶液中にH+が多い状態になるので、塩化アンモニウム水溶液は酸性になります。なので、中和点であっても中性ではなく、酸性になってしまうのです。
このように、酸と塩基の強弱の組合せによって、できる塩の水溶液の性質が違います。したがって、中和反応でちょうどピッタリ酸と塩基が反応したとしても、できる塩によっては酸性になったり、塩基性になったりするのです。
今回はここまでです。
最後にワンポイントチェック
1.塩(えん)とはどのよなものか?
2.塩はどのようなグループに分けられているか?
3.強酸と強塩基からなる塩の水溶液は何性か?
4.弱酸と強塩基からなる塩の水溶液は何性か?
5.強酸と弱塩基からなる塩の水溶液は何性か?
次回は、中和反応の量的な関係について、もう少し突っ込んで考えてみたいと思います。お楽しみに!
この記事が気に入ったらサポートをしてみませんか?
