
6-1. 酸と塩基
こんにちは、おのれーです。
今回からいよいよ、6章「酸と塩基」に突入します。これまで割と抽象的な話が多かったと思いますが、実際の物質の性質や、化学変化について見ていきます。
■酸性、アルカリ性ってそもそもどんな性質?
「酸性」「アルカリ性」という言葉は日常生活の中でも耳にする機会が多いと思いますが、そもそもどのような性質なのでしょうか?
塩化水素HCl、硫酸H2SO4、酢酸CH3COOHなどの水溶液には、共通する性質として、
・酸味を示す
・青色リトマス紙を赤く変色させる
・マグネシウムや亜鉛などの金属と反応して水素を発生させる
という性質があります。これらの性質のことを「酸性」といい、酸性を示す物質のことを「酸(acid)」といいます。
一方、水酸化ナトリウムNaOH、水酸化カルシウムCa(OH)2、アンモニアNH3などの水溶液には、次のような性質があります。
・苦みを示す
・酸と反応して酸性を打ち消す
・赤色リトマス紙を青く変色させる
・タンパク質を溶かす
これらの性質を塩基性と言い、塩基性を示す物質のことを「塩基(base)」といいます。ちなみに、塩基のうち、水に溶けやすいものをアルカリとよび、その性質をアルカリ性といっています。
■酸と塩基の定義は、一つじゃない!
では、具体的にどのような物質が酸で、どのような物質が塩基に相当するのでしょうか?
はじめて、酸・塩基について言及したのは、スウェーデンの科学者、アレニウスでした。
アレニウスは、塩(イオン結晶)はそのままでは電気を通さないのに、水に溶かすと電気を通すようになるのはなぜなのか、疑問を持ちました。そして、水に溶かしたときに、塩は電荷をもつイオンという粒子に分かれると考えました。
このイオンについての研究を進めていく中で、1887年、アレニウスは次のように酸・塩基を定義しました。
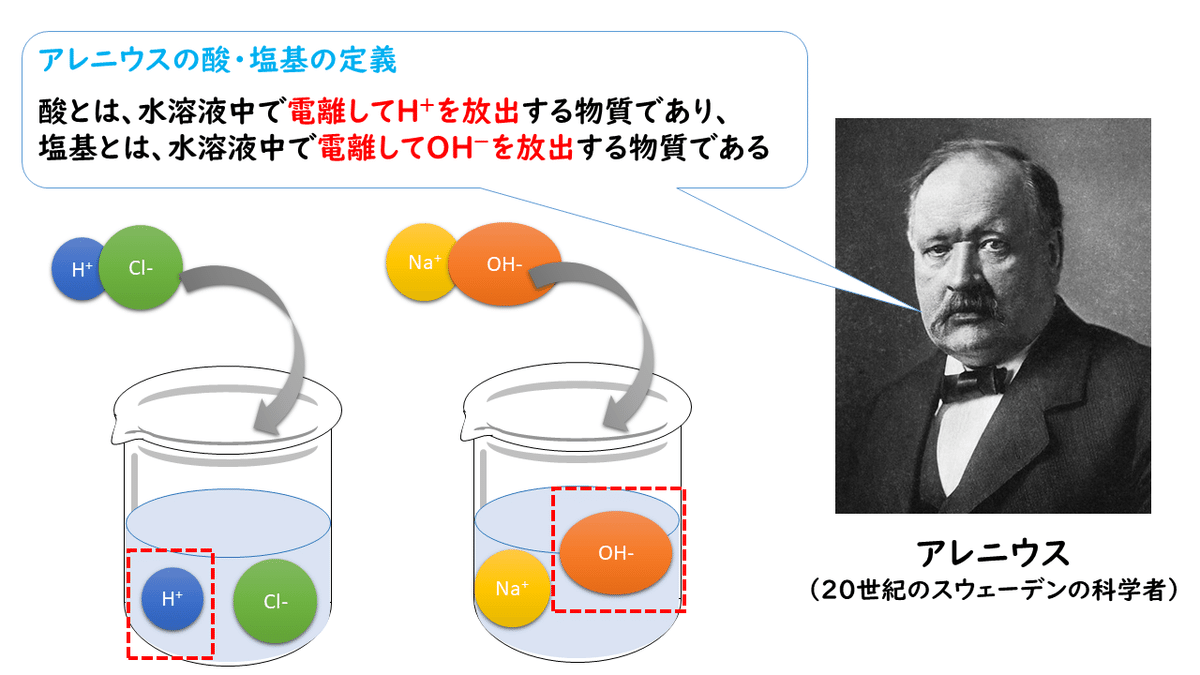
アレニウスの定義による酸と塩基の考え方を、様々な物質にあてはめてみると、次のようになります。

上の各式を見れば分かるように、反応後(右辺)にH+があれば元の物質(左辺)は酸、OH-があれば元の物質は塩基ということになります。
ただ、このアレニウスの酸・塩基の定義には「水溶液中で電離して」という条件が付いているので、酸・塩基は水溶液の状態になっていないと定義することができません。しかし実際には、気体同士で反応したり、水溶液の状態になっていなくても酸と塩基の反応と考えられる反応がありました。
そこで、デンマークの科学者ブレンステッドと、イギリスの科学者ローリーは、水溶液中以外の反応についても酸と塩基が決められるように、次のような定義を唱えました。

具体例をあげて考えてみると、次のようになります。
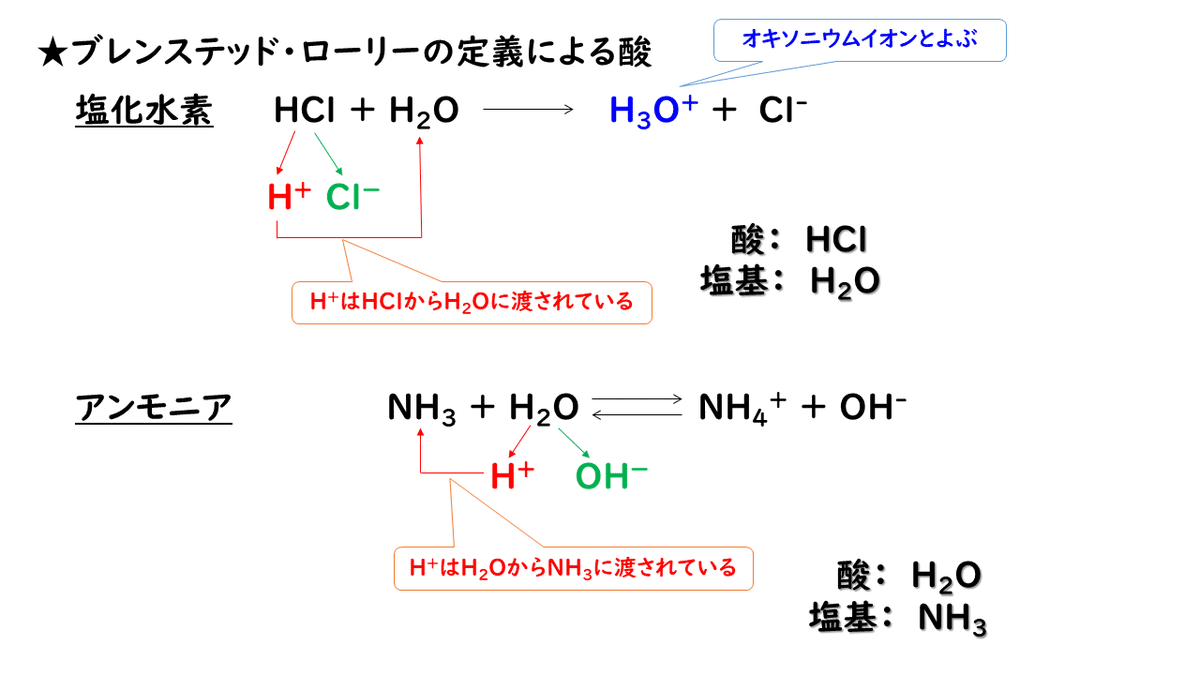
同じ水H2Oという物質であっても、反応する相手によって、酸になったり塩基になったりするのが面白いですね。
化学反応式を見て、H+がどちらからどちらへ移動しているのかを見極めるのは少し難しいかもしれませんが、左辺と右辺でHの数を比べた時に、増えていたらH+をもらっているので塩基、減っていたらH+を与えているので酸ということになります。
この他にも、大学で専門的に化学を学ぼうとすると、酸塩基の定義はいくつか登場します。とりあえず高校段階では、アレニウスとブレンステッド・ローリーの2つの定義を使えるようにしておきましょう。
■酸・塩基の価数ってどんなもの?
一口に「酸」「塩基」といっても、その種類はかなりの数に上ります。その一つ一つの性質を覚えていこうとしたら大変ですから、いくつかの方法によってグループ分けをしてあげる必要が出てきます。
まず一つ目の分類は、「価数」という分類方法です。
酸の価数とは、電離してH+を何個放出できるかを表し、塩基の価数とは、電離してOH-を何個放出できるかを表します。
例えばHClであれば、HCl → H+ + Cl- と電離し、放出するH+は1個ですから「1価の酸」ということになります。
また、Ca(OH)2であれば、Ca(OH)2 → Ca2+ + 2OH- と電離し、放出するOH-は2個ですから「2価の塩基」ということになります。

見分け方ですが、上にもあるように、化学式の中にH(またはOH)が何個入っているのかで判断すると分かりやすいです。
このとき、酢酸とアンモニアに注意してください。
酢酸はCH3COO-とH+に電離するので1価の酸ですが、見た目にOHがあるので1価の塩基としてしまう人が多いです。またアンモニアは水と反応してNH4+とOH-に電離するので1価の塩基ですが、見た目にHが3個あるので3価の酸としてしまう人が非常に多いです。ここだけは気を付けて覚えておきましょう。
■酸・塩基にも強弱がある!
もう一つのグループ分けの方法は、「酸・塩基の強弱による分類」です。
実は、酸であっても種類によって、その強さに違いがあるのです。
例えば塩酸HClは強酸に分類され、金属マグネシウムと激しく反応したり、塩酸の水溶液は電流をたくさん流すことができたりします。
一方で酢酸CH3COOHは弱酸に分類され、金属マグネシウムとはおだやかにしか反応せず、電流も少ししか流しません。
このような違いは、「溶かした物質のうち、どのくらいが電離してイオンになることができたか」によって違ってきます。
溶かした物質のほとんどが電離した水溶液中には、電荷を帯びたイオンがたくさんありますから、電流をたくさん流すことができます。また、電離して生じたH+もたくさん存在しているので、酸性の性質も強くなり、金属とも激しく反応します。このような酸を「強酸」といい、塩酸は強酸に分類されます。
一方、溶かした物質のうち一部しか電離していない水溶液中には、イオンが少ししかありませんので、電流は少ししか流すことができません。また、電離して生じたH+も少ししかありませんので、酸性の性質も弱くなり、金属とはおだやかにしか反応できません。このような酸を「弱酸」といい、酢酸は弱酸に分類されます。

このように、水溶液中でどのくらい電離しているかどうかで、反応に大きな違いが見られるので、それぞれの物質がどのくらい電離するものなのかを知っていると便利です。
具体的に「水溶液中でどのくらい電離しているか」を表す値を「電離度」といい、記号「α」で表します。
例えば、100粒溶かしたとして、100粒すべて電離したとしたら、電離度αは1になります。一方で100粒溶かしたとして、そのうち1粒しか電離しなかったとしたら、電離度αは100分の1=0.01になります。
ほぼすべて電離するのが強酸でしたので、α≒1のものが強酸(または強塩基)、αの値が1よりもだいぶ小さかったら弱酸(または弱塩基)ということができます。
世の中にある酸・塩基の多くは「弱酸」「弱塩基」です。「強酸」「強塩基」とよばれるものは非常に限られているので、まずは次の物質について覚えてしまいましょう。"強酸・強塩基だけ覚えて、残りは弱酸・弱塩基"と考えておくと、比較的暗記する量は減らせるかと思います。
強酸:塩酸HCl、硝酸HNO3、硫酸H2SO4、、臭化水素HBr、 ヨウ化水素HI
強塩基:水酸化ナトリウムNaOH、水酸化カリウムKOH、水酸化カルシウムCa(OH)2、水酸化バリウムBa(OH)2
強塩基はちょっと面白い覚え方があります。Na, K, Ca, Baにフリガナを振って、「泣くカバ」と覚えておくものです。昔この話を授業中にしたら、カバが泣いている漫画をノートにさらっと描いている生徒がいました。絵が描ける人、うらやましい・・・。
ちなみに、この電離度の値は、濃度が小さいほど大きくなります。要は、うすめた方がいっぱいイオンに電離するということです。濃いと仲間がいっぱいいて互いになれ合いが生じて「自分たちわざわざイオンにならなくてもよくね?」と談合しているのかどうかはわかりませんが、100%に近いくらい濃くなってくると、ほとんど電離はしません。

今回はここまでです。酸と塩基のおおまかな性質は覚えられそうですか?
では最後に、確認チェックをしてみましょう。
最後にワンポイントチェック
1.アレニウスの酸・塩基の定義とはどのようなものか?
2.ブレンステッド・ローリーの酸・塩基の定義とはどのようなものか?
3.酸・塩基の価数とはどのようなものか?
4.電離度はどのようにして求めればよいか?
5・酸・塩基の強弱とはどのようなものか?
お疲れさまでした。次回は水溶液の性質を調べる時に重要になってくるpHについてです。お楽しみに!
この記事が気に入ったらサポートをしてみませんか?
