
6-2. 水素イオン濃度とpH
こんにちは、おのれーです。
前回、酸や塩基とよばれるものには、その性質が強く表れるものと、弱く表れるものがあるということを確認しました。
今回は、酸や塩基の性質の強さを、具体的に数値で表してみましょう。
■水もわずかに電離している!
水は化学式H2Oで表される分子ですが、純粋な水もわずかに電離して、水素イオンH+と水酸化物イオンOH-に分かれています。
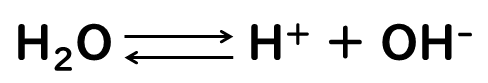
といっても、本当にわずかなので、純粋な水は電気をほとんど通すことはありません。
ちなみに、純粋な水に限らず、水溶液中には必ずH+とOH-が存在します。
H+のモル濃度を水素イオン濃度といい、[H+]と表します。また、OH-のモル濃度を水酸化物イオン濃度といい、[OH-]と表します。
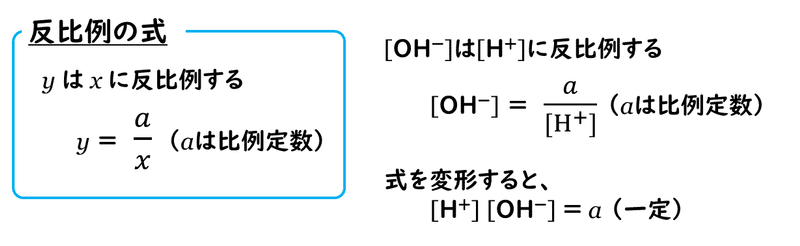
そして、この[H+]と[OH-]の間には、ちょっと面白い関係があるのです。それはどのような関係なのでしょうか?
実は、[H+]増えると[OH-]は減り、[H+]が減ると[OH-]は増えるという、反比例の関係にあるのです。このことから、以下のように式を変形して考えていくと、水素イオン濃度 [H+]と水酸化物イオン濃度 [OH-]の積は常に一定になるということがいえます。
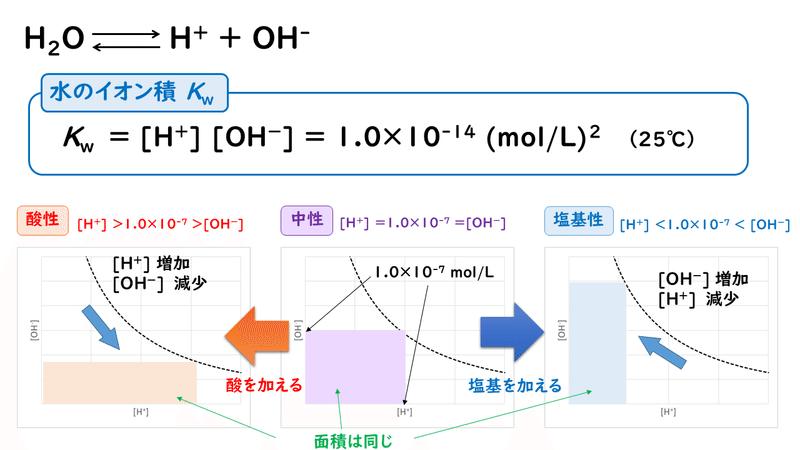
この"水溶液中の水素イオン濃度[H+]と水酸化物イオン濃度[OH-]の積"のことを、「水のイオン積」といい、Kwと表します。25℃においては、Kwの値は常に1.0×10^-14 (mol/L)^2になります。
アレーニウスの定義によれば、酸とは水溶液中で電離してH+を放出するもの、塩基とはOH-を放出するものでした。したがって、酸性を示す溶液のときにはH+の方が多い状態、塩基性を示す溶液のときにはOH-の方が多い状態であり、中性の溶液とは、[H+]と[OH-]がちょうどつり合っている状態だといえます。
■[H+]や[OH-]の大きさはどのようにして求めるのか?
水素イオン濃度や水酸化物イオン濃度の大きさはどうやって求めればよいのでしょうか?
ここでは酸と水素イオン濃度の関係を例にして考えてみます。
上でも確認しましたが、アレニウスの定義によれば「酸とは水溶液中で電離してH+を放出する物質」とあります。したがって、酸性の水溶液中にあるH+の濃度を求めるには、
① もともと酸がどのくらいの量あるのか(酸のモル濃度)
② 1個の酸がいくつH+を出すことができるのか(酸の価数)
③ 実際にどのくらい酸が電離しているのか(酸の電離度)
が必要です。
酸のモル濃度に価数をかければ、酸が放出することのできるH+の最大数を求めることができます。さらに、これに電離度をかければ、実際に酸が電離することで放出したH+の濃度を求めることができます。
つまり、
水素イオン濃度=酸のモル濃度×酸の価数×酸の電離度
という関係が成立するのです。
水酸化物イオン濃度についても同じように、
水酸化物イオン濃度=塩基のモル濃度×塩基の価数×塩基の電離度
という関係が成立します。
では実際に問題を考えてみましょう。


■pHって何だ?
コンビニのお弁当の成分に「pH調整剤」と書いてあったり、温泉に出かけると「この温泉のpHは〇〇です」と表示されていたりするのを見たことはないでしょうか?
このpHという値、割と私たちの生活の中で自然に使われていたりするのですが、いったいどのような値なのでしょうか?
pH(ピーエイチ、昔はドイツ語読みでペーハーと呼ばれていた)とは、水溶液の酸性・塩基性の強さを表す数値で、水素イオン指数(水素イオン濃度指数)ともいわれています。pHが小さいほど酸性が強く、大きいほど塩基性が強くなります。
ちなみに、pHとは、[H+]=1.0×10^-nのとき、n になると決められています(本来の定義は、pH=-log[H+]です)。pHの大きさは0~14で表され、7未満が酸性、7が中性、7を超えると塩基性です。その関係を表したのが下の表です。
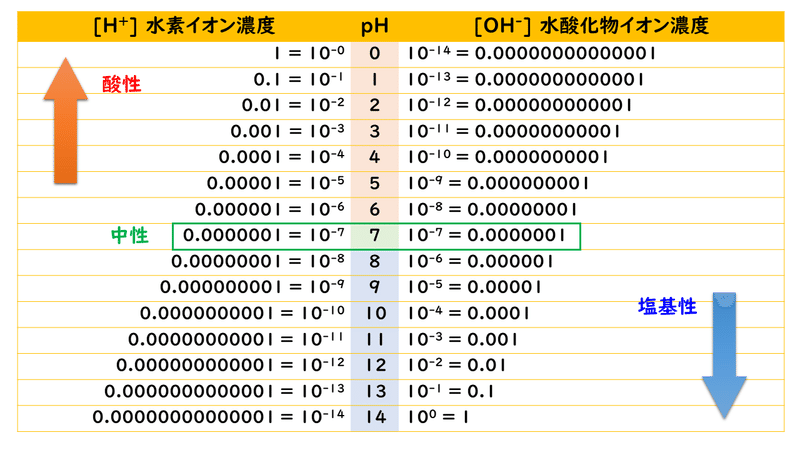
同様に、水酸化物イオン指数(水酸化物イオン濃度指数)pOHというものもあり、[OH-]=1.0×10^-m のとき、mになるといえます。
また、水のイオン積が Kw = [H+] [OH-] = 1.0×10^-14 (mol/L)^2 となることから、pHとpOHの和は常に14になります。
こうしてpHの値を求めることで、その水溶液の酸性や塩基性の強さを比較することができるようになります。
この他にもpHの値は、万能pH試験紙などを使って、実験的に求めることもできます。身近な水溶液のpHを万能pH試験紙によって調べた結果は以下のようになります。
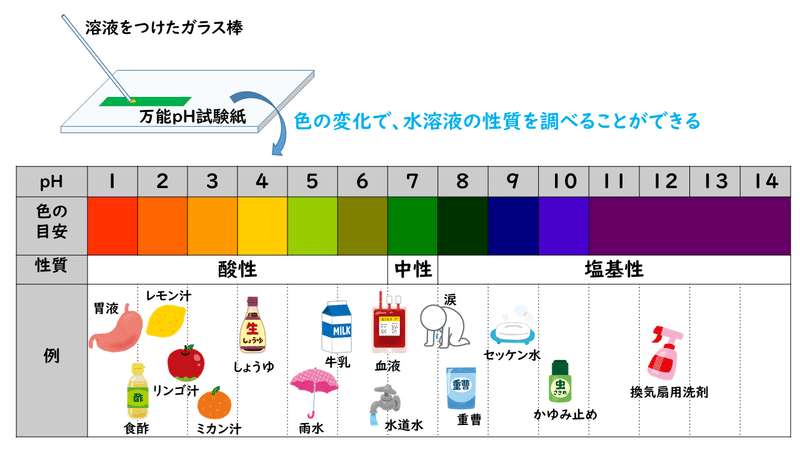
こうして見てみると、口に入るものに酸性のものが多く、塩基性のものはあまり口にしてはいけないと言われるものが多いかと思います。塩基性の物質にはタンパク質を溶かすという性質があるため、皮膚を溶かすこともできてしまうことも関係しているかもしれません。
では実際に、いくつかの水溶液について、pHの値を求めてみましょう。


ちなみに、酸の水溶液は10倍うすめるごとにpHが1大きくなり、中性の7に近づいていき、塩基の水溶液は10倍うすめることにpHが1小さくなり、中性の7に近づいていき、7をまたぐことはありません。
酸性のオレンジジュースをめちゃくちゃうすめていったら、いきなり酸っぱい味から苦い味に変わって、アルカリ性になることはないのです。水で薄めたら、水(中性)に近づいていくだけなので、注意してください。
今回はここまでです。今回は計算も多かったので、ワンポイントチェックはお休みです。お疲れさまでした。
次回は、酸と塩基をで合わせて反応させると、どのようなことが起こるのか、ということを考えていきたいと思います。お楽しみに!
この記事が気に入ったらサポートをしてみませんか?
