
1-6. 元素の周期律と周期表
こんにちは、おのれーです。
「毎日更新します」と宣言してから6日目。何とか第1章の最終節にたどり着きました。
今回は「元素の周期表」について。「水兵、リーベ、ぼくの船…」っていうあれです。この周期表、知っているとかなり暗記事項を減らすことができ、とても便利なので、その特徴を見ていきましょう。
■メンデレーエフの予言
最初の周期表が考え出されたのは、今から約150年前、日本では江戸幕府が倒れ、明治政府が成立して近代化の道を歩き始めた1869年のことです。
ロシアの科学者メンデレーエフは、元素を原子の質量(原子量)の順に並べると、周期的に性質のよく似た元素が表れることを発見しました。元素の性質のこのような周期性を、元素の周期律といいます。
メンデレーエフはさらに、性質のよく似た元素を縦の列にそろえて分類し、現在のものに近い元素の周期表を発表しました。

メンデレーエフがつくった周期表には、いくつかの空欄がありました。性質と原子量の関係から、「現時点では発見されていないけれど、恐らくこのような元素が存在するだろう」と、未知の元素の存在を予言したのです。
メンデレーエフの予言は的中しました。
1886年に発見されたゲルマニウムGeの性質は、メンデレーエフが予言した"エカケイ素Es"とよばれる元素と驚くほど一致していたのです。
現在では、周期律が現れるのは、原子番号の増加にともなって価電子の数が周期的に変化することが原因だと分かっています。これは、原子の電子配置と、元素の性質が深く関わっているためです。

メンデレーエフ、すごい・・・
■150年かけてつくられた元素の周期表!
現在の元素の周期表は、メンデレーエフの頃には発見されていなかった元素も含め、全部で118種類の元素が、原子番号の順に、性質の似た元素が同じ縦の列になるように並べられています。また、元素の周期表の縦の列を族、横の行を周期とよんでいます。

2016年に第7周期までの空欄がすべて埋められ、元素の周期表はいったん完成したことになっています。メンデレーエフの発見から147年、最近になってようやく出来上がったと考えると、感慨深いものありますね。
できたら、原子番号1~20まで、理系で大学受験を考えている人は1~36までは原子番号の順番を覚えて、周期表を書けるようにしておきたいものです。

余談ですが、2016年に認められた元素の中には、日本の理化学研究所が発見した原子番号113番のニホニウムNh も含まれており、国内でも話題になりました。このニホニウム発見物語は、理化学研究所のHPに載っているので、詳しく知りたい人はぜひ見てみて下さい。
また、それぞれの元素の性質を知るには、イギリスのノッティンガム大学の科学者らが、普通は手に入れることができない希少元素なども含む全118種の元素をテーマにした実験や解説の動画を公開しているので、こちらを見てみると、面白いかと思います。
⇒ The Periodic Table of Videos - University of Nottingham
■タテの列に注目をすると、元素の性質がわかる!
同じ族に属している元素のことを同族元素といいます。もともと、メンデレーエフは同じ性質を示す元素を、縦の列にそろうように並べて周期表をつくったわけですから、同族元素に注目すると、何かいいことがありそうですね。
縦の列に注目するときには、元素を「典型元素」と「遷移元素」という2つの大きなグループに分けて考えていきます。
◎典型元素
典型元素とは、周期表の1,2族と12~18族の元素のことです。
典型元素は、原子番号の増加とともに、価電子の数が周期的に変化ます。このため、典型元素の同族元素は価電子の数が等しく、性質が似ています。
特に、次の4つの族の元素は、特に性質が似ているので、特別に名称がつけられています。
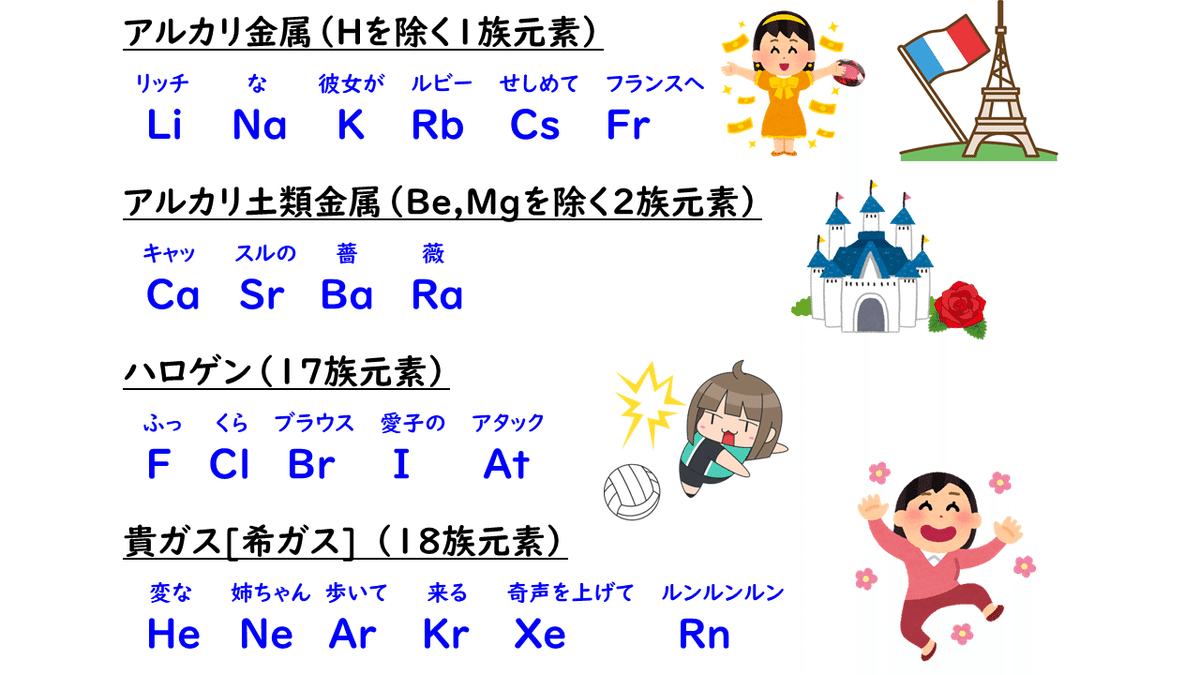
・1族(Hを除く、Li, Na, K, Rb, Cs, Fr)=アルカリ金属
→価電子数が1、1価の陽イオンになりやすい
・2族(Be, Mgを除く、Ca, Sr, Ba, Ra)=アルカリ土類金属
→価電子数が2、2価の陽イオンになりやすい
・17族(F, Cl, Br, I, At)=ハロゲン
→価電子数が7、1価の陰イオンになりやすい
・18族(He, Ne, Ar, Kr, Xe, Rn)=貴ガス(希ガス)
→価電子数が0、安定でイオンになりにくい
ちなみに、これらの同族元素を、語呂合わせで覚える方法があるので紹介しておきます。自分で考えてみるのも面白いかもしれないですね。
◎遷移元素
遷移元素とは、周期表の3~11族の元素のことです。典型元素とは異なり、価電子数が周期的には変化せず、1か2のものが多いという特徴があります。
ただし、周期表の同一周期で隣り合った元素どうしは、電子配置がよく似ているので、比較的性質が似ています。
■周期律にはどのようなものがあるか?
では、具体的には価電子数が周期的に変化することによって、どのような性質に周期律がみられるのでしょうか?
①原子の半径
原子の大きさ(半径)を原子番号順に並べてみると、次のグラフのようになります。

これを見てみると、同一周期では、原子番号が大きくなるほど原子半径は小さくなることが分かります(18族を除く)。これは、同一周期では、原子番号が大きくなるほど、陽子(+)の数が増え、電子(-)を原子核に引き付ける力が強くなるからです。
また同族では、原子番号が大きくなるほど原子半径は大きくなることも分かります。これは、同族では、原子番号が大きくなるほど、最外殻がK殻→L殻→M殻…と外側にひろがっていくためです。

➡動画での解説(YouTubeに飛びます)
②イオンの半径
単原子イオンの大きさ(半径)も、原子の半径と同じように考えることができます。
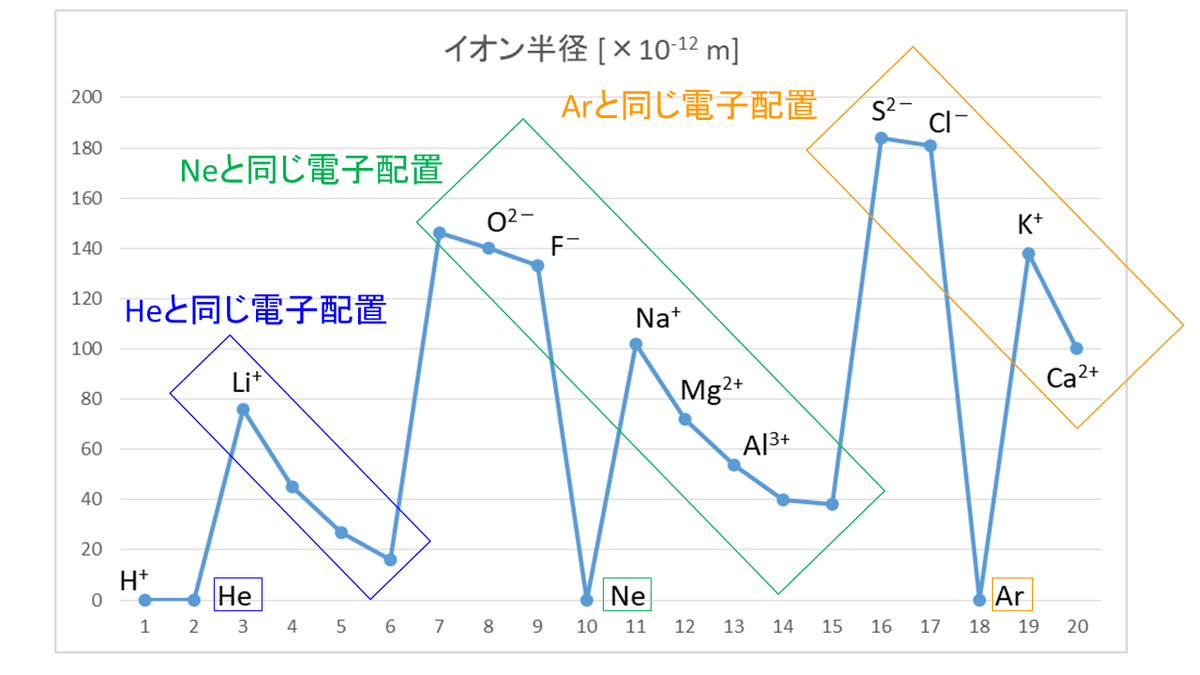
単原子の陽イオンの場合、最外殻の電子をすべて放出してイオンになるので、もとの原子よりも最外殻が1つ内側になり、半径も小さくなります。また、イオンの価数が大きいほど、放出した電子(-)の数が多く、原子核(+)が電子を引きつける力の影響が大きくなるので、イオン半径は小さくなります。
一方、単原子の陰イオンの場合、最外殻に電子(-)を取り入れてイオンになるので、原子核(+)が電子を引きつけようとする影響力はもとの原子より弱まり、半径は大きくなります。また、イオンの価数が大きいほど、取り入れた電子の数が多く、より原子核の影響力が弱くなるので、イオン半径は大きくなります。

③イオン化エネルギー
次のグラフでもわかるように、イオン化エネルギーにも周期性が見られます。

イオン化エネルギーは、原子が1価の陽イオンになるときに必要なエネルギーのことなので、1価の陽イオンになりやすいアルカリ金属のイオン化エネルギーは小さく、イオンになりにくい貴ガスのイオン化エネルギーが大きくなっています。したがって、同一周期では、イオン化エネルギーは原子番号とともに大きくなる傾向があります。
また、イオン化エネルギーは次の周期に移ると、急激に低下します。これは、次の周期に移ると、最外殻が1つ外側の電子殻になるので、原子核(+)と電子(-)の間にはたらく引力が急に弱くなるからです。
イオン化エネルギーの大小と周期表との関係は、ざっくりと次のようにイメージしておくとよいでしょう。

今回はここまでです。これまで原子や電子を中心に、化学の基本の基本を学んできました。次回からは、科学者がこれまでどのようにして物質の性質を調べてきたのか、というところに注目していきたいと思います。
最後にワンポイントチェック
1.元素の周期律を見つけたロシアの科学者の名前は?
2.現在の周期表は何の順番に並んでいる?
3.典型元素と遷移元素とは何?
4.アルカリ金属、アルカリ土類金属、ハロゲン、貴ガスの元素を答えられるか?
5.原子半径と周期律の関係は?
6.イオン化エネルギーと周期律の関係は?
お疲れさまでした。それでは、また第2章でお会いしましょう!
この記事が気に入ったらサポートをしてみませんか?
