
ショットガン・メタゲノミクス研究により、自閉症児の硫黄代謝と酸化ストレスの変化と微生物叢移植療法後の改善が示唆される
オープンアクセス論文
ショットガン・メタゲノミクス研究により、自閉症児の硫黄代謝と酸化ストレスの変化と微生物叢移植療法後の改善が示唆される
https://neurosciencenews.com/microbiota-transfer-asd-22094/








Khemlal Nirmalkar 1,*ORCID,Fatir Qureshi 2,3,Dae-Wook Kang 1,†ORCID,Juergen Hahn 2,3,4ORCID,James B. Adams 1,5ORCID andRosa Krajmalnik-Brown 1,6,*ORCID によるものです。
1
バイオデザインセンター、アリゾナ州立大学、テンペ、アリゾナ州85287、米国
2
レンセラー工科大学バイオメディカル工学部、トロイ、ニューヨーク州12180、米国
3
レンセラー工科大学バイオテクノロジー・学際研究センター、トロイ、ニューヨーク州、米国
4
レンセラー工科大学化学・生物工学部、ニューヨーク州トロイ、12180、USA
5
アリゾナ州立大学物質・輸送・エネルギー工学部、テンピ、アリゾナ州、85287、米国
6
アリゾナ州立大学サステイナブル・エンジニアリング・構築環境学部(School of Sustainable Engineering and the Built Environment, Arizona State University, Tempe, AZ 85281, USA
著者名(敬称略
†
現住所 現住所:Department of Civil and Environmental Engineering, The University of Toledo, Toledo, OH 43606, USA.
Int. J. Mol. Sci. 2022, 23(21), 13481; https://doi.org/10.3390/ijms232113481
Received: 2022年9月16日 / 改訂:2022年10月23日 / 受理:2022年11月2日 / 発行:2022年11月3日
(本論文は、特集「微生物-脳-腸の軸における分子メカニズム」に属しています。)
ダウンロード 閲覧 図版 備考
要旨
腸内細菌叢と自閉症スペクトラム障害(ASD)の関連は、16S rRNA遺伝子アンプリコンやショットガンシーケンスを用いた多くの研究において検討されてきた。これらの関連性に基づき、ASD患者の消化管(GI)およびASD症状を改善するためのマイクロバイオーム療法が提案されている。以前、私たちが行ったオープンラベルのマイクロバイオータ移植療法(MTT)研究では、MTT後のASD児の腸内細菌群集の変化について洞察を深め、ASDおよびGI症状の有意かつ長期的な改善を示しました。同試験のサンプルを用いて、ショットガンメタゲノムシーケンスを適用したより深い分類学的および機能的解析を行うことが本研究の目的であった。分類学的解析の結果、ASD Baselineは相対量が少ない細菌が多く、MTT後にその存在量が増加することがわかった。ASD児ではMTT-10wks後に食物繊維を消費する有益な微生物であるPrevotella (P. dentalis, P. enoeca, P. oris, P. meloninogenica), Bifidobacterium bifidum, and a sulfur reducer Desulfovibrio pigerの相対量がBaselineと比較して増加しました(以前の16S rRNA遺伝子研究と属レベルで一致していました)。Baselineの代謝パスウェイ解析では、典型的な発達(TD)児と比較して、多くの機能性遺伝子の存在量が変化していたが、MTT後はTDまたはドナーと同程度になることがわかった。変化した重要な機能遺伝子は、葉酸生合成、硫黄代謝、酸化ストレスに関与する酵素をコードする遺伝子であった。これらの結果は、MTT処理によって代謝経路に関与する重要な遺伝子の相対的な存在量が変化しただけでなく、TD対照と同程度のレベルになったようであることを示している。しかし、2年間の追跡調査では、微生物叢と微生物遺伝子は、ベースライン時のレベルとは異なる、TD群とは異なる新たな状態に移行していた。今回の結果は、MTTからの微生物がASD児の代謝プロファイルの初期改善につながり、治療後2年でさらに大きな変化をもたらすことを示唆するものであった。今後、これらの特定の微生物の役割、機能的な遺伝子発現、ASDに関連する代謝物をより理解するために、より大規模なコホート研究、機構的なin vitro実験、メタトランススクリプトミクス研究が推奨される。
キーワード:自閉症スペクトラム障害(ASD)、腸内細菌叢、メタゲノム、糞便微生物叢移植(FMT)、微生物叢移植療法(MTT)
はじめに
自閉症スペクトラム障害(ASD)は、社会的コミュニケーションの困難と制限的で反復的な行動によって特徴付けられる神経発達症である[1]。最近、CDCは、ASDは米国で約44人に1人の子どもが罹患していると推定されると報告した[2]。ASDは一般的に、慢性便秘、下痢、腹痛などの消化器(GI)障害を含むいくつかの医学的併存疾患と関連しています[3,4,5,6]。私たちの以前の研究[7]では、これらのGI障害は18人のASD児すべてにおいて乳児期に始まり、7~16歳でMTTによる治療を受けるまで続いていることがわかりました。ASD患者の腸内細菌叢は、GI症状の併発の有無にかかわらず、通常、定型発達(TD)児とは異なることが報告されています[7,8,9,10]。
以前、ASDの子どもに対する微生物叢移植療法(MTT)の非盲検試験において、MTTは治療終了までにGI症状の重症度を~80%、ASD症状を~24%減少させました[7]。さらに、治療10週間後にビフィドバクテリウム、プレボテラ、デスルホビブリオの属レベルでの相対存在量が増加しました[7]。この同じ子供たちのMTT後の2年間の追跡調査では、Baselineと比較してGI症状が〜59%、ASD症状が〜47%減少し、Bifidobacterium、Prevotella、Desulfovibrioの存在量は高いままであった[11]。行動症状の改善は、MTTが変化した腸と脳のつながりを回復させることにも役立つことを示唆しています[12]。
腸脳軸は双方向性であり、腸内細菌叢、代謝機能および代謝産物は、GIおよび中枢神経系(CNS)の接続の確立に重要な役割を果たす[13,14]。ASDの子供におけるいくつかの限られた横断的研究からの微生物機能遺伝子分析は、GABA [16]、ドーパミン、セロトニン、グルタミン酸 [17,18]、および微生物解毒 [19] などの神経伝達物質 [15] をコードする遺伝子の存在量の変化または枯渇を示しました。
ASD患者の腸内細菌叢に存在する代謝経路/遺伝子の種/菌株レベルでのマイクロバイオーム知識は限られており[15,16,17,18,19]、この領域は、自閉症児のMTT治療を用いて縦断的に調査されていない。これらの限界は、MTT前後の腸内細菌叢の機能的影響を理解するための広範な研究を保証するものである。
我々が以前に行ったMTTのオープンラベル研究では、16S rRNA遺伝子アンプリコンシーケンシング[7,11]とメタボローム[20]の評価を行った。それらの研究では、MTT後(10週および2年)の微生物(属レベル)およびメタボロームプロファイルの変化、ASDおよびGI症状の改善を明らかにした。本研究の目的は、これらのMTTサンプルに対してショットガンメタゲノムシーケンスを実施することであった。ショットガンメタゲノミクスにより、微生物の分類や治療によって変化する重要な遺伝子・パスウェイの可能性について、より詳細な情報が得られると仮定したのである。結果
2.1. 多くの細菌種が MTT 処理後に移動、多くは 2 年後
ASD児のMTT(10週、2年)前後の世界的な分類学的変化を調べるため(試験の概要、図1)、αおよびβ多様性指標を用いた(補足図S1、表S1、S2)。Shannon指数は、ASDのBaseline(以下、Baselineとする)とMTT後、TD後を比較すると、ASDのBaseline中央値は他のすべての群より低いが、有意差は見られなかった(補足図S1A)(詳細は補足資料1参照)。Jaccard非類似度指数は、MTT-2 yrと他の群との間でのみ、有意な分離(ANOSIM R = 0.45, p = 0.001)を示した(補足図S2A、表S1A)。
Ijms 23 13481 g001 550Figure 1. hd-high dose; ld-low dose; SHGM-standardized human gut microbiota; WGS-hole-genome sequencing; MB-metabolomics; CA-clinical assessment (includes all ASD- and GI-associated symptoms; movi-MoviPrep.) ASDにおけるMTT試験の概要と本研究における試験時間点。試験の詳細については、[7,11,20]を参照されたい。
ショットガンメタゲノム解析により、ASD(MTT前後)およびTD(補足表S1〜S5)の子どもにおいて合計5272種の細菌が同定され、群間の一変量比較により細菌量に有意差が認められた(詳細は補足資料1参照)。
2.2. MTTは食物繊維消費菌、プロバイオティクス菌、硫黄還元菌など特定の細菌種を変化させた
図2は、ASD児においてASD群とTD群の相対量に最も有意差があり(カットオフp<0.01、調整p<0.05)、MTT後にBaselineと比較して変化が見られた30種類の細菌を示したものである。Taxa cluster-Iは、BaselineではTDと比較して有意に低く、MTT後も変化が見られなかった菌群である。Taxa cluster-IIは、TDと比較してBaselineで有意に低く、MTT後2年でさらに低下した。Taxa cluster-IIIはBaselineで有意に低く、MTT-10週間後に上昇したが、MTT-2年後には低下し、Baselineより低下した1つを除いてBaselineとの差はなかった。上位30個の細菌はいずれも、ASD群ではBaselineではTDと比較して有意に高くはなかった。全体として、図2は、ASD群では細菌のレベルが有意に低く、MTT-10週で大きな増加が起こり、MTT-2年で大きな変化が起こっていることを表している。詳細は補足資料1を参照。
Ijms 23 13481 g002 550Figure 2. ASDベースライン群対他の全群の腸内細菌の(z-score)相対存在度の一変量比較。BaselineとTDで相対存在量に有意な差があった3つのクラスターにおける上位30細菌種(カットオフp<0.01、調整p<0.05)。各グループのヒートマップ作成には、細菌の相対存在量の中央値を使用した。* シングルアスタリスクはp<0.05、ダブルアスタリスクはp<0.01、トリプル*アスタリスクはp<0.001を示す。p値はすべてFDR補正済み。ASD:自閉症スペクトラム障害、TD:典型的発達障害。
我々は、同じサンプルを用いた16S rRNA遺伝子アンプリコン研究で、これらの属がMTT後に有意に増加することを発見したため、当初はPrevotella(繊維消費菌)、Bifidobacterium(一般的なプロバイオティクス)、Desulfovibrio(硫黄還元菌)に焦点を当てた[7, 11]. 本研究では、種レベルでの変化を調べることで前回の知見を拡張し、BaselineにおけるASDはTDと比較してPrevotella、Bifidobacterium、Desulfovibrioの特定種の中央値が低かった(生p < 0.05, 調整p > 0.05) (Figure 3 and Figure 4) が、FDR補正後は統計的有意差はみられなかった。図3および図4に見られるように、いくつかのPrevotella、BifidobacteriumおよびDesulfovibrio種の相対現存量は、MTT-10 wkで有意に増加した(調整後p < 0.05)。MTT-2 yrでは、相対現存量は10週と比較して減少したが、D. pigerを除いてBaselineよりも有意に高く推移した(中央値、p > 0.05)。MTT-10週後に有意に増加したPrevotellaは、P. denatalis, P. enoeca, P. oris, P. meloninogenica (Figure 3A-D); P. denticola, P. fusca, P. intermedia, P. ruminicola (Supplementary Figure S4A-D) の8種であることが確認された。Bifidobacteriumでは、2種が有意に増加した(B. bifidum、(図4A);B. angulatum、補足図S4E)。一方、Desulfovibrioでは、D. pigerのみが有意に増加して2年後も相対存在度が高く維持された(図4B)。
Ijms 23 13481 g003 550Figure 3. ASDベースラインとMTT(10週、2年)、TDの(A)P. denatalis, (B)P. enoeca, (C)P. oris, (D)P. meloninogenicaの相対存在量(log10変換後)を一変量で比較。赤破線は維持期(n=2)の平均値、青は主要ドナー(n=5)の中央値。各色のドットは1人のASD個体、灰色色のドットはTDを表す。アスタリスクはASD Baselineと他の群との有意差を表す 二重アスタリスクはp < 0.01; ns: not significant; p値はすべてFDR補正済み)。ASD:自閉症スペクトラム障害、TD:典型的発達障害。
Ijms 23 13481 g004 550図4. ASDベースライン群とそれ以外の群における異なる細菌種:(A)Bifiodobacterium bifidum,(B)Desulfovibrio piger,(C)Lactobacillus vaginalis,(D)Alistipes finegoldiiの相対存在度(log10変換後)の一変量比較。赤の破線は維持ドナー(n = 2)の平均値、青は主要ドナー(n = 5)の中央値を示し、A. finegoldiiについては、赤と青の線が重なっている。各色の点は1つのASD個体、灰色色の点はTDを表す。アスタリスクはASD Baselineと他のグループとの有意差を示す(シングルアスタリスクはp<0.05、ダブルアスタリスクはp<0.01、トリプルアスタリスクはp<0.001、#はlog10変換後のみ統計的に有意、nsは有意ではなく、すべてのp値はFDR補正済み)。ASD:自閉症スペクトラム障害、TD:典型的発達障害。
より高い分類学的バリエーション(補足表S3)のため、ASDまたは神経障害に有益または関連すると以前に報告されたいくつかの特定の細菌(図3および図4)に分析を集中させた。図4Cに見られるように、乳酸産生菌Lactobacillus vaginalisの相対量はBaselineとTDで有意に低く(調整p<0.05)、その相対量はASD Baselineと比較してMTT-10 wkで増加(調整p<0.05)したがMTT-2 yrでやや減少した。以前、他の研究でASDで有意に高く、ASDと関連があることがわかったAlistipes finegoldiiは、BaselineではTDに比べて非有意に高く(中央値、p > 0.05)、MTT-10 wkではBaselineに比べて有意に減少し(調整後p < 0.05)、ASDの子どもではMTT-2yrでも有意に低いままであり、TDレベルに近かった(調整後p < 0.05) (図 4D)。
2.3. MTTに伴ってシフトする微生物機能遺伝子
MTT(10週、2年)前後のグローバルなKEGGオルソログ(KOs)の変化に対応するため、アルファおよびベータ多様性指標を使用した。MTT-10wk後のShannon indexはASD Baselineと比較して有意に増加したが(補足図S1B)、MTT-2yr後のα diversityは有意に変化しなかった。TDとBaselineの多様性には有意な差は見られなかった。分類群解析と同様に、KOsのβ多様性もMTT-2 yr (ANOSIM R = 0.32, p = 0.001) と他の群との間でJaccard dissimilarity indexに有意な差があり(補足図S2B、表S1B)、MTT2年後、ASD児ではBaselineと比べ、稀少/少ないKOsが大きく変化したと考えられた(詳細は補足資料1参照)。
MTT後のKOsシフトを理解・確認するために、サンプルグループ間のKOsの具体的な差異を探った。HUMAnN2を用いて5069個のKEGG Orthologs(KOs、機能的遺伝子)を同定した。図5に示すように、ASD at BaselineとTDを比較すると、37のKOが有意に異なり(調整後p<0.05)(補足表S3、S5)、22のKOが有意に低く(KO Cluster-I)、15のKOが有意に高かった(KO Cluster-II)(補足資料1詳細:表S6を参照)。KO Cluster-Iでは、9個のKOがMTT-10 wkで増加し、3個がMTT-2yrで増加したままであった。 KO Cluster-IIでは、1個のKOがMTT-10 wkで減少し、12個がMTT-2yrで減少した。 したがって、当初ASDで低いまたは高いKOがMTTによって正常になりTDとよく似た状態になったと言える。
Ijms 23 13481 g005 550Figure 5. ASDベースラインとTDで有意に低かった(KO Cluster-I)または高かった(KO Cluster-II)KOのヒートマップ。また、ヒートマップはBaselineと比較してMTT後のKOがどのように変化し、概ねTD群に近い状態になったかを示している。各群のヒートマップ作成には、細菌の相対存在量の中央値を用いた。 シングルアスタリスクはp<0.05、ダブルアスタリスクはp<0.01、トリプルアスタリスクはp<0.001を示す。ASDベースライン vs. その他すべての群について、一変量統計比較を行った。p値はすべてFDR補正済み。ASD:自閉症スペクトラム障害、TD:典型的発達障害。
2.4. MTT後に変化した重要代謝遺伝子の相対的存在量
ここでは、ASDとTDで有意差があった(調整後p<0.05)、またはMTT後に有意に変化した(調整後p<0.05)、これまでASDとの関連が示唆されていたKOについてより詳細に説明する。補足表S6に、各遺伝子と関連する代謝経路を示す。KO Cluster-I(図6)を詳しく見ると、葉酸生合成(K04094)、ビタミンB12合成(K02499)、オレイン酸合成(K10254:オメガ9脂肪酸)をコードする遺伝子の相対存在量の変化が見られる。図6に見られるように、これらの遺伝子の相対量はBaselineではTDに対してASDで有意に低く、MTT-10 wkで有意に増加し(調整p<0.05)、TDと同様、ドナーレベルに近づくようになった。MTT-2yrでは、K04094とK02499は非有意に減少(中央値、p>0.05)したが、K10254はBaselineより有意に高いままだった(詳細は補足資料1参照)。
Ijms 23 13481 g006 550Figure 6. ASDのMTT後に有意に変化し、TDの遺伝子プロファイルと類似するようになった腸内細菌叢遺伝子/KOの相対存在量(log10変換後)の一変量比較。(A)K04094:葉酸依存性リボチミジル合成酵素、(B)K10254:オレイン酸ヒドラターゼ、(C)K02499:テトラピロールメチル化酵素。赤破線は維持率(n = 2)、青は主要ドナー(n = 5)の中央値を表す。色のついたドットはASD個体、グレー色のドットはTDを表す。アスタリスクはASD Baselineと他の群との有意差を示す(シングルアスタリスクはp<0.05、ダブルアスタリスクはp<0.01、トリプルアスタリスクはp<0.001、nsは有意ではなく、すべてのp値はFDR補正されている)。ASD:自閉症スペクトラム障害、TD:典型的発達障害。
2.5. 酸化ストレス防御および硫黄代謝をコードする遺伝子の存在量はMTT後に変化した
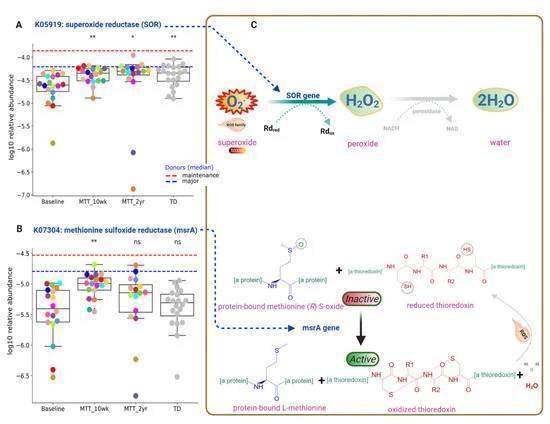
腸内細菌群の機能的遺伝子解析により、MTTは、酸素を無毒化する微生物や酸化ストレスから保護する酵素を持つ微生物の存在量を増加させ、微生物生態系を支えている可能性も明らかになった。図5および図7Aに見られるように、K05919(dfx遺伝子、SOR):スーパーオキシド還元酵素をコードする遺伝子の相対量は、BaselineではASDで有意に低く、MTT-10 wkおよび-2 yrではBaselineに対して有意に増加し(調整p < 0.05)、TD群に近い状態になることが示された。
Ijms 23 13481 g007 550Figure 7. ASDにおけるMTT前後の酸素解毒や酸化ストレスに関与する酵素をコードする腸内マイクロバイオーム遺伝子/KOの相対量(log10変換後)をTDと比較して一変量で比較した。(A)酸化ストレス防御と活性酸素の解毒;K05919(dfx遺伝子、SOR):スーパーオキシドレダクターゼ。(B)K07304(msrA):ペプチド-メチオニン(S)-S-オキシド還元酵素。(C) SORおよびmsrA KOの酵素反応の説明図。破線はドナーの中央値を表す。赤破線は維持(n = 2)、青は主要ドナー(n = 5)の中央値を表す。色のついた点はASD個体、グレー色のものはTDを表す。アスタリスクはASD Baselineと他の群との有意差を示す(*シングルアスタリスクはp<0.05、**ダブルアスタリスクはp<0.01、nsは有意ではない、p値はすべてFDR補正済み)。ASD:自閉症スペクトラム障害、TD:典型的発達障害。
このSOR微生物遺伝子は、有害なスーパーオキシドを過酸化物に変換し、その後水に還元する酵素をコードしており、スーパーオキシドと同様に活性酸素を中和するのに役立つ(図7C、上)。酸化ストレス防御を担うもう一つのKOは、K07304 (msrA): ペプチド-メチオニン (S)-S-oxide reductaseである(図7B)。活性酸素は硫黄アミノ酸「メチオニン-硫黄-酸化物」を不活性化するが、KO K07304(msrA)はメチオニン-硫黄-酸化物を還元し、チオレドキシンを酸化させることによって活性化する(図7C、下)。KO K07304(msrA)の相対量は、Baseline対TDでは非有意に低く(中央値、p>0.05)、MTT-10wkでは有意に増加したが(調整後p<0.05)(図7B)、MTT-2yrではBaselineに対して有意差なし(中央値は高いまま)であることが確認された。図7Cは、MTT後の酸素解毒と酸化ストレス防御のためのK05919(SOR)酵素とK07304(msrA遺伝子)酵素の酵素反応をそれぞれ示したものである。
3′-ホスホアデノシン-5′-ホスホ硫酸(PAPS)及びアデノシン-5′-ホスホ硫酸(APS)は、硫酸還元菌を介して同化性及び異化性硫酸還元に関与する硫黄代謝に重要なホスホ酸化合物(補足図S5)[24,25]である。図8に示すように、PAPSをAPSに変換する酵素であるKO K01082 (BPNT1/cycQ) 3′(2′), 5′-bisphosphate nucleotidase をコードする遺伝子の相対存在量はBaselineで有意に高く、MTT-10 wkで非有意に減少( median, p > 0. 05)していた。 05)、MTT-10 wkではBaselineに対してMTT-2 yrで有意に減少し(調整済みp < 0.05)、その相対量はTDに近くなった(図8A)。
Ijms 23 13481 g008 550Figure 8. ASDにおける微生物の硫黄代謝(異化性硫酸還元)に関わる酵素をコードする遺伝子のMTT前後の相対量(log10変換後)をTDと比較して一変量で比較した。(A) K01082 (BPNT1/cycQ) 3′(2), 5′-bisphosphate nucleotidase, (B) K00395 (aprB) adenylsulfate reductase, subunit B. (C) 図 解糖系還元とBPNT1および aprB の寄与を示す図。各色のドットはASD個体、グレー色のドットはTDを表す。赤の破線は維持率(n = 2)の平均値、青は主要ドナー(n = 5)の中央値を表す。アスタリスクはASD Baselineと他の群との有意差を示す(*シングルアスタリスクはp<0.05、**ダブルアスタリスクはp<0.01、nsは有意ではない、p値はすべてFDR補正済み)。ASD:自閉症スペクトラム障害、TD:典型的発達障害。
KO K00395 (aprB) adenylylsulfate/APS reductase, subunit B(APSを亜硫酸塩に変換する酵素)をコードする遺伝子の相対存在量は、ASD Baseline vs TDで有意に低く(調整済みp<0.05)、MTT-10 wkおよび-2 yr後に非有意に増加し(中央値、p>0.05)、よりTD群に近い状態になった(図8B)。
図8Cは、異化硫黄還元とその過程におけるBPNT1およびaprBの寄与を示したものである。
また、BaselineとTDの間に有意な差はなかったが、MTT-10 wkと-2 yrの後に有意に変化した重要な機能遺伝子の相対量の差を調べた(調整p < 0.05) (補図S6)。
2.6. 相関分析によるオミックスとGSRSの関連性
相関分析を用いて、細菌分類学、細菌遺伝子、血漿代謝物[20]、ASDおよびGI症状データの潜在的な関係を明らかにした(補足図S7およびS8)。相関ネットワーク内では、R>0.6またはR<-0.6、調整p<0.05の相関を持つ280のノードと420のエッジを同定した。ネットワーク解析はASD Baseline群に対してのみ行い、治療後の糞便代謝物の有意な変化が観察されなかったため、糞便代謝物ではなく血液代謝物のみを対象とした[20]。
相関ネットワークは、神経伝達物質/神経活性分子、アミノ酸、インドール、タウリン、チラミン誘導体、および硫黄代謝に関連する遺伝子(KO)について、241の陽性(緑色)と179の陰性(赤色)の相互作用/相関を示した(補足資料1、図S7および図S8)。Prevotella属、Bifiobacterium属、Desulfovibrio属、酸化ストレス、異化性硫酸還元、その他本節で述べた分類群/KOについては、有意な相関ネットワークは観察されなかった。3.考察
MTTによる症状(ASD、GI)改善の主要な仮説は、腸内細菌群のリモデリングにより、健常ドナーまたはTD/コントロールの腸内細菌群に類似することであった [26,27] 。分類学的解析では、ベースラインでは多くの低い分類群の存在量が、MTT-10週後に増加することが示された(図2)。興味深いことに、2年後、分類学的組成は分析した他のグループとは異なるものになった(図2、補足図S2A)。これは、MTTが微生物組成を変えたが、時間とともにこれらの子供たちが異なる/独自の微生物組成を開発したことを示唆している。
本研究で使用した同じサンプルの以前の16S rRNA遺伝子アンプリコン測定では、処理前にPrevotella、Bifidobacterium、Desulfovibrio属の存在量が低く、MTT後に大きく改善されることが示された[7,11]。そこで、まずこれらの菌に着目した。Baselineでは、TDと比較してPrevotella属の存在量は統計的に有意ではないものの低かったが(図3)、MTT-10 wkでは8種で相対存在量がBaselineに対して有意に増加し(調整p < 0.05)、16S rRNA遺伝子アンプリコンシーケンスを用いた属レベルでの我々の既知の結果と一致した [11].先行研究では、ASDではTDと比較して、糞便中[17,23,28,29]と口腔内微生物叢でプレボテラのレベルが低いか枯渇していることが報告されている[30]。我々は糞便サンプルから多くのPrevotella種を同定したが、その中にはP. dentalis(図3)やP. denticola(補足図S4A)といった口腔内Prevotella種と類似したものもあった。我々は、MTT試験でプロトンポンプ阻害剤を使用したため、これらの経口プレボテラ菌が通常より多く口から腸に移行した可能性があると考えた[7]。腸内プレボテラの多くは食物繊維を消費する細菌である[31,32].アメリカのASDの子供におけるPrevotellaの枯渇の1つの可能な理由は、繊維分解酵素を持つ細菌の枯渇につながる西洋化された食事における繊維含有量の低下であり[9,33]、これはASDの子供の貧しいGI健康および行動の一因である可能性がある[17]。
同様に、Bifidobacterium(B. bifidum図4A;B. angulatum、補足図S4E)および硫黄還元菌(Desulfovibrio piger、図4B)の2例のプロバイオティクスはMTT-10 wk対Baselineで著しく増加し、それらの相対量はTDと同等となった(図4A,B)。これは、我々の16S rRNA遺伝子アンプリコン研究[7,11]と属レベルで一致しているが、これらの微生物の存在量は、Baselineと比較してMTT-2 yrで非有意に増加(中央値)した(p > 0.05)(図4A,B)。ASDでは、Bifidobacterium種の枯渇が広く報告されている[8,23,29,34,35]。ビフィズス菌はSCFA産生菌であり、「サイコバイオティクス」[36]、γ-アミノ酪酸(GABA)およびグルタミン酸代謝を介して腸-脳間のシグナルを調節する[37]。ビフィズス菌は、マウスの行動を改善し、うつ病様行動を予防することが報告されている[38,39,40]。Desulfovibrioは、ヒト大腸内のムチン、SCFA、アミノ酸(グルタミン酸、アラニン)を分解できる硫黄還元菌(SRB)であり、腸管上皮の健全性の維持に役立つと考えられている[41,42]。しかし、ASDのBaselineではTDの糞便サンプルと比較してDesulfovibrioが多いという、一見異なる結果を示す報告もある[43,44,45]。なお、Prevotella、Bifidobacterium、Desulfovibrioの菌種はASD BaselineとTDで有意差はなかったが、中央値はTDよりBaselineの方が低かった。MTT(10wk)後、これらの菌の存在量は有意に増加し、維持ドナー(破線赤色水平線)に近づいた(Figure 3、Figure 4)。
Lactobacillus vaginalisの相対量は、MTT-10 wkでBaselineに対して有意に増加し、TDに近い状態になった(図4C)。L. vaginalisは、一般的な膣内常在菌であり[46]、ヒトの糞便および口腔内にも報告されている[47]。Bifidobacteriumと同様に、Lactobacillus属も「サイコバイオティクス」であり、神経活性分子(GABA、グルタミン酸)を介して腸-脳接続を調節することができる[36,37]。
自閉症、特定不能の広汎性発達障害(PDD-NOS)[23]、うつ病[22]の子どもでは、アリスティペス属の相対量が高いことが報告されている。研究者らは、アリスティペスがセロトニン(インドール陽性生物)を減少させることによって腸脳軸を混乱させる可能性があり[21,22]、ラットにおいてプロピオン酸を産生することによって認知機能を損なうと仮定している[48]。興味深いことに、Alistipes finegoldiiの相対存在量は、MTT(10週および2年)後、Baselineと比較して有意に低くなり(図4D)、TDと同程度になった。AlistipesとDesulfovibrioを除くすべての分類群では、MTT(10週間)後に細菌量が変化したが、時間の経過とともに(2年)Baselineレベルに戻った(図3および図4)ことが重要である。このことは、これらの細菌におけるMTT処理の影響は一時的なものであり、より長い処理が必要であった可能性を示唆している。AlistipesとDesulfovibrioは、2年間のMTT処理後も有意な変化を示した(Figure 4)。
KOのグローバルレベルでは、BaselineではTDと比較して多くの微生物遺伝子レベルの変化が観察されたが、MTT後では微生物遺伝子量はTDと同等か健常者ドナーに近くなった(Figure 5)。このことから、MTTがASD児に良い影響を与え、代謝経路の回復に寄与していることが示唆された。これをより詳しく理解するために、特定のKOに注目した。葉酸代謝の変化や葉酸/ビタミンB9の欠乏は、ASDと関連している[49]。興味深いことに、テトラヒドロ葉酸合成酵素をコードする遺伝子であるtrmFO(K04094)は、BaselineとTDでは存在量が低かったが、MTT後、その相対量が著しく増加し、TD群に近い存在になった(図6A)。これは、MTTによって増強された微生物が宿主のために葉酸を合成する可能性があることを示唆しており、葉酸の補給がASD症状を改善することが実証されている。ASDでは、プレボテラやビフィドバクテリウム(図3A-D、図4A)のレベルが低下すると、葉酸依存性再メチル化が低下するため、葉酸産生のレベルが低下するという仮説がある[24]。
酸化ストレスはASDの病因において大きな関心事であり[50]、神経炎症[50,51]や認知障害を引き起こすことによって、ASD患者の脳におけるニューロン接続を破壊することができる[50,51]。酸化還元反応の不均衡とフォリン酸、グルタチオン、ビタミン(CおよびE)または補酵素NAD+/NADHなどの抗酸化物質の不足が、ASDにおける活性酸素の一因である可能性がある[50,52,53]。興味深いことに、K05919:スーパーオキシド還元酵素をコードする遺伝子(dfx遺伝子、SOR)の相対量はBaselineではTDに比べて低かったが、MTT(10wk、2yr)後に有意に増加し、その量はTDと同等となった(図7A)。この微生物SORは、反応性が高く毒性の高いスーパーオキシド(O2-)を毒性の低い過酸化水素(H2O2)に変換し、その後にH2Oに変換する[54,55]。SORは、SRBのような嫌気性微生物、例えばDesulfovibrioに存在する[54,56,57]。興味深いことに、Desulfovibrio pigerの相対量はBaselineでは少なかったが、MTT後に有意に増加した(図4B)。
研究者らは、硫酸塩欠乏症または硫酸塩代謝の変化が自閉症と関連していることを報告している[8,24,58,59]。我々は、微生物の異化硫酸還元に関与する2つのKOをコードする遺伝子において、相対的な存在量の違いを観察した。K01082 (BPNT1/cycQ) 3′(2′), 5′-bisphosphate nucleotidase とK00395 adenylsulfate reductase, subunit B (aprB 遺伝子)である(図8、補足図S5)。また、K01082 (BPNT1/cycQ) は硫黄還元菌Selenomonas種(補足図S9A、S10B(相対量))、Desulfovibrio piger(補足図S9B)と効果量は小さいが有意な負の相関が観察された。これらの知見は、ASDの子供における微生物の硫酸塩還元におけるアンバランスを示唆しており、MTTによってこれらのKOsレベルはTDで観察されるレベルに近づくことになる[25]。以上の結果から、BaselineのASDでは、微生物の異化性硫酸還元(硫黄代謝、補足図S5)の遺伝子量が変化していたことが示唆された。MTTが微生物の硫黄代謝に良い影響を与え、ASD児の硫黄代謝に関わる遺伝子の相対的な存在量がAfter-MTT群でTDに似てきたと推測される。もう一つの興味深い発見は、MTT後、ASD児の機能性遺伝子の相対存在量が、ドナーの相対存在量とより類似するようになったことである。
細菌とGIおよびASD症状との相関を調べた。シアノバクテリアのNostoc linckiaはBaselineのGSRSと正の相関があった(Supplemental Figures S7 and S10A)。Nostocの中にはβ-N-methylamino-L-alanine(BMAA)を産生し、腸管免疫系を標的にして慢性低悪性度炎症を引き起こす種があることが示唆されている[60]。しかし、本研究では、CARSと微生物叢の間に有意な相関は認められなかった。本研究での相関については、Kangら[20]の血漿代謝物データのみを使用し、糞便代謝物は含まなかった。糞便代謝物は、我々の以前の研究[20]で述べたように、MTT後にほとんど変化しなかった。年齢などの人口統計学的な測定値や便の粘性とも、マイクロバイオームの統計的に有意な相関は見られなかった。ASD児のMTT後の食事情報が限られていたため、食事情報は相関分析に含まれなかった。
本研究の強みは、ショットガンメタゲノムデータ解析を用いて、MTT前後のASD児の腸内マイクロバイオームと代謝経路を探索した初めての研究である点である。本研究では、より高度な分類学的分類と、MTTのような微生物介入による改善を達成するために重要と思われる微生物経路の示唆を与えている。k-mer (short sequencing fragments) alignmentを用いて配列処理を行い、マーカー遺伝子データベースを用いて分類学および機能分析を行った。18人の子供のうち3人は、MTT治療終了後の2年間に食生活を変えていた[11]。TDコホートでは10週と2年のフォローアップ時点がなく、Kangら[7,11]のようにサンプルサイズが小さく、オープンラベルデザインであった。MTT後にASDとGI症状が改善したことから,ASD児の症状改善はMTTが第一に導き,食事は子どもが落ち着いた後に補完的に影響を与える可能性があると仮定している。材料と方法
4.1. 試験の概要
このショットガンメタゲノム研究は、16S rRNA遺伝子アンプリコンシーケンスについて以前に発表したASD児の微生物叢移行療法に関する第1相オープンラベル研究の延長である[7,11]。簡単に説明すると、7~16歳の年齢範囲内で20人のTD児と18人のASD児を募集しました。試験期間中の10週間、ASD群にはバンコマイシンを2週間投与し、MoviPrepで1日腸内洗浄を行った後、高用量の液体マイクロバイオータ(Major donor)を1-2日、低用量の液体マイクロバイオータ(Maintenance donor)とプリロセック(胃酸抑制剤)を7-8週間投与しました(図1)。治療後8週間(すなわちDay 0から10週間)、およびMTT後2年(18人中16人だけが糞便サンプルを提供)に追跡評価が行われた[11]。Kangら[7,11]に記載されているように、すべての参加者の特徴および医療・食事歴が記録された。MTT治療中の食事に変化はなく、治療2年後にKangら[11]に記載されているように食事が記録された。
4.2. メタゲノム配列の決定
以前の研究から抽出した糞便DNAを配列決定に使用した[11]。DNAサンプルは3つの異なるタイムポイントからのものであった。ASDベースライン(n = 18)、10週間の治療終了時(MTT-10 wk、n = 18)、2年間のフォローアップ時(MTT-2 yr、n = 16)である。サンプルは、TD(n = 20)、主要ドナー(n = 5)、維持ドナー(n = 2)のコホートからも収集された。ショットガンメタゲノミクスでは、Illumina NextSeq 500プラットフォーム(Illumina、カリフォルニア州、米国)でDNAを配列決定し、2×150 bpペアエンドリードを、最低1000万リードでより高い配列決定深度で生成した。
4.3. 塩基配列の解析
ショットガンメタゲノムシーケンスにより、サンプルあたり28,470,588 ± 9,835,000 (mean ± SEM) のリードを得た。生リードの品質はMultiQC [61]で調べました。リードからのアダプター、長さ < 50 bp または phred < 30 の低品質リードは削除しました。ヒトゲノムの汚染を避けるため、Burrows-Wheeler aligner (bwa) [62]を用いて、UCSC Genome Browserのhg38ヒトゲノム参照データベースに対してすべてのリードをマッピングし、マッピングされたリードは廃棄した。ヒトゲノムを含まないマッピングされていないリードは、下流の解析に使用された。
バクテリアの分類学的構成は、Kraken2 (v2.0.7, https://github.com/DerrickWood/kraken2) を用いて、NCBI RefSeqデータベース [63] を用いて特徴づけした。Kraken2は、配列中のk-merの正確なアラインメントを使用し、データベースと比較することでLCA(最低共通祖先)分類群を見つける超高速分類群割り当てツールである。分類群割り当て後、種レベルの配列存在量推定アルゴリズムBracken (Bayesian re-estimation of Abundance with KrakEN, v2.6) [64] を用いて、割り当てられた分類群の存在量を再推定し、相対存在量を算出した。我々の分類学的割り当ては、細菌の系統分類を対象としていた。この著作では、本文中、「ファイロタイプ」に対して「細菌」または「細菌種」の用語を使用しています。
HUMAnN2 (the HMP unified metabolic analysis network, v2, https://github.com/biobakery/humann/tree/2.9) は、マイクロバイオーム遺伝子マーカーに関連する機能的遺伝子/パスウェイを特定するために使用された[65]。HUMAnN2は、MetaPhlAn2 (Metagenomic Phylogenetic Analysis, v2, https://github.com/biobakery/MetaPhlAn2) とそのChocoPhlAnパンゲノムデータベースと連携し、MetCyc、MinPath、UniRef90データベースを使用する[65]。HUMAn2の出力から、UniRef90と90%一致した遺伝子ファミリーアバンダンスを用いて、この情報をKO(KEGG Orthologs:機能遺伝子)に変換した。その後、各サンプルについて、すべての KO の絶対量を用いて相対量を算出した。
4.4. 糞便および血漿のメタボロミクス
超高速液体クロマトグラフィータンデム質量分析法(UHPLC-MS/MS)を用いて糞便および血漿の代謝物を測定するアンターゲットメタボロミクスアプローチは、Metabolon Inc.が以前に実施しました(https://www.metabolon.com)(アクセス日:2022年1月10日)。サンプル調製、代謝物測定、結果については、私たちの先行研究[20]に記載されています。本研究では、Kangら[20]の代謝物データを活用し、ショットガン・メタゲノミクスによるダウンストリーム解析を行います。詳細は補足資料 1 を参照。
4.5. GIおよびASD症状評価
すべてのGIおよびASD症状の測定は、[11]に詳細に記載されている。簡単に説明すると、GI症状については、腹痛、逆流、消化不良、下痢、便秘の5つのドメインを持つGastrointestinal Symptom Rating Scale(GSRS)の改訂版を使用した。また、Bristol Stool Formスケールを用いた毎日の便の記録(DSR)も記録された。ASD症状については、Parent Global Impressions-III (PGI-III), Childhood Autism Rating Scale (CARS), Aberrant Behavior Checklist (ABC), Social Responsiveness Scale (SRS), Vineland Adaptive Behavior Scale II (VABS-II) 測定がすべてのASD参加者に対してとられた。
4.6. 多様性指数の算出
MTT前後での分類学的およびKOの変化を探るため、α-多様性(シャノン指数)およびβ-多様性(JaccardおよびBray-Curtis非類似度指数)を算出した。まず、分類学的データとKOの存在量データをQiime2(v2022.2)[66]にインポートし、多様性指標を算出した。Shannon多様性指標は、一変量解析を行い(Wilcoxon signed rank test for paired, Mann-Whitney tests for unpaired)、ggpubr Rパッケージ(v0.4.0)を用いて可視化した。ベータダイバーシティについては、Qiime2での統計比較に999個の並べ換えを用いたペアワイズANOSIM(類似性分析)を用い、Qiime2とともにpythonのDokdo API(https://github.com/sbslee/dokdo, v1.14.0)を用いて可視化した。P 値は Benjamini-Hochberg 法 [67] で補正し、q 値として割り当てた。
4.7. マルチオミックスコリレーションネットワーク
細菌、代謝物、機能性遺伝子の存在量とGIやASD症状との相互作用を理解するために、相関ネットワークを導き出した。ネットワークを作成するために、細菌とKOの相対的存在量、Zスコアの代謝物、およびGIとASD症状の重症度スケールデータを相関に使用した。相関関係には、追加のデータ変換は行わなかった。変数間の関係は、ピアソンの相関係数(R>±0.6、p<0.05)を用いて意味があるものとして特徴づけられ、leave-one-out FDR補正(p<0.05)を適用した。各変数のFDR補正された相関係数とp値は、Cystoscope(v3.8.2)を用いて相関ネットワークを構築し、可視化した。接続されていないノードは、ネットワークから除外された。本研究では、糞便代謝物がMTT前後で有意な変化を示さなかったため、Kangら[20]の血漿代謝物データのみを使用した。
4.8. 統計解析とプロット
標本分布を比較する一変量解析は、分類群およびパスウェイデータについて、leave-one-out 法を用いて決定した偽発見率による仮説検定により実施した。多重仮説検定の問題は、各有意所見(p < 0.05)の偽発見率(FDR)をリーブワンアウトアプローチで決定し、p < 0.05 を有意と見なすことによって対処された。各グループにおいて、一変量解析時に相対存在量(分類群、KOともに)がゼロのサンプルの20%以上をフィルターで除外した(詳細は補足資料1に記載)。これは試験的な研究であるため、興味のありそうないくつかの有意でない(p > 0.05)変化を報告し、原稿全体を通して「有意でない」という用語を使用している。
分類学的プロットとKOsプロットはすべてPython (v3.8.5) in Jupyter Notebook (v6.1.4) でnumpy (v1.19.2), matplotlib (v3.3.2), seaborn (v0.11.0), pandas (v1.1.3), scipy (v1.5.2) 等を使って作成されたものである。MATLAB(v2018B)で受信者動作特性下面積(AUROC)を算出した(補足資料1)。代謝経路画像は、MetaCyc(Metacyc.org)を使用した[68]。図の作成・編集には BioRender (Licensed, https://biorender.com) (accessed on 15 September 2022) と Inkscape (v1.1) を使用した。5.結論
今回の結果から、ASD児のMTTは、当初少なかった多くの細菌のレベルを正常化することで、微生物組成を変化させることが示唆された。また、MTTは、以前から検出されていたPrevotella、Bifidobacterium、硫黄還元菌Desulfovibrioなどの有益な細菌を種レベルで増加させたが、2年という時間の経過とともにPrevotellaとBifidobacteriumの存在量は減少し、これらの細菌の保持にはMTT処理時間の延長や一定時間後のブースターが必要かもしれないと示唆される。同様に、MTTは多くの細菌遺伝子(KO)のレベルを正常化する結果にもなった。興味深いことに、葉酸生合成、酸化ストレス防御、硫黄代謝の微生物代謝遺伝子(KO)はASD BaselineではTDと異なっていたが、MTT後(10wk、2yr)にはTDおよび/またはドナーのレベルに近くなった(図9)。MTT前後のASDにおけるこれらの特定の微生物、機能的遺伝子発現、代謝物の役割を理解するために、さらに大規模なコホートによるメカニズム的なin vitro実験とメタトランススクリプトミクス研究を行うことを薦める。
Ijms 23 13481 g009 550図9. MTT前後のASD児のマイクロバイオームと代謝経路/KOの概要図。Gastrointestinal Symptom Rating Scale (GSRS); Childhood Autism Rating Scale (CARS)。
補足資料
以下の補足資料は、https://www.mdpi.com/article/10.3390/ijms232113481/s1、図S1:ASD児のMTT前後のαダイバーシティ、図S2:ASD児のMTT前後のJaccard距離非類似指数、図S3:ASD児のMTT前後のβダイバーシティ。ASD児のMTT前後のβダイバーシティ;図S4: 異なる分類群の相対存在度(log10変換後)の一変量比較、図S5:硫黄代謝の概要、図S6: ASDのMTT後に有意に変化したがTDと同様にはならなかった腸内細菌叢遺伝子/KOの相対存在量(log10変換後)の一変量比較;図S7: BaselineにおけるASD児の微生物、微生物代謝経路、血漿代謝物、ASD症状のネットワーク解析、図S8:マイクロバイオームと血漿代謝物との相関ネットワークのサブセット、図S9:分類群と微生物遺伝子間の相関検定、図S10:異なる分類群の相対的存在量(log10変換後)の一変比較、表S1:β多様性。Jaccard非類似度指数、表S2:β多様性。ブレイ・カーティス非類似度指数、表S3: グループ間の分類とKOの比較、表S4: グループ間の分類群数の違い、表S5:TDグループと全ASDグループの分類・KO比較、表S6: 図5からASD Baseline vs. TD児で有意に異なる37のKO/代謝経路の一覧。
著者による貢献
構想、K.N., D.-W.K., J.B.A. and R.K.-B.; データキュレーション、K.N., F.Q., J.B.A. and R.K.-B.; 正式解析、K.N., F.Q., J.B.A. and R.K.-A., R.K.-A., R.K.-B. B.、資金獲得、D.-W.K.、J.B.A.、R.K.-B.、調査、K.N.、F.Q.、J.B.A.、 R.K.-B.、方法論、 K.N., J.H., J.B.A. and R.K.-B.; プロジェクト実施、K.N., J.H., J.B.A. and R.K.-B. B.、プロジェクト管理、R.K.-B.とJ.B.A.、ソフトウェア、K.N.とF.Q.、監督、D.-W.K., J.H., J.B.A. and R.K.-B. B.、可視化、K.N.、F.Q.、執筆-原案、K.N.、F.Q.、J.B.A.、R.K.-B. 、執筆-レビューと編集、K.N.、F.Q. 、D.-W.K. 、 J.H. 、J.B.A.、R.K.-B. 。すべての著者がこの原稿を読み、同意している。
資金提供
この研究は、Finch Therapeutics, MA, USAの助成金FP00023901およびArizona Board of Regents (ABOR 6-310)の支援を受けて行われた。
施設審査委員会声明
本研究は、ヘルシンキ宣言のガイドラインに従って実施され、Kangら、2019[11]に記載されているように、施設審査委員会(アリゾナ州立大学(ASU IRBプロトコル#:00001053および# 00004890))によって承認された。原治療試験のプロトコルは、FDA(治験薬番号15886)によって承認された。
インフォームド・コンセントの表明
本研究に参加したすべての被験者からインフォームドコンセントを取得した。参加者の名前と識別子は削除され、補足資料を含む原稿のどの部分にも使用されていない。本試験は、2015 年 3 月 30 日に ClinicalTrials.gov (NCT02504554) に登録された。
データの利用可能性に関する声明
本試験で提示されたデータは、BioProject ID PRJNA782533の下、NCBI SRAリポジトリでオープンに利用可能であり、https://www.ncbi.nlm.nih.gov/bioproject/?term=PRJNA782533。
謝辞
本研究に参加してくださったASDの子どもたちとそのご家族に感謝します。Thomas Borody、Alexander Khoruts、Michael J. Sadowsky、Alessio Fasanoには、この研究の治療部分において、また、オリジナルの治験薬(IND)申請と研究において協力していただいたことに感謝したい。Finch Therapeutics(旧Crestovo)社(米国)には、本試験に標準化されたヒト腸内細菌叢を提供していただき、感謝いたします。また、ショットガンメタゲノムシーケンスを提供してくれたGenomics Core-Biodesign Institute ASUのJuan Maldonadoとチーム、クラスター(Agave)でのシーケンスデータ解析の実行に協力してくれたアリゾナ州立大学のResearch Computing Core Facilities (https://rcstatus.asu.edu/) (accessed on 15 September 2022) の Jason Yalimとチームに対して謝辞を述べたい。Elena PollardとSharon McDonough-Meansには、本研究の治療部分に協力してもらい、Ethan Howleyには原稿に対する有益なフィードバックをいただいた。
利益相反
K.N.、J.B.A.、D.-W.K.、R.K.-B.は自閉症を含む様々な症状に対するFMTやプロバイオティックスの使用に関する特許を申請/承認している。K.N.、J.B.A.、R.K.-B.は、FMTの研究に関してFinch TherapeuticsとN of Oneから研究資金を受け取っています。
参考資料
自閉症スペクトラムとは何か|CDC. オンライン公開:https://www.cdc.gov/ncbddd/autism/facts.html(アクセス日:2022年5月3日)。
自閉症スペクトラムのデータ・統計|CDC. Available online: https://www.cdc.gov/ncbddd/autism/data.html (accessed on 3 May 2022)。
Hsiao, E.Y. Gastrointestinal Issues in Autism Spectrum Disorder(自閉スペクトラム症における胃腸の問題). Harv. Rev. Psychiatry 2014, 22, 104-111. [Google Scholar] [CrossRef] [PubMed].
Restrepo, B.; Angkustsiri, K.; Taylor, S.L.; Rogers, S.J.; Cabral, J.; Heath, B.; Hechtman, A.; Solomon, M.; Ashwood, P.; Amaral, D.G.; et al. 自閉症スペクトラムと併発した胃腸症状を持つ子どもの発達・行動プロファイル.Autism. Autism Res. 2020, 13, 1778-1789. [Google Scholar] [CrossRef][PubMed]を参照してください。
Vargason, T.; McGuinness, D.L.; Hahn, J. 自閉症スペクトラム障害の子どもにおける消化器症状と経口抗生物質使用。米国民間保険加入者集団のレトロスペクティブ分析。J. Autism Dev. Disord. 2019, 49, 647-659. [Google Scholar] [CrossRef][PubMed]を参照してください。
McElhanon, B.O.; McCracken, C.; Karpen, S.; Sharp, W.G. Gastrointestinal Symptoms in Autism Spectrum Disorder(自閉症スペクトラム障害における消化器症状): メタアナリシス. ペディアトリクス 2014, 133, 872-883. [Google Scholar] [CrossRef] [PubMed].
Kang, D.W.; Adams, J.B.; Gregory, A.C.; Borody, T.; Chittick, L.; Fasano, A.; Khoruts, A.; Geis, E.; Maldonado, J.; McDonough-Means, S.; et al. Microbiota Transfer Therapy Alters Gut Ecosystem and Improves Gastrointestinal and Autism Symptoms: オープンラベル研究。マイクロバイオーム 2017, 5, 10. [Google Scholar] [CrossRef].
Adams, J.B.; Johansen, L.J.; Powell, L.D.; Quig, D.; Rubin, R.A. Gastrointestinal Flora and Gastrointestinal Status in Children with Autism-Comparisons to Typical Children and Correlation with Autism Severity.(自閉症の子どもの消化管フローラと消化管の状態-定型児との比較と自閉症の重症度との相関-). BMC Gastroenterol。2011, 11, 22. [Google Scholar] [CrossRef]を参照してください。
Krajmalnik-Brown, R.; Lozupone, C.; Kang, D.-W.; Adams, J.B. Gut Bacteria in Children with Autism Spectrum Disorders(自閉症スペクトラム障害児の腸内細菌): 複雑なコミュニティが複雑な疾患にどのように影響するかを研究することの課題と可能性。Microb. Ecol. Health Dis. 2015, 26, 26914. [Google Scholar] [CrossRef]を参照してください。
Garcia-Gutierrez, E.; Narbad, A.; Rodríguez, J.M. Autism Spectrum Disorder Associated With Gut Microbiota at Immune, Metabolomic, and Neuroactive Level.(自閉症スペクトラム障害は、免疫、メタボローム、神経活性レベルでの腸内細菌と関連している)。Front. Neurosci. 2020, 14, 578666. [Google Scholar] [CrossRef].
Kang, D.W.; Adams, J.B.; Coleman, D.M.; Pollard, E.L.; Maldonado, J.; McDonough-Means, S.; Caporaso, J.G.; Krajmalnik-Brown, R. Long-Term Benefit of Microbiota Transfer Therapy on Autism Symptoms and Gut Microbiota.(微生物移植療法の自閉症症状および腸内細菌叢に対する長期効果について). サイエンス・リポート2019, 9, 5821. [Google Scholar] [CrossRef]を参照してください。
Ruggiero, M. Fecal Microbiota Transplantation and the Brain Microbiota in Neurological Diseases(糞便微生物叢移植と神経疾患における脳微生物相). Clin. Endosc. 2016, 49, 579. [Google Scholar] [CrossRef]を参照してください。
Collins, S.M.; Surette, M.; Bercik, P. The Interplay between the Intestinal Microbiota and the Brain.(腸内細菌叢と脳の相互作用). Nat. Rev. Microbiol. 2012, 10, 735-742. [Google Scholar] [CrossRef] [PubMed].
Mayer, E.A.; Knight, R.; Mazmanian, S.K.; Cryan, J.F.; Tillisch, K. Gut Microbes and the Brain.(腸内細菌と脳。神経科学におけるパラダイムシフト。J. Neurosci. 2014, 34, 15490-15496. [Google Scholar] [CrossRef][PubMed]を参照。
Wan, Y.; Zuo, T.; Xu, Z.; Zhang, F.; Zhan, H.; Chan, D.; Leung, T.F.; Yeoh, Y.K.; Chan, F.K.L.; Chan, R.; et al. 自閉症スペクトラム障害児における予測非侵襲マーカーとしての腸管微生物相および細菌種の未発達度.Gut, Y., Zu. Gut 2022, 71, 910-918. [Google Scholar] [CrossRef] [PubMed].
Averina, O.; Kovtun, A.S.; Polyakova, S.I.; Savilova, A.M.; Rebrikov, D.; Danilenko, V.N. The Bacterial Neurometabolic Signature of the Gut Microbiota with Young Children with Autism Spectrum Disorders.(自閉症スペクトラム障害の幼児における腸内細菌叢の神経代謝シグナチャー). J. Med. Microbiol. 2020, 69, 558-571. [Google Scholar] [CrossRef]を参照してください。
Dan, Z.; Mao, X.; Liu, Q.; Guo, M.; Zhuang, Y.; Liu, Z.; Chen, K.; Chen, J.; Xu, R.; Tang, J.; et al. Altered Gut Microbial Profile Is Associated with Abnormal Metabolism Activity of Autism Spectrum Disorder.(自閉症スペクトラムの腸内細菌プロファイルは代謝異常と相関する), Gut Microbes, 11, 11, 12, 12, 12, 12. Gut Microbes 2020, 11, 1246-1267. [Google Scholar] [CrossRef]を参照してください。
Wang, M.; Wan, J.; Rong, H.; He, F.; Wang, H.; Zhou, J.; Cai, C.; Wang, Y.; Xu, R.; Yin, Z.; et al. Autism Spectrum Disorderの子供の腸内細菌叢組成の変化と関連した腸内グルタミン酸代謝の変容。mSystems 2019, 4, e00321-18.。[Google Scholar] [CrossRef]を参照してください。
Zhang, M.; Chu, Y.; Meng, Q.; Ding, R.; Shi, X.; Wang, Z.; He, Y.; Zhang, J.; Liu, J.; Zhang, J.; et al. A Quasi-Paired Cohort Strategy Reveals the Impaired Detoxifying Function of Microbes in the Gut of Autistic Children.準ペアホート戦略による自閉症児の消化管の微生物の解毒機能低下. サイエンス・アドバンテージ2020, 6, eaba3760. [Google Scholar] [CrossRef].
Kang, D.-W.; Adams, J.B.; Vargason, T.; Santiago, M.; Hahn, J.; Krajmalnik-Brown, R. Distinct Fecal and Plasma Metabolites in Children with Autism Spectrum Disorders and Their Modulation after Microbiota Transfer Therapy. mSphere 2020, 5, e00314-20.を参照。[Google Scholar] [CrossRef].
Sharon, G.; Cruz, N.J.; Kang, D.W.; Gandal, M.J.; Wang, B.; Kim, Y.M.; Zink, E.M.; Casey, C.P.; Taylor, B.C.; Lane, C.J.; et al. Autism Spectrum Disorder由来のヒト腸内細菌はマウスの行動的症状を促進します。Cell 2019, 177, 1600-1618.e17. [Google Scholar] [CrossRef]を参照してください。
Naseribafrouei, A.; Hestad, K.; Avershina, E.; Sekelja, M.; Linløkken, A.; Wilson, R.; Rudi, K. Correlation between the Human Fecal Microbiota and Depression.ヒトの糞便微生物叢とうつ病の相関。Neurogastroenterol. Motil. 2014, 26, 1155-1162. [Google Scholar] [CrossRef]を参照してください。
de Angelis, M.; Piccolo, M.; Vannini, L.; Siragusa, S.; de Giacomo, A.; Serrazzanetti, D.I.; Cristofori, F.; Guerzoni, M.E.; Gobbetti, M.; Francavilla, R. Fecal Microbiota and Metabolome of Children with Autism and Pervasive Developmental Disorder Not Otherwise Specified.(「自閉症」と「特定不能」の発達障害のある子供の便微生物相と代謝系).PlasoS ONE 2013, 8, 7, 9, 10, 12, 13, 13, 14, 14, 14, 14, 14, 14, 15, 15, 16, 17, 17, 19, 19, 19, 19. PLoS ONE 2013, 8, e76993。[Google Scholar] [CrossRef]を参照してください。
Indika, N.L.R.; Deutz, N.E.P.; Engelen, M.P.K.J.; Peiris, H.; Wijetunge, S.; Perera, R. Sulfur Amino Acid Metabolism and Related Metabotypes of Autism Spectrum Disorder.自閉症スペクトラム障害における硫黄アミノ酸代謝と関連するメタボタイプ。仮説のための生化学的エビデンスのレビュー。Biochimie 2021, 184, 143-157. [Google Scholar] [CrossRef] [PubMed].
Anantharaman, K.; Hausmann, B.; Jungbluth, S.P.; Kantor, R.S.; Lavy, A.; Warren, L.A.; Rappé, M.S.; Pester, M.; Loy, A.; Thomas, B.C.; et al. Disimilatory Sulfur Cycleを形成する微生物群の拡大した多様性(Expanded Diversity of Microbial Groups That Shape the Dissimilatory Sulfur Cycle). ISME J. 2018, 12, 1715-1728. [Google Scholar] [CrossRef]を参照してください。
Allegretti, J.R.; Kassam, Z.; Mullish, B.H.; Chiang, A.; Carrellas, M.; Hurtado, J.; Marchesi, J.R.; McDonald, J.A.K.; Pechlivanis, A.; Barker, G.F.; and al. Effects of Fecal Microbiota Transplantation With Oral Capsules in Obese Patients.日本における肥満患者における腸管細菌移植の効果. Clin. Gastroenterol. Hepatol. 2020, 18, 855-863.e2. [Google Scholar] [CrossRef][PubMed]を参照してください。
Kazemian, N.; Ramezankhani, M.; Sehgal, A.; Khalid, F.M.; Kalkhoran, A.H.Z.; Narayan, A.; Wong, G.K.S.; Kao, D.; Pakpour, S. The Trans-Kingdom Battle between Donor and Recipient Gut Microbiome Influences Fecal Microbiota Transplantation Outcome.(カゼミアン、N、ラムザンカーニ、M、セガール、ア、カリード、エム、カラン、エー、エー、ザ、ザ、パカ、サカ、ザカ、ザカ、サカ、ザカ、ザカ、サカ、ザカ)。Sci. Rep. 2020, 10, 18349. [Google Scholar] [CrossRef]を参照してください。
Kushak, R.I.; Winter, H.S.; Buie, T.M.; Cox, S.B.; Phillips, C.D.; Ward, N.L. Analysis of the Duodenal Microbiome in Autistic Individuals.自閉症患者における十二指腸マイクロバイオームの解析: 炭水化物消化との関連性。J. Pediatr. Gastroenterol. Nutr. 2017, 64, e110-e116. [Google Scholar] [CrossRef]を参照してください。
Kang, D.W.; Park, J.G.; Ilhan, Z.E.; Wallstrom, G.; LaBaer, J.; Adams, J.B.; Krajmalnik-Brown, R. Reduced Incidence of Prevotella and Other Fermenters in Intestinal Microflora of Autistic Children.(自閉症児の腸内細菌叢におけるプレボテラとその他の発酵物質の発生率低下)。PLoS ONE 2013, 8, e68322. [Google Scholar] [CrossRef].
Qiao, Y.; Wu, M.; Feng, Y.; Zhou, Z.; Chen, L.; Chen, F. Alterations of Oral Microbiota Distinguish Children with Autism Spectrum Disorders from Healthy Controls.口腔内細菌叢の変化により、自閉症スペクトラムの子どもと健常対照者の区別がつく。サイ・レップ 2018, 8, 1597. [Google Scholar] [CrossRef]を参照してください。
Kovatcheva-Datchary, P.; Nilsson, A.; Akrami, R.; Lee, Y.S.; de Vadder, F.; Arora, T.; Hallen, A.; Martens, E.; Björck, I.; Bäckhed, F. Dietary Fiber-Induced improvement in Glucose Metabolism Is Associated with Increased Abundance of Prevotella.(食物繊維が誘発するブドウ糖代謝改善には、Prepotellaの増加量が関係している). セルメターブ 2015, 22, 971-982. [Google Scholar] [CrossRef]を参照してください。
David, L.A.; Maurice, C.F.; Carmody, R.N.; Gootenberg, D.B.; Button, J.E.; Wolfe, B.E.; Ling, A.V.; Devlin, A.S.; Varma, Y.; Fischbach, M.A.; et al. Diet Rapidly and Reproducibly Alters the Human Gut Microbiome.(ダイエットは、急速に再現性を持って、ヒトの腸内細菌を変える)。ネイチャー 2014, 505, 559-563. [Google Scholar] [CrossRef]を参照してください。
Vangay, P.; Johnson, A.J.; Ward, T.L.; Al-Ghalith, G.A.; Shields-Cutler, R.R.; Hillmann, B.M.; Lucas, S.K.; Beura, L.K.; Thompson, E.A.; Till, L.M.; and al. US Immigrationizes the Human Gut Microbiome(米国移民がヒト腸管マイクロバイオームを欧米化する). Cell 2018, 175, 962-972.e10. [Google Scholar] [CrossRef][PubMed]を参照してください。
Xu, M.; Xu, X.; Li, J.; Li, F. Association Between Gut Microbiota and Autism Spectrum Disorder(腸内細菌叢と自閉スペクトラム症との関連)。系統的レビューとメタアナリシス。フロントサイキアトリー2019, 10, 473. [Google Scholar] [CrossRef] [PubMed].
Coretti, L.; Paparo, L.; Riccio, M.P.; Amato, F.; Cuomo, M.; Natale, A.; Borrelli, L.; Corrado, G.; Comegna, M.; Buommino, E.; et al. Autism Spectrum Disordersの幼児におけるGut Microbiota Features in Young Children with Autism Spectrum Disorders. Front. Microbiol. 2018, 9, 3146. [Google Scholar] [CrossRef][PubMed]を参照してください。
Dinan, T.G.; Stanton, C.; Cryan, J.F. Psychobiotics.サイコバイオティクス: A Novel Class of Psychotropic. Biol. Psychiatry 2013, 74, 720-726. [Google Scholar] [CrossRef][PubMed]を参照してください。
Sarkar, A.; Lehto, S.M.; Harty, S.; Dinan, T.G.; Cryan, J.F.; Burnet, P.W.J. Psychobiotics and the Manipulation of Bacteria-Gut-Brain Signals.(サイコバイオティクスとバクテリア-脳シグナルの操作), Vol. トレンド・ニューロサイエンス. 2016, 39, 763-781. [Google Scholar] [CrossRef][PubMed]を参照。
Kosuge, A.; Kunisawa, K.; Arai, S.; Sugawara, Y.; Shinohara, K.; Iida, T.; Wulaer, B.; Kawai, T.; Fujigaki, H.; Yamamoto, Y.; et al. 熱滅菌Bifidobacterium Breveは慢性社会敗北ストレスを受けたマウスのうつ様行動とインターロイキン1β発現を抑制する.Brah. Brain Behav. Immun. 2021, 96, 200-211. [Google Scholar] [CrossRef]を参照してください。
Tian, P.; Zou, R.; Song, L.; Zhang, X.; Jiang, B.; Wang, G.; Lee, Y.K.; Zhao, J.; Zhang, H.; Chen, W. Bifidobacterium Longum Subspecies Infantis Strain CCFM687 摂取により、慢性ストレス誘発うつマウスの感情行動と中枢性 BDNF パスウェイを制御する、消化器微生物相を再形成して。Food Funct. 2019, 10, 7588-7598. [Google Scholar] [CrossRef]を参照してください。
Luk, B.; Veeraragavan, S.; Engevik, M.; Balderas, M.; Major, A.; Runge, J.; Luna, R.A.; Versalovic, J. Postnatal Colonization with Human "Infant-Type" Bifidobacterium Species Alters Behavior of Adult Gnotobiotic Mice.(幼若ヒトビダニ属菌の出生後のコロニー化が成体マウスの挙動を変える). PLoS ONE 2018, 13, e0196510. [Google Scholar] [CrossRef]を参照してください。
Dordević, D.; Jančíková, S.; Vítězová, M.; Kushkevych, I. Hydrogen Sulfide Toxicity in the Gut Environment.腸内環境における硫化水素の毒性。炎症過程における硫酸還元菌と乳酸菌のメタアナリシス。J. Adv. Res. 2020, 27, 55-69. [Google Scholar] [CrossRef].
Derrien, M.; van Passel, M.W.J.; van de Bovenkamp, J.H.B.; Schipper, R.G.; de Vos, W.M.; Dekker, J. Mucin-Bacterial Interactions in the Human Oral Cavity and Digestive Tract.(ヒト口腔および消化器官におけるムチン-細菌相互作用). Gut Microbes 2010, 1, 254-268. [Google Scholar] [CrossRef].
Tomova, A.; Husarova, V.; Lakatosova, S.; Bakos, J.; Vlkova, B.; Babinska, K.; Ostatnikova, D. Gastrointestinal Microbiota in Children with Autism in Slovakia(スロバキアの自閉症児の消化管微生物相). Physiol.Behav. 2015, 138, 179-187. [Google Scholar] [CrossRef] [PubMed].
Finegold, S.M. Desulfovibrio Species Are Potentially Important in Regressive Autism.(ファインゴールド、S.M. デサルフォビブリオ種は退行性自閉症において潜在的に重要である)。Med. Hypotheses 2011, 77, 270-274. [Google Scholar] [CrossRef] [PubMed].
Finegold, S.M.; Dowd, S.E.; Gontcharova, V.; Liu, C.; Henley, K.E.; Wolcott, R.D.; Youn, E.; Summanen, P.H.; Granpeesheh, D.; Dixon, D.; et al. Autistic and Control ChildrenのFecal Microfloraのパイロシーケンススタディ. Anaerobe 2010, 16, 444-453. [Google Scholar] [CrossRef] [PubMed].
細菌性膣炎治療のためのプロバイオティクス. Cochrane Database Syst. Rev. 2009, 4, CD006289. [Google Scholar] [CrossRef] [PubMed].
乳酸菌の消化管内における生態的役割:基礎および生物医学的研究への示唆. Appl. Environ. Microbiol. 2008, 74, 4985-4996. [Google Scholar] [CrossRef].
MacFabe, D.F.; Cain, N.E.; Boon, F.; Ossenkopp, K.P.; Cain, D.P. Effects of the Enteric Bacterial Metabolic Product Propionic Acid on Object-Directed Behavior, Social Behavior, Cognition, and Neuroinflammation in Adolescent Rats.(思春期ラットの物体指向行動、社会行動、認知、神経炎に対する腸内細菌代謝産物の影響): 自閉スペクトラム症との関連性。Behav. Brain Res. 2011, 217, 47-54. [Google Scholar] [CrossRef]を参照してください。
フライ、R.E.、ロシニョール、D.A.、スカヒル、L.、マクドゥーグル、C.J.、ヒューバーマン、H.、クアドロス、E. 自閉症スペクトラムの葉酸代謝異常の治療法. Semin Pediatr. Neurol. 2020, 35, 100835. [Google Scholar] [CrossRef]を参照してください。
Bjørklund, G.; Meguid, N.A.; El-Bana, M.A.; Tinkov, A.A.; Saad, K.; Dadar, M.; Hemimi, M.; Skalny, A.V.; Hosnedlová, B.; Kizek, R.; et al. 自閉スペクトラム症における酸化的ストレス(Oxidative Stress in Autism Spectrum Disorder, Vol.1, No. Mol. Neurobiol. 2020, 57, 2314-2332. [Google Scholar] [CrossRef]を参照してください。
Frye, R.E.; Vassall, S.; Kaur, G.; Lewis, C.; Karim, M.; Rossignol, D. Emerging Biomarkers in Autism Spectrum Disorder(自閉症スペクトラム障害における新たなバイオマーカー): 系統的レビュー。をご覧ください。を参照。Med. 2019, 7, 792. [Google Scholar] [CrossRef]を参照してください。
Frye, R.E.; Delatorre, R.; Taylor, H.; Slattery, J.; Melnyk, S.; Chowdhury, N.; James, S.J. Redox Metabolism Abnormalities in Autistic Children Associated with Mitochondrial Disease.(ミトコンドリア病に関連する自閉症児の酸化還元代謝異常)。Transl. Psychiatry 2013, 3, e273. [Google Scholar] [CrossRef]を参照してください。
El-Ansary, A.; Al-Ayadhi, L. GABAergic/Glutamatergic Imbalance Relative to Excessive Neuroinflammation in Autism Spectrum Disorders(自閉症スペクトラム障害における過剰な神経炎症に関連するギャバ/グルタミン酸の不均衡). J. Neuroinflammation 2014, 11, 189. [Google Scholar] [CrossRef][PubMed]を参照してください。
Mishra, A.; Aja, E.; Fletcher, H.M. Role of Superoxide Reductase FA796 in Oxidative Stress Resistance in Filifactor Alocis.(スーパーオキシド還元酵素FA796の酸化ストレス耐性における役割). Sci. Rep. 2020, 10, 9178. [Google Scholar] [CrossRef] [PubMed].
Jenney, F.E.; Verhagen, M.F.J.M.; Cui, X.; Adams, M.W.W. 嫌気性微生物(Anaerobic Microbes: スーパーオキシドディスムターゼを用いない酸素解毒。サイエンス 1999, 286, 306-309. [Google Scholar] [CrossRef] [PubMed].
Dermoun, Z. Oxygen Defense in Sulfate-Reducing Bacteria(硫酸還元菌の酸素防御). J. Biotechnol. 2006, 126, 87-100. [Google Scholar] [CrossRef].
また、このような環境下において、「環境汚染物質」を「環境汚染物質」として認識し、「環境汚染物質」を「環境汚染物質」として認識し、「環境汚染物質」を「環境汚染物質」として認識し、「環境汚染物質」を「環境汚染物質」として認識し、「環境汚染物質」を「環境汚染物質」として認識し、「環境汚染物質」を「環境汚染物質」として認識し、「環境汚染物質」を「環境汚染物質」として認識し、「環境汚染物質」を「環境汚染物質」として認識することができる。J. Biol. Chem. 2000, 275, 27021-27026. [Google Scholar] [CrossRef].
Williams, R.J. Sulfate Deficiency as a Risk Factor for Autism(自閉症の危険因子としての硫酸塩欠乏症). J. Autism Dev. Disord. 2020, 50, 153-161. [Google Scholar] [CrossRef]を参照してください。
Waring, R.H.; Klovrza, L. Sulphur Metabolism in Autism(自閉症における硫黄代謝). J. Nutr. Environ. Med. 2009, 10, 25-32. [Google Scholar] [CrossRef]を参照してください。
Nunes-Costa, D.; Magalhães, J.D.; G-Fernandes, M.; Cardoso, S.M.; Empadinhas, N. Microbial BMAA and the Pathway for Parkinson's Disease Neurodegeneration(微生物BMAAとパーキンソン病神経変性の経路). Front. Aging Neurosci. 2020, 12, 26. [Google Scholar] [CrossRef]を参照してください。
Ewels, P.; Magnusson, M.; Lundin, S.; Käller, M. MultiQC.複数ツールの解析結果をまとめる。複数のツールおよびサンプルの解析結果を1つのレポートにまとめる。バイオインフォマティクス 2016, 32, 3047-3048. [Google Scholar] [CrossRef]を参照してください。
Li, H.; Durbin, R. Burrows-Wheeler Transformによる高速かつ高精度なロングリードアライメント. バイオインフォマティクス 2010, 26, 589-595. [Google Scholar] [CrossRef].
Wood, D.E.; Lu, J.; Langmead, B. Improved Metagenomic Analysis with Kraken 2.(クラーケン2によるメタゲノム解析の改善)。Genome Biol. 2019, 20, 257. [Google Scholar] [CrossRef][PubMed]を参照してください。
Lu, J.; Breitwieser, F.P.; Thielen, P.; Salzberg, S.L. Bracken.(ブラッケン)。メタゲノミクスデータにおける種の存在量の推定。PeerJ Comput. Sci. 2017, 2017, e104. [Google Scholar] [CrossRef]を参照してください。
Franzosa, E.A.; McIver, L.J.; Rahnavard, G.; Thompson, L.R.; Schirmer, M.; Weingart, G.; Lipson, K.S.; Knight, R.; Caporaso, J.G.; Segata, N.; et al. Species-Level Functional Profiling of Metagenomes and Metatranscriptomes.メタゲノムの種類別機能とそのプロファイリング.Nature. Nat. Methods 2018, 15, 962. [Google Scholar] [CrossRef][PubMed]を参照してください。
Bolyen, E.; Rideout, J.R.; Dillon, M.R.; Bokulich, N.A.; Abnet, C.C.; Al-Ghalith, G.A.; Alexander, H.; Alm, E.J.; Arumugam, M.; Asnicar, F.; et al. Reproducible, Interactive, Scalable and Extensible Microbiome Data Science Using QIIME 2.Nat.に基づく再現性の高い対話型拡張性微生物データサイエンス。Biotechnol 2019, 37, 852-857. [Google Scholar] [CrossRef]を参照してください。
Benjamini, Y.; Hochberg, Y. Controlling the False Discovery Rate: 多重検定に対する実用的で強力なアプローチ.としている。Soc. Ser. B (Methodol.) 1995, 57, 289-300. [Google Scholar] [CrossRef]を参照してください。
Caspi, R.; Altman, T.; Billington, R.; Dreher, K.; Foerster, H.; Fulcher, C.A.; Holland, T.A.; Keseler, I.M.; Kothari, A.; Kubo, A.; et al. The MetaCyc Database of Metabolic Pathways and Enzymes and the BioCyc Collection of Pathway/Genome Databases.[Nature](メタサイクス・データバー・ザ・メタバイクス・アンド・エンジム・ザ・バイオサイコン・データベーシス・オブ・パスウェイ/ゲノム・データベース). Nucleic Acids Res 2014, 42, D459-D471. [Google Scholar] [CrossRef]をご参照ください。
出版社からのコメント:MDPIは出版された地図や機関所属の管轄権主張に関して中立的な立場をとっています。
© 2022 著者によるものです。ライセンシー MDPI, Basel, Switzerland. この記事は、クリエイティブ・コモンズ 表示(CC BY)ライセンス(https://creativecommons.org/licenses/by/4.0/)の条件に基づいて配布されるオープン・アクセス記事です。
共有と引用
MDPIおよびACSスタイル
Nirmalkar, K.; Qureshi, F.; Kang, D.-W.; Hahn, J.; Adams, J.B.; Krajmalnik-Brown, R. Shotgun Metagenomics Study Suggestions Alteration in Sulfur Metabolism and Oxidative Stress in Children with Autism and Improvement after Microbiota Transfer Therapy(ショットガンメタゲノミクス研究で、自閉症の子供における硫酸代謝の変化と酸化ストレスが明らかになった。Int. J. Mol. Sci. 2022, 23, 13481. https://doi.org/10.3390/ijms232113481
AMAスタイル
Nirmalkar K, Qureshi F, Kang D-W, Hahn J, Adams JB, Krajmalnik-Brown R. Shotgun Metagenomics Study Suggests Alteration in Sulfur Metabolism and Oxidative Stress in Children with Autism and Improvement after Microbiota Transformation Therapy(ショットガンメタゲノミクス研究による、自閉症児における硫黄代謝の変化と酸化ストレスの提案、微生物叢移植療法による改善)。International Journal of Molecular Sciences. 2022; 23(21):13481。https://doi.org/10.3390/ijms232113481。
シカゴ/トゥラビアンスタイル
Nirmalkar, Khemlal, Fatir Qureshi, Dae-Wook Kang, Juergen Hahn, James B. Adams, and Rosa Krajmalnik-Brown.の各氏が執筆。2022. "Shotgun Metagenomics Study Suggests Alteration in Sulfur Metabolism and Oxidative Stress in Children with Autism and Improvement after Microbiota Transfer Therapy" International Journal of Molecular Sciences 23, no. 21: 13481." https://doi.org/10.3390/ijms232113481.
この記事が気に入ったらサポートをしてみませんか?
