中枢神経系と腸内細菌叢
167巻4号 2016年11月3日 915-932ページ
レビュー
中枢神経系と腸内細菌叢
著者リンク オーバーレイパネルGil Sharon 1, Timothy R. Sampson 1, Daniel H. Geschwind 2 3 4 5, Sarkis K. Mazmanian 1
もっと見る
概要
シェア
引用する
https://doi.org/10.1016/j.cell.2016.10.027
権利とコンテンツを手に入れる
エルゼビアユーザーライセンスの場合
オープンアーカイブ
神経発達は、内因性シグナルと外因性シグナルの両方によって支配される複雑なプロセスである。歴史的には脳の研究が行われてきましたが、末梢からの入力は多くの神経学的な症状に影響を及ぼします。実際、不安、うつ病、認知、自閉症スペクトラム障害(ASD)などにおいて、腸と脳とのコミュニケーションが示唆されるデータが出てきています。健康で機能的な脳の発達は、腸からの分子シグナルなどの環境的な手がかりを統合する生前・生後の重要な出来事によって左右されます。これらの手がかりは、主にすべての動物に存在する共生細菌のコンソーシアムであるマイクロバイオームに由来しています。ここ数年の研究により、腸内細菌は血液脳関門の形成、髄鞘形成、神経新生、ミクログリアの成熟といった基本的な神経再生過程に関与していること、さらに動物の行動の多くの側面を調節していることが明らかになっています。ここでは、神経発達とマイクロバイオームの生物学的交差点について議論し、腸内細菌が神経系の発達と機能、および精神的健康と病気のバランスに不可欠な貢献者であるという仮説を探求する。
前の記事へ 次の記事へ
メインテキスト
はじめに
哺乳類の脳の発達は、ヒトでは思春期から成人期初期まで続く複雑なプロセスである。さらに、脳の発達過程では、胎児期に細胞が特定の領域や層へ並外れた大規模な長距離移動を行い、さらに長い距離(多くは細胞体の直径数百メートル)を横断してそのプロセスをナビゲーションし、行動の基盤となる特定の回路を構築します(Geschwind and Rakic, 2013, Marín and Rubenstein, 2003).これらの事象は、複雑で、生前・生後の時間経過が長いため、環境要因に非常に敏感で、脆弱でさえある。実際、脳の発達を支配するプロセスの多くは、外因的な合図や経験によって駆動され、生成的および退行的な事象を通じて発達中の脳を形成しています。腸は分子宇宙への最大の入り口であるため、様々な食物成分が発達中の脳と直接相互作用し、成熟した脳の機能変化を誘発することが示されています(Chang et al., 2009, Zeisel, 2004)。また、現在、腸内細菌が脳の発達過程を指示し促進する役割を果たし、健康への長期的影響があるとの証拠が次々と出ています(図1および表1)。

ダウンロード 高解像度画像ダウンロード(998KB)
ダウンロード フルサイズ画像をダウンロードする
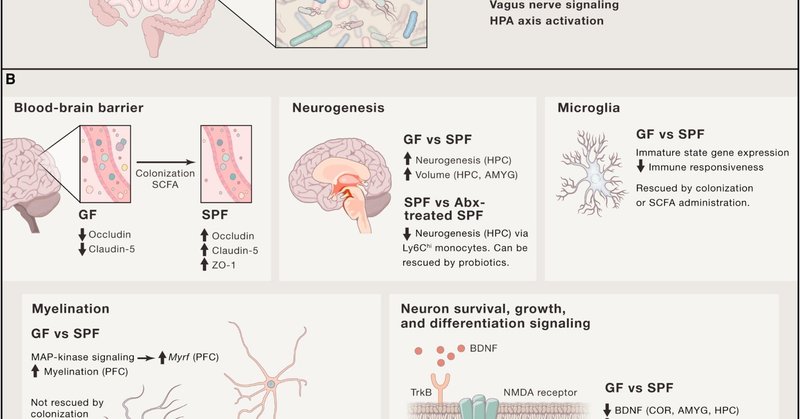
図1. 腸内細菌と基本的な発達過程の接点
腸内細菌とその産物が直接的または間接的に駆動する基本的な発達過程。
(A)腸内細菌は、様々な直接的および間接的なメカニズムを介して脳へのメッセージを中継する。
(B)神経発達の基本的なプロセスは、GF動物のコロニー形成や抗生物質による腸内細菌の減少の結果、調節される。具体的には、以下のプロセスが調節される:血液脳関門(BBB)形成および完全性(Branisteら、2014)、神経新生(Möhleら、2016、Ogbonnayaら、2015)、ミクログリアの成熟および隆起(Ernyら、2015、Matcovitch-Natanら、.2016)、髄鞘形成(Gacias et al., 2016, Hoban et al., 2016)、および神経トロフィン(Bercik et al., 2011a、Bercik et al., 2011b、Desbonnet et al., 2015)、神経伝達物質(Bercik et al., 2011a, O'Mahony et al., 2015)とそのそれぞれの受容体の発現が挙げられる。
表1. マイクロバイオームおよび微生物産物の摂動は、マウスモデルおよびヒトの行動学的結果に影響を及ぼす可能性がある
マイクロバイオームへの処置/摂動 行動への影響 既知/推定メカニズム(相関による) 参考文献
出生前効果
Abxの子孫は不安様行動や活動低下、社交性の低下などを示した dysbiotic microbiome Tochitani et al, 2016, Degroote et al, 2016
高脂肪食による社会的欠損と子孫の反復行動 生体内微生物の異常、VTAシナプス可塑性とオキシトシン産生の欠損 Buffington et al., 2016
ペプチドグリカンの子孫は認知機能の低下を示す 胎児皮質におけるFoxG1誘導を介したTLR-2媒介のニューロプロリフィケーション Humann et al, 2016
出生前ストレスによる子孫のマイクロバイオーム、腸、脳のメタボロームの変化 生体内マイクロバイオームの異常、子孫の脳の遊離アミノ酸レベルの変化 Jašarević et al., 2015b.
Poly(I:C)投与による母体免疫活性化 子のマイクロバイオームとメタボロームの変化 反復行動、不安様行動、社会性障害、コミュニケーション 障害の増加 IL-6 と IL-17A を介した行動と皮質の発達異常; 生物多様性マイクロバイオーム異常 Smith ら、2007、Hsiao ら、2013、Choiら、2016年
プロピオン酸の子孫は不安様行動を示した Foley et al, 2014
産後の影響
周産期Abx内臓知覚過敏症のマイクロバイオーム異常;脊椎腰仙部における疼痛知覚に関与する各種遺伝子の発現低下 O'Mahony et al, 2014
Abx(短期) 短期的な抗不安作用 生体内微生物の異常;海馬のBDNF量が増加、扁桃体の量が減少;交感神経、副交感神経経路に依存しない表現型 Bercik et al., 2011a
Abx(長期)抗不安作用、認知障害 デスボネットら、血清中のトリプトファン増加、キヌレニン減少、海馬のノルアドレナリン増加、扁桃体のL-DOPA増加、海馬のBDNF減少、視床下部のバソプレシン発現減少 Desbonnet et al., 2015
無菌動物の記憶形成障害では、海馬のCA1領域でBDNFとc-Fosの発現が減少している Gareau et al.2011
無菌動物 GFスイス・ウェブスターをBALB/cの微生物群にコロニー形成すると探索行動が増加し、GF BALB/cマウスをスイス・ウェブスターの微生物群に相互コロニー形成すると探索行動が減少する スイス・ウェブスターの微生物群にコロニー形成したGFスイス・ウェブスターマウスは、BALB/cマウスの微生物群にコロニー形成したGFマウスと比べて海馬のBDNFレベルが高く、扁桃体のレベルは低い Bercik et al, 2011a.
GFマウスはSPFマウスと比較して、運動活性が上昇し、不安様行動が減少した。GFマウスはSPF対照と比較して、線条体のノルアドレナリン、ドーパミン、セロトニンのターンオーバーが上昇した; 前頭皮質のNGFI-A、海馬の基底外側扁桃体およびCA1領域のBDNF、樹状回のドーパミンD1受容体の発現低下、海馬、前頭皮質、線条体の遺伝子発現の違い、シナプトフィジンとPSD-95の発現上昇(シナプト形成の促進) Diaz Heijtz et al. , 2011
無菌動物では不安様行動が減少 GFマウスでは扁桃体のNR2Bの発現が減少、歯状回ではBDNFの発現が増加、5HT1Aの発現が減少 Neufeld et al., 2011
無菌動物ではストレス誘発性HPA反応の増加 GF動物ではSPF対照と比較して、ストレス誘発性アセチルコリンとコルチコステロンの増加(HPA軸)、大脳皮質でのNR-1、大脳皮質と海馬でのNR-2aの発現低下、大脳皮質と海馬でのBDNFレベル低下 Sudo et al., 2004
無菌動物が社会的行動を減少させた Desbonnet et al, 2014
プロバイオティクス投与により社会的行動が増加し、扁桃体における特定のBDNF転写物の発現が減少した Arentsen et al., 2015
プロバイオティクス投与 クロストリジウム・ブチリカムの投与により、血管性認知症モデルマウスの認知機能が回復 糞便および脳内のSCFA酪酸レベルの上昇と相関し、海馬におけるBDNF-PI3K/Akt経路の活性化を伴う Liu et al., 2015
プロバイオティクス投与 Clostridium butyricumによる糖尿病マウスの脳虚血・再灌流障害からの保護 Akt活性化による抗アポトーシス作用、細菌の多様性の回復 Sun et al, 2016.
プロバイオティクスLactobacillus farciminisの投与により、マウスにおけるストレス誘発性の腸管透過性と神経炎症が抑制された PVNにおけるCRF発現の増加、血中炎症性サイトカインの発現の増加、コルチコステロンの血漿レベルの上昇 Ait-Belgnaoui et al, 2012
プロバイオティクスの投与 乳酸菌helveticus R0052とビフィズス菌longum R0175(プロビオスティック)は、マウスの水回避ストレスの影響から保護し、腸のバリア機能障害を減少させました。 プロバイオティクス投与によりHPA/ANS関連コルチコステロンの血漿レベルが減少しました、 ストレス誘発の結果、アドレナリン、ノルアドレナリン、さらにPVN、扁桃体、海馬CA3、歯状回などの核が活性化されました。さらに、シナプス形成やミクログリアなどに関連する様々な遺伝子の発現がプロバイオティクス投与の結果減少し、BDNFは増加しました。さらに、歯状回ではシナプス形成が増加した。 アイト-ベルグナウイら、2014年
プロバイオティクスの投与 乳酸菌ラムノサス(JB-1)は、マウスのストレスによる不安・抑うつ様行動を抑制 プロバイオティクスは、ストレスによる血漿コルチコステロンのレベルを低下させ、脳内のGABAB1b、GABAAα1、GABAAα2の発現レベルを迷走神経依存的に変化させた Bravo et al.., 2011
プロバイオティクスの投与 Lactobacillus rhamnosus (R0011) および Lactobacillus helveticus (R0052) (Lacidofil)は、マウスの不安様行動を抑制し、海馬のBDNFおよびc-Fos発現を増加させた Gareauら、2011年
プロバイオティクス投与により、マウスの社会的欠損を改善 プロバイオティクスにより、PVNのオキシトシン産生細胞レベルとVTAのシナプス可塑性が回復 Buffington et al., 2016
GFマウスにプロバイオティクスを投与、または発育初期にSPFマイクロバイオームでコロニー形成すると、ストレスによるアセチルコリンとコルチコステロンの発現が正常化した。
プロバイオティクスの投与 Bifidobacterium longum NCC3001は、マウスの大腸炎誘発不安様行動を抑制した プロバイオティクスは、迷走神経依存的に不安を減少させたが、病理は減少しなかった;プロバイオティクス発酵培地で培養した腸管ニューロンの興奮性はコントロールより低い Bercik et al, 2011b.
プロバイオティクスを摂取した発酵乳製品は、健常人の感情や感覚を処理する領域の脳活動に影響を与えた プロバイオティクスは、島皮質と体性感覚皮質における感情的な顔の注意課題に対する活動を低下させた Tillisch et al..., 2013
プロバイオティクスBacteroides fragilisの投与により、マウスの不安行動および反復行動が改善された 微生物群集の部分的回復、腸管バリア機能の回復 Hsiao et al..., 2013
哺乳類のマイクロバイオームは、体内および体外の様々なニッチに関連する微生物(細菌、古細菌、真菌、ウイルスなど)のユニークな集合体から構成されています。動物モデルやヒトを対象とした研究では、腸内細菌と免疫系の発達や機能が密接に関連しています。免疫細胞全体が存在するにはマイクロバイオームが必要であり、1型糖尿病、喘息、炎症性腸疾患などの免疫疾患を促進または改善する特定の微生物が発見されている(Round and Mazmanian, 2009)。腸内細菌叢が免疫系に大きな影響を与えるのであれば、その影響が神経系に及ばないわけがない。実際、関連するすべての微生物を取り除いた無菌(GF)マウスは、従来の(特異的病原体フリー;SPF)マウスと比較して、リスクテイキング行動や多動性が増加し、学習・記憶障害も見られる(Clarke et al., 2013, Gareau et al., 2011, Diaz Heijtz et al. さらに、GFマウスは、海馬における5-ヒドロキシトリプタミン受容体(5-HT1A)、神経栄養因子(BDNFなど)、およびNMDA受容体サブユニットの発現に変化を示す(Bercik et al, 2011a, Diaz Heijtz et al. 2011、Sudo et al.、2004)、また、血液脳関門機能の低下、前頭前野の髄鞘の増加(Braniste et al.、2014、Hoban et al.、2016)を示しています(表1および図1)。また、うつ病や不安症(Foster and McVey Neufeld, 2013)、自閉症スペクトラム障害(ASD)(Krajmalnik-Brown et al., 2015)、統合失調症(Severance et al., 2014)、さらにはパーキンソン病(PD)やアルツハイマー病(AD)(Keshavarzian et al., 2015)といった神経精神疾患におけるマイクロバイオームの役割の可能性について、ほとんどが動物モデルからの予備知識とはいえエビデンスもある。
本総説では、ヒトと動物モデルの両方において、哺乳類マイクロバイオームと脳の交わりについて議論します。微生物コミュニティが確立される出生前発達、出生後および成人期における微生物と脳との相互作用の発達の軌跡とその結果を探る。さらに、宿主に関連する微生物が、健康維持と病的状態の増強の両方において積極的な役割を果たす可能性のあるパラダイムを明らかにします。マウスモデルやヒトの脳の構造的・機能的事象と微生物の活動を関連づけることで、腸内細菌が神経発達や神経変性に寄与する経路を提案します。これらの関連を制御する微生物と宿主の経路を明らかにすることで、行動障害、精神疾患、神経変性疾患に対処するための新しいアプローチを提供できる可能性があります。
神経発達の主要なプロセスは、母体および新生児の腸内細菌叢の変化と一致する
出生前の脳の発達
ヒトでは受胎後3週目に胃形成が完了すると、エピブラストから神経幹細胞が分化し、最終的に大人の脳になるシーケンスの最初のイベントとなる(図2)。ヒトで最も精巧な大脳皮質では(Geschwind and Rakic, 2013)、神経前駆細胞(NPC;放射状グリア細胞とも呼ばれる)が脳室帯で増殖する。神経前駆細胞や神経細胞は、中間帯を通り皮質板まで細胞体直径の距離を移動するが、NPCは増殖帯に留まる(Kriegstein and Alvarez-Buylla, 2009, Rakic, 1988)。皮質の神経新生が妊娠中期までに(大部分)完了するのに対し、グリア形成は主に生後のプロセスである。神経系の前-後および背-腹のパターニングは、身体をパターン化するのと同じ基本的な規則、因子、経路を介して起こり、脳の空間的および構造的分化の基礎となる「プロトマップ」を支配する制御因子勾配の特徴は、発達中の胚性脳の胚葉帯に存在する(Marín and Rubenstein, 2003, Rakic, 1988, Stiles and Jernigan, 2010)。
ダウンロード 高解像度画像ダウンロード(613KB)
ダウンロード フルサイズ画像をダウンロードする
図2. 哺乳類の脳発達における主な出来事
マウスとヒトの発達軌跡と主要な神経発達事象(Knuesel et al., 2014, Pressler and Auvin, 2013, Semple et al., 2013から引用)。E、胚性年齢、P、出生後年齢、GSW、妊娠週数。右パネルの細菌分類群は、各ライフステージで優勢なものである(Bäckhed et al., 2015, Lloyd-Price et al., 2016, Nuriel-Ohayon et al., 2016)。
大脳皮質の発達過程で大規模な神経細胞の拡大と移動が行われた後、妊娠の最終週(38-41)に約50%の神経細胞がアポトーシスを起こし、ネットワークに統合され、神経栄養シグナルに支えられたものだけが生き残ります(Ceni et al., 2014)(図2)。神経栄養因子、中でも脳由来神経栄養因子(BDNF)は、神経細胞の生存のためのシグナルとして機能し、様々な細胞集団の維持と分化を促進し(Ichim et al., 2012)、神経回路形成の様々な段階を仲介する(Park and Poo, 2013)。神経栄養仮説によると、神経細胞がより多くの接続を行うほど、その周囲のニューロトロフィンの濃度が高くなり、したがって生存の可能性が高くなります(Oppenheim、1989)。神経新生は、微生物の存在によって影響を受ける(図1)。具体的には、成体GFマウスの背側海馬における神経新生は、従来型マウスと比較して増加します(Ogbonnaya et al.、2015)。興味深いことに、離乳時にGFマウスをコロニー化してもこの表現型を逆転させることはできず、生後ごく早い時期に微生物のシグナルが海馬の神経新生率を低下させることが示されました。さらに、成体GFマウスは扁桃体と海馬(特にCA2/3)の体積増加を示し、樹状突起の形態が異なるが、GFとSPFの動物間で脳の総体積に違いは記録されなかった(Luczynski et al.、2016a)。ニューロトロフィンとその受容体を介して、神経細胞の分化と生存を支配する経路を利用することで、腸内微生物は脳の様々な領域の神経細胞の運命、ひいては神経発達と健康に影響を与えることができます。
神経細胞、アストログリア、オリゴデンドロサイトとは対照的に、ミクログリアは、卵黄嚢のマクロファージの原始的なサブセットから派生した中枢神経系(CNS)に常駐する自然免疫細胞です。まだ議論の余地がありますが、最近の報告では、ミクログリアは単球由来ではなく、脳損傷後にCNSを補充する骨髄由来のマクロファージ(具体的にはLy-6ChiCCR2+単球)とは異なる、より早い時期に発生し、異なる細胞マーカーを発現することが示されています(ベネットら、2016、Ginhouxら、2010、Nayakら、2014、Barvelら、2012)。一方、ミクログリアはCD45-c-kit+赤血球系前駆細胞に由来し、CNSにおいてCD45+c-kit-CX3CR1+細胞として成熟することが示された。マウスでは、ミクログリアが胚8.5日目(E8.5)までに循環を通じて脳に入り、早ければ生後6日目にミクログリアマーカーTmem119を発現し始め、生後28日目には脳全体に完全に隆起することが研究で示されています(Bennett et al., 2016、Nayak et al., 2014)(図2)。ミクログリアは卵嚢前駆細胞に由来し、侮辱を受けると骨髄由来のマクロファージによって補充されることがあります。どちらの細胞タイプも、初期発生時に微生物のシグナルを受けることがあります(Erny et al., 2015, Khosravi et al., 2014)。最近、ミクログリアの発生と成熟における微生物叢の中心的な役割が明らかになりました(Erny et al.、2015、Matcovitch-Natan et al.、2016)。微生物叢が存在しない場合、マウスは著しく発達状態が変化したミクログリアを保有する(図1)。これらのミクログリアは、その発生的成熟の停止を示す形態学的特性と遺伝子発現プロファイルを示し、その後、未熟な状態に維持される(Erny et al., 2015, Matcovitch-Natan et al., 2016)。特に、GFマウス由来のミクログリアは、ウイルス感染や微生物関連分子パターン(MAMPs)に対する反応が限定的であることが知られています。このような欠陥のある応答は、短鎖脂肪酸(SCFA)の投与によって回復することができる(Erny et al.、2015)。
血液脳関門(BBB)は妊娠中に形成され、脳と循環の間の選択的なバリアとして機能する。BBBの形成における腸内細菌叢と微生物代謝物の重要性は、GFマウス(Braniste et al., 2014)で例証されています(図1、図2)。腸内細菌が存在しない場合、BBBは従来の飼育動物と比較して高分子に対する透過性が高く、脳内皮における主要なタイトジャンクションタンパク質の発現低下が介在しています。さらに、GF動物のコロニー形成、あるいは腸内細菌発酵の結果生成される酪酸SCFAを投与すると、透過性は低下しました(Braniste et al., 2014)。これに対応して、無菌状態の胎児のBBBは、成人のBBBと比較して透過性が高い(Møllgård and Saunders, 1986)。最近、隣接するクモ膜下腔の脳脊髄液と脳内液から深頸部リンパ節に排出する脳のリンパ管系が発見された(Aspelund et al.、2015)。このネットワークにより、様々な免疫細胞や高分子・代謝物が脳内外を容易に行き来できるようになっています(Aspelund et al.、2015、Louveau et al.、2015)。BBBと脳リンパ管は、循環する免疫細胞や可溶性分子(宿主由来と微生物由来のホルモンや神経伝達物質を含む)など、様々なシグナルを脳に伝えるゲートウェイとして機能し、迷走神経の刺激とともに、腸から脳への微生物シグナルの直接・間接伝達を促進するメカニズムを示しています。
妊娠中の母親の腸と膣のマイクロバイオームと子孫の行動への影響
母親のマイクロバイオームは、女性の人生の他の期間と比較して、妊娠中は特徴的で動的に変化します(DiGiulio et al., 2015, Koren et al., 2012, MacIntyre et al., 2015, Nuriel-Ohayon et al., 2016, Romero et al., 2014a)。妊娠の進行に伴い、様々な分類群の存在量が変化し、あるものが他のものより優勢になります。例えば、腸内では、一部のプロテオバクテリアとアクチノバクテリアは、妊娠第1期と比較して、妊娠第3期に相対的な存在量が増加するようです (DiGiulio et al., 2015, Koren et al., 2012)(図2)。妊娠中の膣マイクロバイオームは、ラクトバチルス種によって支配されたままですが、妊娠が進むにつれて、種組成は、コミュニティ状態タイプ(CST)と呼ばれる安定した共通の状態の間で変化します。膣内の微生物多様性が高いCSTは、早産と関連しています(DiGiulio et al., 2015, Romero et al., 2014b)。哺乳類の胎児は、一般的に予測されているように必ずしも無菌ではないことを示唆するデータもあります。胎盤と、時には胎児を取り巻く羊水が、異なる細菌集団を保有していることを提唱する研究(Aagaard et al., 2014, DiGiulio, 2012, Kuperman and Koren, 2016, Zheng et al., 2015a)があるが、Lauderと同僚(2016)が示したように、これらの知見は依然として議論の余地があり、さらなる調査が必要だ。この情報を検証し、治療や診断に応用するためには、多大な作業が必要です。
母親の微生物集団の変動は、子孫のマイクロバイオーム、神経発達、および行動を調節することが示唆されています(Jašarević et al.、2015a)。抗生物質の周産期投与は、ヒトとマウスモデルの両方において、子孫の健康と免疫状態に影響を与える可能性があります(Russell et al.、2013、Stensballe et al.、2013)。げっ歯類のダムに非吸収性抗生物質を投与すると、母体と子孫の両方の腸内細菌叢がシフトし、コントロールと比較して活動低下が誘発されました(Degroote et al., 2016, Tochitani et al.) さらに、子孫は不安様行動と運動欠損を示しました(Tochitani et al., 2016)。同様に、妊娠初期のダムに非吸収性抗生物質を投与した結果、子孫のWistarラットは社会的行動の低下と不安の増加を示した(Degroote et al., 2016)。最近の報告では、母親の肥満と子どものASD診断との関連を示す臨床データ(Krakowiak et al.、2012)に続き、母親の食事も子孫の微生物集団と行動の両方を変える可能性があることが示されています(Buffington et al.、2016)。マウスの母親の高脂肪食は、通常の飼料を与えたコントロールと比較して、社会性が低く、反復行動を示す子孫を生み出すのに十分であった。これらのマウスの社会的欠損は、高脂肪食の子孫の腸内細菌叢で欠損していることが判明したラクトバチルス・ロイテリの投与によって回復させることができた(Buffington et al.) 同様に、妊娠中の抗生物質治療によって誘発された行動障害は、コントロールダムと子孫を交配することで救済される可能性があります(Degroote et al., 2016, Tochitani et al.) これらの例は、母親の微生物集団が子孫の行動結果に影響を与える可能性があることを示しています。これらの変化が、母親の行動への影響を通じて間接的に媒介されるのか、あるいは胎児の脳の発達を直接的に変化させるのかは、まだ明らかにされていません。
胎児環境にはマイクロバイオームが存在する場合もしない場合もありますが、胎児が二次代謝産物、発酵産物、LPS、ペプチドグリカン(PG)など、母親からの微生物産物にさらされることは間違いありません。Gomez de Agüeroら(2016)は、それ以外のGFマウスを大腸菌の補助栄養株で一過性にコロニー化する際に母体腸内で生成される微生物代謝物が胎児区画に到達し、出生前に特定の発達プログラムを誘導できることをエレガントに証明した。細菌の細胞壁成分も子孫に影響を与えることがあります: PGは胎盤を通過して胎児の脳に到達し、前脳の発達と神経新生の重要な制御因子であるFOXG1の発現増加を介して前頭葉皮質のニューロンの増殖を誘導することができます。出生前にPGに曝露された子孫は、認知機能の低下を示す(Humann et al.、2016)。出生前および新生児期に他の微生物製品に暴露されると、子孫の行動に影響を及ぼします。皮下注射されたプロピオン酸またはLPSに曝露されたダムの子孫は、不安様行動を示した(Foley et al.、2014)。これらの効果は、子孫が新生児期に曝露された場合でも観察され、母親の行動ではなく、子孫への直接的な影響が示唆された(Foley et al., 2014)。母親のマイクロバイオーム、子孫に伝わるマイクロバイオーム、それらの代謝物、その他の微生物産物は、発達プログラムを健全な軌道で推進する上で重要であり、摂動されると子孫の行動障害を誘発するのに十分なものである。
母体の免疫系は、腸内細菌と胎児の両方と密接に相互作用している。妊娠中の免疫活性化は、マイクロバイオームだけでなく、子孫の生理、神経病理、行動にも深刻な影響を及ぼす可能性があります(Estes and McAllister, 2016, Knuesel et al., 2014によるレビュー)。大規模な疫学研究により、出生前の感染症が子孫の統合失調症リスクを有意に高めることが実証されており(Khandaker et al., 2013)、決定的ではないがASDへの関与も支持するデータがある(Gardener et al., 2011)。これらの知見に基づき、母体免疫活性化(MIA)の齧歯類モデルが開発され、感染の代用としてToll様受容体リガンドLPSまたはPoly(inosine:cytosine)を出生前に投与すると、子孫の神経病理と行動に有害な影響を引き起こす(EsteとMcAllister、2016)。さらに、MIA後の子孫のマイクロバイオームの変化は、これらの子孫の血清中のメタボロームプロファイルに影響を与えることが報告されています(Hsiao et al., 2013)。ヒト常在菌であるBacteroides fragilisの介入は、MIAによって誘発された多くの悪影響を改善した(Hsiao et al.、2013年)。具体的には、B. fragilisの投与により、腸管バリアの透過性が低下し、潜在的な病原性代謝物の濃度が低下しました(Hsiao et al.、2013年)。さらに、最近の研究では、MIAの表現型がTh17細胞とIL-17Aの産生に依存していることが判明しました(Choi et al., 2016)。興味深いことに、このTヘルパー細胞の発達は、以前、腸内細菌に依存することが示されました(Ivanov et al.、2009年)。MIAモデルは、腸内細菌と免疫系が協調して子孫の生理、行動、神経病理を形成する一つの可能な軸を示しています。
出生後の脳発達
生後の脳の発達は、ヒトの最初の10年間におけるシナプスの過剰生産と排除を含む、シナプスの発達と可塑性に主に支配されています(Paolicelli et al., 2011, Zuchero and Barres, 2015)。出生後の神経新生は非常に限られており、側脳室の脳室下帯と海馬歯状回の顆粒下帯に限られているが、グリア細胞は出生後の発達を通して、また部分的には生涯を通じて増殖、移動、分化を続けている。グリア前駆細胞は前脳の脳室下帯で増殖し、脳の様々な部位に移動し、そこでオリゴデンドロサイトとアストロサイトに分化する(Menn et al.、2006)。オリゴデンドロサイト前駆細胞は、隣接する軸索に突起を伸ばし、オリゴデンドロサイトに分化してこれらの軸索を髄鞘化する。この過程は、大脳皮質の前頭葉で生後20~30年にわたり続き、人間の高次認知機能の発達に不可欠である(図2)。
成体マウスの長期的な抗生物質投与は、成体マウスの海馬における神経新生の低下を誘導するのに十分であり、新規物体認識課題における欠損をもたらす(Möhle et al.、2016)。自主的な運動とプロバイオティクス処理は、これらの表現型を救済するのに十分である(Möhle et al.、2016年)。抗生物質を投与した動物の脳では、ミクログリアではなく、CD45+CD11b+Ly-6chiCCR2+単球の数の減少が観察された。驚くべきことに、CCR2-/-ノックアウト動物、およびLy-6chi-単球枯渇動物は、海馬の神経新生が減少していることが示された。最後に、抗生物質処理動物へのLy-6chi単球の養子移入は、海馬の神経新生表現型を救済するのに十分であり、循環単球が成人の神経新生に重要な役割を果たすことを示している(Möhle et al., 2016)。これらの報告は、神経新生、アポトーシス、シナプス刈り込みがマイクロバイオームからのシグナルによって制御されている可能性を示唆しています。しかし、これらのプロセスにおけるマイクロバイオームの役割を、動物モデルとヒトの両方で機械的に研究するためには、さらなる研究が必要です。成人の神経新生はセロトニンによっても促進され(Allenina and Klempin, 2015)、腸内細菌は腸内と脳のさまざまな領域の両方でセロトニン作動性経路の役割を果たすことが示されている(O'Mahony et al.によるレビュー、(2015)。
生後脳の発達期には、アストロサイトとミクログリアが補体の活性化とそれに続く貪食によって弱い神経細胞シナプスの刈り込みを促進すると考えられている(Hong and Stevens, 2016)。例えば、ミクログリアが存在しない場合、成体脳は著しく多くのシナプスを保有し、これらのグリア細胞がシナプスの刈り込みに必要であることを例示している(Paolicelli et al., 2011, Zhan et al., 2014).補体成分はCNSの複数の細胞から分泌されるが、アストロサイトとミクログリアは補体の主要な生産者である(Bahrini et al., 2015, Stephan et al., 2012)。ミクログリアは、補体活性化カスケードの最初のタンパク質であるC1qを大量に生産し、様々な補体受容体を発現します(Schafer et al.、2012、Stephan et al.、2012)。シナプス刈り込みは、他のプロセスと同様に、細胞の分化と移動の後に神経細胞の接続を形成し、生後の脳発達における主要な出来事の後に神経細胞ネットワークを洗練させます。
神経細胞の軸索における適切な伝導は、情報と信号の中継に不可欠であり、髄鞘形成は、思春期まで続く健康な脳の発達に重要なプロセスです(Davison and Dobbing, 1966)。2つの報告では、無傷の腸内細菌叢の存在が髄鞘形成を調節することが示されました。これらの研究では、抗生物質による治療(Gacias et al., 2016)またはGFマウス(Hoban et al., 2016)の結果として、他の脳領域ではなく前頭前野でミエリン関連転写物が増加した(図1)。興味深いことに、抗生物質処理は非肥満糖尿病(NOD)マウスにおいてミエリン関連遺伝子の発現上昇を誘導するのに十分であり、これらのマウスからC57BL/6マウスへのマイクロバイオーム移植によって移行できたが(Gacias et al., 2016)、SPFマイクロバイオータによるGF動物のコロニー形成はミエリン表現型を救済しなかった(Hoban et al., 2016)。これらの観察から、早期のマイクロバイオームへの曝露が、その後のマイクロバイオームの変化に対する動的な反応に必要であることが示唆されます。さらに、オリゴデンドロサイトの発生と分化は様々なシグナルに依存しており、その中にはケモカインCXCL1とその受容体CXCR2がある。注目すべきは、虚血性脳卒中モデルマウスの脳において、異なるマイクロバイオータを持つマウスでCXCL1の発現が異なって誘導されることが示され、さらなる調査が必要であるが、恒常性と発生時の役割の可能性を示唆していることである(Benakis et al., 2016).
生後間もない腸内細菌叢と脳の発達・行動への影響
胎児が無菌状態であるという前提のもと、乳児が微生物の世界と最初に直接出会うのは出産時である。経腟分娩で生まれた乳児は、乳酸菌とプレボテラ属を中心とした、母親の腟に近い微生物集団にコロニー形成されます(Dominguez-Bello et al., 2010)(図2)。一方、帝王切開(C-section)で生まれた乳児は、StaphylococcusやCorynebacteriumなどの皮膚微生物にさらされ、コロニー形成されます(Bäckhed et al., 2015、Dominguez-Bello et al., 2010)。このような異なる微生物集団に最初にさらされることは、新生児の健康と発達をめぐるさまざまな影響を及ぼし、長期的な影響を及ぼす。さらに、出生前のストレスは膣内細菌叢を変化させ、その後、子孫の腸内細菌叢とメタボロームをリモデリングすることが示されている(Jašarević et al.、2015b)。帝王切開で生まれた子どもは、自己免疫疾患のリスクが高いことが報告されています(Sevelsted et al.、2015年)。しかし、新生児に母親由来の膣内微生物を曝露することで、膣内由来の微生物の状態に対するある程度の回復が期待できます(Dominguez-Bello et al., 2016)。乳児のマイクロバイオームは、食事の変化や抗生物質治療のような様々な摂動に対して非常に敏感です(Bäckhed et al., 2015, Koenig et al., 2011, Yassour et al., 2016)。さらに、乳児は、親や兄弟との親密な交流や新しい環境への曝露を通じて、新規微生物の垂直的獲得にさらされる(Bäckhedら、2015、Bordenstein and Theis、2015、Rosenberg and Zilber-Rosenberg, 2016)。Bäckhedら(2015)は、生後1年間のさまざまな段階における特徴的な分類群を特定しました。新生児の腸は主に好気性で、Bifidobacterium、Enterococcus、Escherichia/Shigella、Streptococcus、Bacteroides、Rothiaが生息していますが、1歳までに腸内細菌集団は母親のものに著しく近づき、より嫌気的になります(図2)。この段階で、子どもはすでに他の細菌に加えて、Clostredium、Ruminococcus、Veilonella、Roseburia、Akkermansia、Alistipes、Eubacterium、Faecalibacterium、Prevotellaでコロニー形成されています。生後3年間の腸内細菌叢は、より従順で、摂動しやすい。興味深いことに、一部の細菌は母親から新生児に感染するため、妊娠中の母親にプロバイオティクスを投与すると、特定の種が新生児に移行する可能性があります(Dotterud et al., 2015)。したがって、この時期は健康で安定したマイクロバイオームを確立するために重要です(Lloyd-Price et al., 2016, Yatsunenko et al., 2012)。
抗生物質の投与や食事の大幅な変更、あるいは逆にプロバイオティクス微生物による増強によってマイクロバイオームが破壊されると、微生物群集とその生涯の軌跡に大きな影響を及ぼします。微生物群集の擾乱は、動物実験で示唆されているように、代謝、生理、免疫状態に長期的な影響を及ぼし、発達中の個体に大きな影響を与える可能性があります(Blaser, 2016, Kuperman and Koren, 2016, Zeissig and Blumberg, 2014).また、生後1年間の抗生物質投与が、その後のうつ病や行動障害と相関しているとの報告もあります(Slykerman et al.、2016)。出生前または出生後の抗生物質の投与は、動物モデルにおいて母親またはその子孫の生理学的状態を変化させ、その後、子孫の脳の発達の軌跡に影響を与えるか、あるいは母親の行動に対する主要な影響を介して行動を調節する可能性があります。ラットの新生児をバンコマイシンで短期間処理しても、成人期の不安・抑うつ様行動には影響がなかった。しかし、成人期にこれらのラットは内臓過敏症を示し、腸内細菌が侵害受容に影響を与えることが示されました(Amaral et al., 2008, O'Mahony et al., 2014)。成体マウスでは、非吸収性抗生物質を7日間投与することで、不安様行動を減少させるのに十分でした。興味深いことに、この効果は短期間であり、2週間以内に行動はベースラインに正常化しました(Bercik et al.、2011a)が、これはマイクロバイオームが初期状態に戻ったと考えられるからです。離乳期から成人期までの長期的な広域抗生物質投与は、マイクロバイオームを再構築し、その後、脳化学と行動を変調させました(Desbonnet et al.、2015)。これに対応して、GF動物はSPF動物と比較して、さまざまな行動および発達の表現型を示します(Arentsen et al., 2015, Bercik et al., 2011a, Desbonnet et al., 2014, Gareau et al., 2011, Diaz Heijtz et al., 2011, Luczynski et al., 2016b, Neufeld et al., 2011)(表1および図1)。これらの観察結果は、マイクロバイオームと行動の間に密接な関係があることを示し、それらが相互作用する経路の可能性を示唆しています。
プロバイオティクスの投与は、一過性または永続的に特定の微生物で集団を増強し、マイクロバイオームのプロファイルと機能を変化させるだけでなく、宿主との相互作用をもたらすことができます。プロバイオティクス細菌は、マウスモデルやヒトにおいて、様々な症状を変化させたり、逆転させたり、予防したりすることが実証されています。さらに、糞便微生物叢移植(FMT)による健康なコンソーシアムによる腸内微生物集団の再構成の実験も進行中です(Borody and Khoruts, 2011, Hourigan and Oliva-Hemker, 2016)。有益な細菌は、動物において、ストレスや不安に対する反応、抑うつ様行動の減少、社会的行動の促進、反復行動の減少、認知機能やコミュニケーションの改善などをもたらすことが明らかになりました(Ait-Belgnaoui et al., 2012, Ait-Belgnaoui et al., 2014, Bercik et al., 2011b, Bravo et al., 2011, Buffington et al., 2016, Gareau et al., 2011, Hsiao et al., 2013, Sudo et al., 2004, Sun et al., 2016)。この概念は人間にも拡大され、発酵乳製品(数種類のプロバイオティクス細菌を含む)を摂取した健康なボランティアは、感覚と感情の処理を制御する脳領域において、fMRIで測定した感情的な顔の注意課題中に異なる脳活動を示した(Tillischら、2013)。
脳と腸内細菌集団の間のコミュニケーションが双方向であることを示唆する証拠が増えています(Bailey et al., 2011, Carabotti et al., 2015, Moussaoui et al., 2014, Park et al.、2013)。マウスの母子分離モデルを用いて、De Palmaら(2015)は、早期の生活ストレスに応じた腸内細菌叢の深い違いが、不安様表現型をもたらすことを実証しました。さらに、扁桃体における遺伝子発現は、GF動物とSPF動物で異なっています(Stiling et al.、2015)。腸内細菌による相互作用も報告されており、特定の細菌、あるいは完全な微生物群が宿主のストレス様行動やうつ病様行動に影響を与えた(Bercik et al., 2011a、Gacias et al., 2016、Suto et al., 2004)。これらの例が、腸と脳の直接的な相互作用によって引き起こされるのか、それとも疾患状態によって誘発される他の生理学的要因によって媒介されるのかはまだ不明ですが、これらの報告などは、マイクロバイオーム、消化管、および脳の間の相互作用の可能性を例示しています。
成人の "定常状態 "のマイクロバイオーム
成人期には、マイクロバイオームは細菌の存在量と多様性において相対的な平衡状態に達し、安定した環境や健康状態のもとでは大きく変化することはない。マイクロバイオームを形成する既知の決定要因は、遺伝(Goodrich et al., 2016)、食事(Carmody et al., 2015, David et al., 2014)、ライフスタイル(Allen et al., 2015, Kang et al., 2014)、地理(Rampelli et al., 2015, Yatsunenko et al., 2012)。健康は、「明らかな疾患がないこと」として、むしろ曖昧に定義されています(Aagaard et al., 2013, Lloyd-Price et al., 2016)。健康なヒトのマイクロバイオームについては、最近Lloyd-Priceら(2016)によって広範囲にレビューされています。ヒトのマイクロバイオームはニッチに特化しており、微生物の多様性と存在量はニッチごとに大きく異なっています。これらのニッチはそれぞれ特定の微生物群によってコロニー形成されており、バクテロイデーテス門とファーミキューテス門が腸を、ストレプトコッカス属が口腔を、コリネバクテリウム、プロピオニバクテリウム、スタフィロコッカスが皮膚を、ラクトバシラスが膣を支配しています (Lloyd-Price et al., 2016) (図2)。微生物の多様性が高いことは、健康や機能的な冗長性と相関しています(Lozupone et al., 2012, Moya and Ferrer, 2016)。重要なのは、健康なマイクロバイオームは、再発する軽度の障害を受けた場合でも、時間的に安定していることです(Dethlefsen et al., 2008, Oh et al., 2016, Schloissnig et al., 2013)。マイクロバイオームの多様性の低下、あるいは冗長性の欠如は、複数の疾患で報告されている(Lloyd-Price et al.、2016)。
神経発達障害および気分障害におけるマイクロバイオーム
神経発達障害は、古典的に遺伝的な観点から研究されています(Parikshak et al., 2015, de la Torre-Ubieta et al., 2016)。しかし、神経発達障害では胃腸の併発や食物アレルギーが多く、腸内細菌叢の役割が示唆されています(de Theije et al.、2014)。したがって、患者および対照の糞便サンプルにおける細菌集団のプロファイリングを通じて、これらの疾患における微生物の役割に対する評価が得られています。最近の報告では、マウスモデルや介入研究を用いて、マイクロバイオームやその破壊が様々な神経疾患の病態に寄与するという考え方が支持されています。齧歯類モデルにおけるエビデンスは、腸内細菌叢とストレスや不安との直接的な関連を示唆しています(総説:Foster and McVey Neufeld, 2013)。動物モデルにおけるこれらの観察は、IBDの腸内細菌叢とストレス障害を関連付けるヒト被験者のデータによって支持されています(Bonaz and Bernstein, 2013, Fond et al., 2014)。
自閉症スペクトラム障害
自閉症スペクトラム障害(ASD)児の腸内細菌叢は、複数の異なるコホートにおいて様々な方法論で研究されており、研究間のコンセンサスはほとんど報告されていない。ASDとコントロールの間の種の豊かさとその多様性の違いは繰り返し報告されているが(De Angelis et al., 2013, Finegold et al., 2002, Finegold et al., 2010, Kang et al., 2013, Parracho et al., 2005, Son et al., 2015, Williams et al., 2011, Williams et al., 2012)、これらの小規模研究は一貫した画像を生成できないかのように見える。ASD患者の腸内細菌叢は、神経型コントロールと比較して、クロストリジア種の存在量と多様性が増加し、非胞子形成性嫌気性菌と微好気性菌が全般的に増加しています(De Angelis et al., 2013, Finegold et al., 2002, Finegold et al., 2010, Parracho et al., 2005)。胃腸の併存疾患は、コントロールと比較してASDの子どもで有意に多く見られます(Mannion et al., 2013, McElhanon et al., 2014)。これらの併存疾患は、これらの子どもの腸内細菌叢の違いと一致することが多い(Sonら、2015、Williamsら、2011、Williamsら、2012)。興味深いことに、Sutterellaは、胃腸症状を呈するASD児の腸管上皮と密接に関連していることが判明しましたが、対照児には存在しませんでした(Williams et al.、2012年)。さらに、Kangら(2013)は、ASDの腸内細菌集団からPrevotellaなどの特定のプロバイオティックメンバーが存在しないことを報告し、特定の微生物でマイクロバイオームを増強することが有益であることを示唆しています。これらの研究やその他の研究は、自閉症におけるマイクロバイオーム(または特定の微生物)と脳との間の潜在的な関係を示しています。標準化された方法論を用いた大規模な施設横断研究は、ASD患者の腸内細菌叢における有意差の正体を明らかにするのに役立つだろう。その後、ASDにおける腸内細菌叢の特性に関する機能的研究が進めば、腸内細菌叢が病態や行動に寄与するメカニズムに光が当たるでしょう。また、発達過程における特定の微生物種と脳との相互作用を理解することで、この謎めいた疾患の病因を解明することができるかもしれません。
統合失調症(Schizophrenia
現在までのところ、統合失調症のマイクロバイオームに関する研究はほとんど存在しません。口腔咽頭マイクロバイオームにおける乳酸菌の発生率が、対照群と比較して高いことが報告された(Castro-Nallar et al.、2015年)。興味深いことに、乳酸菌特異的なファージも高濃度で発見されました(Yolken et al., 2015)。別の研究では、統合失調症患者の血液特異的マイクロバイオームが、コントロールと比較して、アルファおよびベータ多様性が高いことが報告されています(Mangul et al., 2016, Severance et al., 2013)。これらの違いが集団全体で一貫しているかどうかを示すためには、大規模な集団でのさらなる研究が必要です。さらに、この疾患に関連するマイクロバイオームをプロファイリングし、統合失調症の病因における潜在的な役割を機構的に検証する必要がある。
うつ病
齧歯類モデルにおけるエビデンスは、腸内細菌がうつ病様行動に関与していることを示唆しています(Bravo et al., 2011, Desbonnet et al., 2010, Mello et al., 2013)。消化器症状はうつ病と関連しており、患者の約20%がそのような症状を報告しています(Mussell et al., 2008)。うつ病の発症は、脳内の激しい炎症エピソードや、逆にミクログリア機能の低下に伴って起こることが多いため、うつ病やこの疾患のサブセットはミクログリア障害であるとする仮説がある(Yirmiya et al.、2015)。興味深いことに、ミクログリアの活性化を抑制することが知られているテトラサイクリン系抗菌薬であるミノサイクリンは、ネズミ(Molina-Hernándezら、2008、Zhengら、2015b)およびヒト(Miyaokaら、2012)において抑うつ行動を低下させ、強力な抗うつ薬として示唆されている。ミクログリアの成熟と活性化におけるマイクロバイオームの役割に関する最近の証拠(Erny et al., 2015, Matcovitch-Natan et al., 2016)に照らせば、マイクロバイオームがミクログリアの成熟と活性化に影響を与えることによってうつ病に影響を与えると推測するのは説得力があります。ただし、ミノサイクリンの抗うつ作用が、抗菌作用によるものか、ミクログリア活性化の抑制によるものか、あるいは両者の組み合わせによるものかは、まだ確定していないことに留意する必要がある。最近、Zhengら(2016)は、大うつ病性障害(MDD)患者における腸内細菌叢のβ多様性が健常対照と有意に異なり、MDD関連微生物集団ではアクチノバクテリアが有意に多く、バクテロイデーテスが少ないことを示しています。さらに、著者らはMDDとコントロールのヒトサンプルをGFマウスに移植し、MDDサンプルのレシピエントはコントロールと比較して、うつ病様表現型を示すことを示しました(Zheng et al., 2016)。これらの知見は別のグループでも再現され、うつ病では細菌の豊かさと多様性が低下することが報告され、ラットへの糞便移植によりうつ病様表現型が伝達されることがわかりました(Kelly et al.、2016)。マウスとヒトの研究は、マイクロバイオームがうつ病様行動の推進に積極的な役割を果たす可能性を示唆し、治療法開発の新たな道筋の可能性を示唆する、心ときめくものです。
老年期の神経変性とマイクロバイオーム
加齢に伴い、哺乳類は生理的な変化を受け、病気に対する感受性が高まります。興味深いことに、いくつかの消化器疾患の発症率は加齢とともに増加し(Britton and McLaughlin, 2013)、診断された消化器疾患の有病率は65歳以上で約24%(Alameel et al, 2012)である。注目すべきは、腸管神経系は成人期から加齢とともに変性していくことです。腸管神経叢と粘膜下神経叢の両方で、コリン作動性神経と腸グリア細胞が失われる(Phillips and Powley, 2007)。この変性は、高齢者に多く見られる腸管運動症状の増加の一因となっています(O'Mahony et al.、2002年)。
マイクロバイオームもまた、高齢者集団(65歳以上)において大きなリモデリングを受けます(Biagi et al.、2012、O'Toole and Claesson、2010、Salazar et al.、2014)(図2)。高齢者の糞便マイクロバイオームでは、乳幼児や若年層と比較して、細菌分類群の大きな変化が報告されており、これらの変化は高齢者の健康状態や虚弱と相関しています(Claesson et al., 2011, van Tongeren et al.) 注目すべきは、成人期の腸内環境では、ファーミキューテスがバクテロイデーテスを上回っているのに対し、高齢者ではバクテロイデーテスに有利な比率にシフトしているように見えることである(Claesson et al., 2011, Mariat et al., 2009)。具体的には、Bacteroides、Alistipes、Parabacteroides、Proteobacteria(特にγ-proteobacteria)が、若年層と比較して高齢者では有意に多くなっています(Claesson et al. さらに、さまざまな研究から、地域で暮らす高齢者のマイクロバイオームは、短期または長期ケア施設に滞在する高齢者のマイクロバイオームと比較して、若い成人のマイクロバイオームと同様の微生物多様性を有することが示されています(Claesson et al.、2012)。Langilleら(2014)は、高齢のマウスでは、若いグループと比較して同様の違いが生じ、マウスの虚弱性と高い相関があることを報告しました。高齢者コホートにおけるLactobacillus rhamnosus GG摂取の効果を検証した臨床研究では、このプロバイオティクスが、有益な微生物の生存と成長、およびSCFA産生の上昇を好む抗炎症表現型に向けて細菌集団を再構築することがわかりました(Eloe-Fadroshら、2015)。高齢者集団のマイクロバイオームは、若年層のそれとは大きく異なり、多様性と回復力が低く、環境因子や介入によって調節される可能性があります。
驚くべきことに、百寿者の腸内細菌叢は、他の成人のものと大きく異なります(Biagi et al., 2010, Biagi et al., 2016)。Biagiら(2016)は、Bacteroidaceae、Lachnospiraceae、およびRuminococcaceaeファミリーの種からなるコア腸内細菌叢が、累積存在量が減少しながら、生涯を通じてヒト宿主と関連していることを発見しました。具体的には、Coprococcus、Roseburia、Faecalibacteriumは年齢と負の相関があることがわかりました(Biagi et al.、2016)。他の属は年齢と正の相関があり、その中にはOscillospiraとAkkermansiaがある(Biagi et al.、2016)。興味深いことに、特定の亜優勢細菌種が百寿者に濃縮されており、その一部は宿主に有益な機能を発揮することが知られており、老齢期の健康維持に役割を果たす可能性があります(Biagi et al.、2016)。百寿者のマイクロバイオームを洞察することで、宿主に有益な保護作用を持つ特定の微生物が解明されるかもしれません。
神経変性疾患におけるマイクロバイオーム
腸内細菌との最初の相互作用が、神経変性疾患のような人生の後半に起こる事象をどのように変化させるかは、まだ不明である。現在までに、神経変性疾患のヒトおよび動物モデルにおいて、腸内細菌の集団が異なることが少数の研究によって証明されている。アルツハイマー病(AD)のAPP/PS1マウスモデルにおける予備的な観察によると、これらの動物は野生型コントロールと比較して、AllobaculumとAkkermansiaが減少し、Rikenellaceaeが増加した(Harach et al.、2015)。同時に、パーキンソン病(PD)に罹患した個体は、糞便および粘膜の微生物集団が著しく異なることを示す(Hasegawa et al.、2015、Keshavarzian et al.、2015、Scheperjans et al.、2015)。Prevotellaceaeはコントロールと比較して減少し、Lactobacilliaceaeは増加しています(Hasegawa et al.、2015年、Scheperjans et al.、2015年)。糞便中の腸内細菌科の相対レベルは、特定のPDの形態を識別するのに十分であり、PDの振戦優勢型を示す患者は、より重度の姿勢および歩行不安定を示す患者よりも腸内細菌科の相対存在量が著しく低かった(Scheperjans et al.、2015)。実際、PD患者の腸生検では、健康な対照群と比較して組織関連大腸菌が増加していることが示されており(Forsyth et al.、2011)、神経変性疾患と診断された個人における腸内細菌群集の変化の存在をさらに示しています。しかし、マイクロバイオームの変化と神経変性との関連性を示すこの研究は、ほとんど説明的なものであり、異なる微生物集団がどのように発生し、その生理学的影響があるとすれば、それは依然として不明である。
神経変性疾患の病態には、神経炎症が重要な役割を果たすと考えられている(Cappellano et al.、2013、Glass et al.、2010)。脳と末梢の両方で産生される炎症性サイトカインは、神経細胞機能を変調させ、病的な細胞死を引き起こす可能性があります(Koprich et al., 2008, McCoy and Tansey, 2008)。神経変性過程の予防と促進の両方においてミクログリアの機能が重要であることを考えると、腸内細菌叢が老化脳のこれらの炎症性疾患に影響を与える可能性があると推測したくなる。上述したように、細菌発酵産物、すなわちSCFAはミクログリアの成熟を促進し、成熟したミクログリアの維持に必要である(Erny et al., 2015)。興味深いことに、コントロールと比較して、PD患者の糞便中のSCFA濃度の低下が最近報告された(Unger et al.、2016年)。腸から脳へのMAMPの通過は、低レベルの炎症を生じさせる可能性がある(Pal et al.、2015年)。このような持続的な炎症性シグナル伝達は、神経変性疾患の重症度と関連している(Cappellano et al., 2013, Glass et al., 2010)。興味深いことに、ADで病原性プラークを形成することが知られているアミロイド蛋白質Aβの生理的役割は、脳内の細菌感染を排除する抗菌剤であることが最近の報告で示唆されています(Kumar et al.、2016年)。微生物叢による神経生理学的変化の長期的な結果を理解するための研究は重要です。
BBBの完全性やミクログリアの成熟における機能不全はグローバルな影響を及ぼす可能性がありますが、最近の研究では、腸内微生物が介在する神経変性疾患の具体例が明らかにされました。眼球の中層の炎症である散発性ぶどう膜炎のマウスモデルにおいて、動物は炎症の増加と神経網膜の細胞の喪失を示し、視力障害に至ります。この炎症は、一般的に免疫優位な組織である網膜に存在する抗原を認識する自己反応性T細胞によって媒介されています。これらのマウスにおける自己反応性T細胞の活性化は、微生物叢に依存しています(Horai et al.、2015)。実際、これらのT細胞は網膜タンパク質に対して反応性があるだけでなく、腸内に存在する微生物抗原を認識する能力もあります(Horai et al., 2015)。しかし現時点では、この自己免疫性神経炎を引き起こす微生物抗原は不明である。それにもかかわらず、この観察は、微生物叢に存在する宿主分子の「分子模倣」が、神経変性を促進する自己免疫応答を誘発することを示唆しています。宿主の構造を模倣する他の微生物分子も、ADやPD時の免疫反応を促進する役割を果たすことが示唆されている(Friedland, 2015, Hill and Lukiw, 2015)。したがって、これらの分子模倣体を産生する特定の腸内微生物が発達初期に存在することは、特定の免疫疾患や神経変性疾患のリスク因子として働く可能性があると考えることができる。しかし、この仮説を直接観察した報告は今のところなく、マイクロバイオームへの年齢依存的な影響と神経病理との関連は、活発な研究領域である。
パースペクティブ
マイクロバイオームは、宿主の幸福に重要な役割を果たしている。これまでの研究の多くが、異なる細菌集団が特定の臨床状態と関連していることを明らかにしてきましたが、これらの違いが病気の原因なのか、病気を促進・増強するのか、それとも無関係な病態生理の結果なのかは、ほとんどの場合、不明です。哺乳類(あるいは他の宿主)と関連する微生物群集との複雑な相互作用を理解するために、今後の研究はこの難題に取り組む必要があります。私たちは、単に細菌集団のカタログを作るだけの研究を続けてはいけません。むしろ、この基礎的な研究アプローチを拡張して、ある微生物集団が果たす機能的・生態的役割を検証し、個々の細菌または細菌のコンソーシアムが動物宿主に及ぼす生理的影響を解読しなければなりません。病態生理の根底にあるのはマイクロバイオームの変化なのか、それともその結果なのか、原因と結果の問題に取り組むことが重要です。行動への影響は直接的なものなのか、それとも他の基本的な生理学的変化の結果なのか?適切な神経発達をサポートし、神経変性を防ぐために必要かつ十分な、定義された微生物の特徴はあるのでしょうか?動物モデルの使用は、健康や病気における基本的なプロセスを研究するための素晴らしいツールです。しかし、結果をヒトの状態に外挿することには注意が必要であり、前臨床の知見をヒトの健康や疾患に情報を提供するためのいくつかのアプローチの1つとして使用するように努めなければなりません。
腸-脳軸に関する研究はまだ始まったばかりですが、ある基本的な法則が明らかになり始めています。特定の神経経路が微生物集団の影響に対応するように進化したように見える一方、マイクロバイオームの「指示」に影響されず、純粋にゲノムやその他の環境的な合図に従う経路もあります。宿主に付随する微生物群集との相互作用は、微生物の代謝物を介した直接的なものから、免疫系、代謝系、内分泌系による間接的なものまで、神経系に環境に関するリアルタイムの情報を提供することができます。これらの情報は、バリア機能、免疫監視、神経新生など、脳の基本的な発達過程を制御するために集約されます。有益または病原性の異なる微生物集団が、健康や疾病に関連するこれらの機能やその他の機能をどのように支配しているかをメカニズム的に理解することは、特定の神経病理の診断、治療、予防につながることが期待されます。西洋化やその他の環境要因によって変化するマイクロバイオームが、神経発達障害の割合が増加し、平均寿命が延びている人間集団にどのような影響を与えるかを明らかにすることは、生物医学研究および社会にとって緊急の課題である。
謝辞
本総説に掲載できなかった同僚にお詫びを申し上げる。Hiutung Chu博士、Wei-li Wu博士、Carly Stewart博士には、本原稿を批判的に読んでいただいたことに感謝する。著者らは、Meixner Postdoctoral Fellowship in Translational Research(G.S.へ)、Larry L. Hillblom Foundation Postdoctoral Fellowship(T.R.S. へ)の支援を受けています。Mazmanian研究室の関連研究は、NIH(MH100556、DK078938、GM099535、NS085910)、国防省、Heritage Medical Research Institute、Simons Foundationからの助成金によって行われています。Geschwind研究室の関連研究は、NIMHの助成金(HD055784、MH100027、MH110927、MH1064382)およびSimons財団の支援を受けています。
参考文献
Aagaardら、2013年
K. Aagaard, J. Petrosino, W. Keitel, M. Watson, J. Katancik, N. Garcia, S. Patel, M. Cutting, T. Madden, H. Hamilton, et al.
ヒトマイクロバイオームプロジェクトのヒトマイクロバイオームの包括的なサンプリングのための戦略とそれが重要な理由
FASEB J., 27 (2013), pp. 1012-1022
CrossRefView in ScopusGoogle Scholar
アーガルド他、2014年
K. アーガード、J.マー、K.M.アントニー、R.ガヌ、J.ペトロシーノ、J.バーサロビッチ
プラセンタはユニークなマイクロバイオームを保有する
Sci. Transl. メド、6 (2014), p. 237ra65
ScopusGoogle Scholarで見る
Ait-Belgnaouiら、2012年。
A. Ait-Belgnaoui、H. Durand、C. Cartier、G. Chaumaz、H. Eutamene、L. Ferrier、E. Houdeau、J. Fioramonti、 L. Bueno、 V. Theodorou
プロバイオティクスによる腸管漏出防止は、ラットの急性心理ストレスに対するHPA反応の抑制につながる
精神神経内分泌学, 37 (2012), pp.1885-1895
PDFを見る記事を見るScopusGoogle Scholarで見る
Ait-Belgnaouiら、2014年。
A. Ait-Belgnaoui、A. Colom、V. Braniste、L. Ramalho、A. Marrot、C. Cartier、E. Houdeau、V. Theodorou、 T. Tompkins
プロバイオティクス腸内環境の効果で、マウスの慢性心理ストレスによる脳活動異常を防ぐ
Neurogastroenterol. Motil.、26(2014)、pp.510-520
CrossRefView in ScopusGoogle Scholar
Alameel et al, 2012
T. アラメール、M.バシェイク、M.K.アンドリュー
高齢者の消化器症状:有病率、施設入所および死亡率との関連性
キャン J. Gastroenterol., 26 (2012), pp.881-884
CrossRefView in ScopusGoogle Scholar
アレニナ、クレンピン、2015年
N. アレニナ、F.クレンピン
成体海馬の神経新生におけるセロトニンの役割
Behav. ブレイン・レジデンス, 277 (2015), 49-57頁
PDFを見る記事を見るScopusGoogle Scholarで見る
アレンら、2015年
J.M.アレン、M.E.バーグミラー、B.D.ペンス、K.ウィットロック、V.ネーラ、H.R.ガスキンス、B.A.ホワイト、J.D.フライヤ、J.A.ウッズ
C57BL/6Jマウスの任意運動と強制運動が腸内細菌叢を差動的に変化させることが判明
J. Appl. Physiol., 118 (2015), pp. 1059-1066
CrossRefView in ScopusGoogle Scholar
Amaral et al., 2008
F.A. Amaral, D. Sachs, V.V. Costa, C.T. Fagundes, D. Cisalpino, T.M. Cunha, S.H. Ferreira, F.Q. Cunha, T.A. Silva, J.R. Nicoli, et al.
炎症性疼痛の発症には常在細菌叢が重要である。
Proc. Natl. Acad. Sci.USA, 105 (2008), pp.2193-2197
CrossRefView in ScopusGoogle Scholar
アレンセンら、2015年
T. Arentsen、H. Raith、Y. Qian、H. Forssberg、R. Diaz Heijtz
宿主微生物がマウスの社会的嗜好性の発達を調節する
Microb. Ecol. Health Dis.、26 (2015), p.29719
ScopusGoogle Scholarで見る
アスペルンド他、2015年
A. アスペルンド、S.アンティラ、S.T.プルー、T.V.カールセン、S.カラマン、M.デトマー、H.ウィッグ、K.アリタロ
脳の間質液や高分子を排出する硬膜リンパ管系
J. Exp. Med., 212 (2015), pp.991-999
CrossRefView in ScopusGoogle Scholar
Bäckhedら、2015年
F. Bäckhed, J. Roswall, Y. Peng, Q. Feng, H. Jia, P. Kovatcheva-Datchary, Y. Li, Y. Xia, H. Xie, H. Zhong, et al.
生後1年におけるヒト腸内細菌叢の動態と安定性
Cell Host Microbe, 17 (2015), pp.690-703
PDFを見る記事を見るScopusGoogle Scholarで見る
バハリニら、2015
I. バフリニ、J.-H. ソン、D.ディーズ、花山亮太
神経細胞エキソソームはミクログリアにおける補体因子のアップレギュレーションによりシナプス刈り込みを促進する
Sci. レップ、5 (2015), p. 7989
ScopusGoogle Scholarで見る
Bailey et al., 2011
M.T.ベイリー、S.E.ダウド、J.D.ギャレー、A.R.ハフナグル、R.G.アレン、M.ライト
社会的ストレッサーへの曝露が腸内細菌叢の構造を変化させる:ストレッサー誘発性免疫調節への示唆
Brain Behav. 免疫, 25 (2011), pp.397-407
PDFを見る記事を見るScopusGoogle Scholarで見る
ベナキス他、2016年
C. Benakis、D. Brea、S. Caballero、G. Faraco、J. Moore、M. Murphy、G. Sita、G. Racchumi、L. Ling、E. G. Pamer, et al.
腸管γδT細胞の制御により虚血性脳卒中の転帰に影響を及ぼす腸内細菌叢の存在
Nat. Med.、22(2016)、pp.516-523
CrossRefView in ScopusGoogle Scholar
ベネット他、2016年
M.L. Bennett, F.C. Bennett, S.A. Liddelow, B. Ajami, J.L. Zamanian, N.B. Fernhoff, S.B. Mulinyawe, C.J. Bohlen, A. Adil, A. Tucker, et al.
マウスとヒトのCNSにおけるミクログリア研究のための新しいツール
Proc. Natl. Acad. Sci. USA, 113 (2016), pp. E1738-E1746
ScopusGoogle Scholarで見る
Bercikら、2011a
P. Bercik, E. Denou, J. Collins, W. Jackson, J. Lu, J. Jury, Y. Deng, P. Blennerhassett, J. Macri, K.D. McCoy, et al.
腸内細菌は脳由来神経刺激因子の中枢レベルとマウスの行動に影響を与える
消化器病学, 141 (2011), pp.599-609
ScopusGoogle Scholarで見る
Bercikら、2011b
P. Bercik, A.J. Park, D. Sinclair, A. Khoshdel, J. Lu, X. Huang, Y. Deng, P.A. Blennerhassett, M. Fahnestock, D. Moine, et al.
ビフィズス菌NCC3001の抗不安作用には、腸と脳のコミュニケーションに関わる迷走神経経路が関与している
Neurogastroenterol. Motil., 23 (2011), pp.1132-1139
CrossRefView in ScopusGoogle Scholar
Biagi et al, 2010
E. ビアジ、L. ニルンド、M. カンデラ、R. オスタン、L. ブッチ、E. ピニ、J. ニッキラ、D. モンティ、里香里、C. フランチェスキ、et al.
加齢を経て、そしてその先へ:高齢者と百寿者における腸内細菌叢と炎症状態
PLoS ONE, 5 (2010), p. e10667
CrossRefView in ScopusGoogle Scholar
Biagi et al, 2012
E. ビアギ、M.カンデラ、S.フェアウェザー・テイト、C.フランチェスキ、P.ブリギディ
ヒトのメタオーガニズムのエイジング:微生物との対応
エイジ(Dordr.),34(2012),pp.247-267
CrossRefView in ScopusGoogle Scholar
ビアジら、2016年
E. ビアジ、C.フランチェスキ、S.ランペリ、M.セヴェルニーニ、R.オスタン、S.トゥローニ、C.コンソランディ、S.クエルチア、M.スクルティ、D.モンティ、他。
腸内細菌叢と極端な長寿の関係
Curr. Biol.、26(2016)、1480-1485ページ
PDFを見る記事を見るScopusGoogle Scholarで見る
ブレーザー、2016年
M.J.ブレーザー
抗生物質の使用とその正常なマイクロバイオームへの影響
サイエンス, 352 (2016), pp.544-545
CrossRefView in ScopusGoogle Scholar
ボナズとバーンスタイン、2013年
B.L.ボナズ、C.N.バーンスタイン
炎症性腸疾患における脳と腸の相互作用
消化器病学, 144 (2013), pp.36-49
PDFを見る記事を見るScopusGoogle Scholarで見る
ボーデンシュタインとテイス、2015年
S.R.ボーデンシュタイン、K.R.テイス
マイクロバイオームに照らし合わせた宿主生物学: ホロビオントとホロゲノムの十大原則
PLoS Biol.、13(2015)、p.e1002226
CrossRefGoogle Scholar
BorodyとKhoruts、2011年
T.J.ボロディ、A.コルッツ
糞便微生物移植と新たな応用例
Nat. Rev. Gastroenterol. Hepatol., 9 (2011), pp.88-96
Google Scholar
Branisteら、2014年
V. Braniste, M. Al-Asmakh, C. Kowal, F. Anuar, A. Abbaspour, M. Tóth, A. Korecka, N. Bakocevic, L.G. Ng, P. Kundu, et al.
腸内細菌叢はマウスの血液脳関門透過性に影響を及ぼす
Sci. Transl. メド、6 (2014), p. 263ra158
ScopusGoogle Scholarで見る
ブラボー他、2011年
J.A.ブラボー、P.フォーサイス、M.V.チュー、E.エスカラバージュ、H.M.サヴィニャック、T.G.ディナン、J.ビエンストック、J.F.クライアン
乳酸菌摂取による迷走神経を介したマウスの情動行動と中枢性GABA受容体発現の制御について
Proc. Natl. Acad. Sci. USA, 108 (2011), pp.16050-16055
CrossRefView in ScopusGoogle Scholar
ブリトン、マクラフリン、2013
E. ブリトン、J.T.マクラフリン
加齢と腸
Proc. 栄養学会, 72 (2013), pp.173-177
ScopusGoogle Scholarで見る
バフィントン他、2016年
S.A.バフィントン、G.V.ディプリスコ、T.A.アウクトゥング、N.J.アジャミ、J.F.ペトロジーノ、M.コスタ=マティオリ
微生物による再構成は、母親の食事によって誘発された子孫の社会性とシナプスの欠損を回復させる
細胞, 165 (2016), pp.1762-1775
PDFを見る記事を見るScopusGoogle Scholarで見る
カッペラーノ他、2013年
G. Cappellano, M. Carecchio, T. Fleetwood, L. Magistrelli, R. Cantello, U. Dianzani, C. Comi
神経変性疾患における免疫と炎症
Am. J. Neurodegener. Dis., 2 (2013), pp.89-107
ScopusGoogle Scholarで見る
カラボッティ他、2015年
M. カラボッティ、A.シロッコ、M.A.マセッリ、C.セヴェーリ
腸-脳軸:腸内細菌叢と中枢神経系および腸管神経系の相互作用
アン. Gastroenterol., 28 (2015), pp.203-209
ScopusGoogle Scholarで見る
カーモディら、2015年
R.N.カーモディ、G.K.ガーバー、J.M.ルエバーノ・ジュニア、D.M.ガッティ、L.ソームス、K.L.スヴェンソン、P.J.ターンボー
マウス腸内細菌叢の形成において、食事が宿主の遺伝子型を支配する
Cell Host Microbe, 17 (2015), pp. 72-84
PDFを見る記事を見るScopusGoogle Scholarで見る
カストロ・ナラール他、2015年
E. カストロ・ナラー、M.L.ベンダル、M.ペレス・ロサダ、S.サバンチャン、E.G.セブランス、F.B.ディカーソン、J.R.シュローダー、R.H.ヨルケン、K.A. クランダル
統合失調症患者および対照者における口腔咽頭微生物群の構成、分類および機能的多様性の検討
PeerJ, 3 (2015), p. e1140
CrossRefView in ScopusGoogle Scholar
Ceniら、2014年
C. Ceni、N.Unsain、M.P.Zeinieh、P.A.Barker
細胞の生存と死を制御するニューロトロフィン
G.R. Lewin, B.D. Carter (Eds.), Neurotrophic Factors, Springer Berlin Heidelberg (2014), pp. 193-221
CrossRefView in ScopusGoogle Scholar
Chang et al., 2009
C.-Y. チャン(Chang)、D.-S. ケ、J.-Y. チェン
必須脂肪酸とヒトの脳
Acta Neurol. 台湾, 18 (2009), pp.231-241
ScopusGoogle Scholarで見る
Choi et al, 2016
G.B. Choi, Y.S. Yim, H. Wong, S. Kim, H. Kim, S.V. Kim, C.A. Hoeffer, D.R. Littman, J.R. Huh
マウスの母体インターロイキン-17a経路は子孫の自閉症様表現型を促進する
サイエンス, 351 (2016), pp.933-939
CrossRefView in ScopusGoogle Scholar
Claessonら、2011年
M.J. Claesson, S. Cusack, O. O'Sullivan, R. Greene-Diniz, H. de Weerd, E. Flannery, J.R. Marchesi, D. Falush, T. Dinan, G. Fitzgerald, et al.
高齢者の腸内細菌叢の組成、変動性、および時間的安定性
Proc. Natl. Acad. Sci. USA, 108 (Suppl 1) (2011), pp.4586-4591
CrossRefView in ScopusGoogle Scholar
Claessonら、2012年
M.J. Claesson, I.B. Jeffery, S. Conde, S.E. Power, E.M. O'Connor, S. Cusack, H.M.B. Harris, M. Coakley, B. Lakshminarayanan, O. O'Sullivan, et al.
腸内細菌叢の組成は高齢者の食事と健康に相関する
Nature, 488 (2012), pp.178-184.
CrossRefView in ScopusGoogle Scholar
Clarkeら、2013年
G・クラーク、S・グレンハム、P・スカリー、P・フィッツジェラルド、R・D・モロニー、F・シャナハン、T・G・ディナン、J・F・クライアン
生後間もない頃の微生物-腸-脳軸が海馬のセロトニン作動系を性差なく制御する
Mol. 精神医学, 18 (2013), pp.666-673
CrossRefView in ScopusGoogle Scholar
デイビッドら、2014年
L.A. David, C.F. Maurice, R.N. Carmody, D.B. Gootenberg, J.E. Button, B.E. Wolfe, A.V. Ling, A.S. Devlin, Y. Varma, M.A. Fischbach, et al.
食事がヒトの腸内細菌叢を迅速かつ再現性よく変化させる
ネイチャー, 505 (2014), pp.559-563
CrossRefView in ScopusGoogle Scholar
DavisonとDobbing、1966年
A.N.デイヴィソン、J.ドッビング
脳発達の脆弱な時期としての髄鞘形成
Br. Med. ブル, 22 (1966), pp.40-44
CrossRefView in ScopusGoogle Scholar
デ・アンジェリス他、2013年
M. デ・アンジェリス、M・ピッコロ、L・ヴァニーニ、S・シラグーザ、A・デ・ジャコモ、D・I・セラザネッティ、F・クリストフォリ、M・E・グエルゾーニ、M・ゴベッティ、R・フランチャヴィラ
自閉症および特定不能の広汎性発達障害児の糞便微生物叢とメタボロームについて
PLoS ONE, 8 (2013), p. e76993
CrossRefView in ScopusGoogle Scholar
デ・ラ・トレ・ユビエタら、2016年
L. de la Torre-Ubieta, H. Won, J.L. Stein, D.H. Geschwind
遺伝学で自閉症疾患メカニズムの解明を進める
Nat. Med.、22(2016)、345-361頁。
CrossRefView in ScopusGoogle Scholar
デ・パルマ他、2015年
G. De Palma, P. Blennerhassett, J. Lu, Y. Deng, A.J. Park, W. Green, E. Denou, M.A. Silva, A. Santacruz, Y. Sanz, et al.
母子分離マウスにおける行動表現型の微生物叢と宿主の決定因子の解明
Nat. Commun.、6 (2015), p. 7735
ScopusGoogle Scholarで見る
de Theije et al, 2014
C.G.M. de Theije, B.M. Bavelaar, S. Lopes da Silva, S.M. Korte, B. Olivier, J. Garssen, A.D. Kraneveld
神経発達障害における食物アレルギーと食品を用いた治療法について
小児科医。アレルギー免疫学, 25 (2014), pp.218-226
CrossRefView in ScopusGoogle Scholar
デグルーテ他、2016年
S. デグルート、D.J.ハンティング、A.A.バッカレッリ、L.タクサー
母体の腸と胎児の脳のつながり: ウィスターラットにおける妊娠前後の抗生物質曝露に伴う不安の増大と社会的相互作用の減退
Prog. Neuropsychopharmacol. Biol. Psychiatry, 71 (2016), pp.76-82
PDFを見る記事を見るScopusGoogle Scholarで見る
Desbonnetら、2010年
L. デボネ、L.ギャレット、G.クラーク、B.キーリー、J.F.クライアン、T.G.ディナン
うつ病の母子分離モデルにおけるプロバイオティクス「Bifidobacterium infantis」の効果
神経科学, 170 (2010), pp.1179-1188.
PDFを見る記事を見るScopusGoogle Scholarで見る
デスボネ他、2014年
L. デボネ、G・クラーク、F・シャナハン、T・G・ディナン、J・F・クライアン
マウスの社会性発達にマイクロバイオータが必須であることが判明
Mol. 精神医学, 19 (2014), pp.146-148
CrossRefView in ScopusGoogle Scholar
デスボネ他、2015年
L. デボネ、G・クラーク、A・トラプリン、O・オサリバン、F・クリスピー、R・D・モロニー、P・D・コッター、T・G・ディナン、J・F・クリアン
マウスの思春期初期からの腸内細菌叢の枯渇: 脳と行動への影響
Brain Behav. 免疫, 48 (2015), pp.165-173
PDFを見る記事を見るScopusGoogle Scholarで見る
Dethlefsenら、2008年
L. Dethlefsen、S.Huse、M.L.Sogin、D.A.Relman
深層16S rRNAシーケンシングで明らかになった、抗生物質がヒト腸内細菌叢に及ぼす広範な影響
PLoS Biol., 6 (2008), p. e280
CrossRefView in ScopusGoogle Scholar
Diaz Heijtz他、2011年
R. Diaz Heijtz, S. Wang, F. Anuar, Y. Qian, B. Björkholm, A. Samuelsson, M.L. Hibberd, H. Forssberg, S. Pettersson
正常な腸内細菌叢は脳の発達と行動を調節する
Proc. Natl. Acad. Sci. USA, 108 (2011), pp.3047-3052
Google Scholar
ディギューリオ、2012年
D.B. DiGiulio
羊水中の微生物の多様性
Semin. 胎児新生児医学, 17 (2012), pp.2-11
PDFを見る記事を見るScopusGoogle Scholarで見る
ディギューリオ他、2015年
D.B. DiGiulio, B.J. Callahan, P.J. McMurdie, E.K. Costello, D.J. Lyell, A. Robaczewska, C.L. Sun, D.S.A. Goltsman, R.J. Wong, G. Shaw, et al.
妊娠中のヒト微生物叢の時間的・空間的変動
Proc. Natl. Acad. Sci. USA, 112 (2015), pp. 11060-11065
CrossRefView in ScopusGoogle Scholar
Dominguez-Belloら, 2010
M.G.ドミンゲスベロ、E.K.コステロ、M.コントレラス、M.マグリス、G.ヒダルゴ、N.フィーラー、R.ナイト
出産形態は、新生児の複数の体内環境における初期微生物叢の獲得と構造を形成する
Proc. Natl. Acad. Sci. USA, 107 (2010), pp.11971-11975
CrossRefView in ScopusGoogle Scholar
ドミンゲス=ベロら、2016年
M.G. Dominguez-Bello、K.M. De Jesus-Laboy、N. Shen、L.M. Cox、 A. Amir、 A. Gonzalez、 N.A. Bokulich、 S.J. Song、 M. Hoashi、 J.I. Rivera-Vinas, et al.
膣内微生物移植による帝王切開児の微生物叢の部分的な回復
Nat. Med., 22 (2016), pp. 250-253
CrossRefView in ScopusGoogle Scholar
Dotterudら、2015年
C.K. Dotterud, E. Avershina, M. Sekelja, M.R. Simpson, K. Rudi, O. Storrø, R. Johnsen, T. Oien
母体周産期プロバイオティクス補給は母子の腸内細菌叢を変化させるか?
J. Pediatr. Gastroenterol. Nutr., 61 (2015), pp.200-207
ScopusGoogle Scholarで見る
エロエ・ファドロシュ他、2015年
E.A. Eloe-Fadrosh、A. Brady、J. Crabtree、E.F. Drabek、B. Ma、A. Mahurkar、J. Ravel、M. Haverkamp、 A.-M. Fiorino, C. Botelho, et al.
高齢者におけるプロバイオティクス摂取時の腸内細菌叢の機能的ダイナミクス
MBio, 6 (2015)
e00231-15
Google Scholar
エルニーら、2015
D. Erny, A.L. Hrabě de Angelis, D. Jaitin, P. Wieghofer, O. Staszewski, E. David, H. Keren-Shaul, T. Mahlakoiv, K. Jakobshagen, T. Buch, et al.
宿主微生物が中枢神経系におけるミクログリアの成熟と機能を絶えず制御する
Nat. ニューロサイエンス, 18 (2015), pp.965-977
CrossRefView in ScopusGoogle Scholar
エスティス、マカリスター、2016年
M.L. Estes、A.K. McAllister
母体の免疫活性化: 神経精神疾患への影響
サイエンス, 353 (2016), pp.772-777
CrossRefView in ScopusGoogle Scholar
Finegoldら、2002年
S.M. Finegold, D. Molitoris, Y. Song, C. Liu, M.-L. Vaisanen, E. Bolte, M. McTeague, R. Sandler, H. Wexler, E.M. Marlowe, et al.
遅発性自閉症における消化管微生物叢の研究
Clin. Infect. Dis., 35 (Suppl 1) (2002), pp.S6-S16
ScopusGoogle Scholarで見る
Finegoldら、2010年
S.M. Finegold, S.E. Dowd, V. Gontcharova, C. Liu, K.E. Henley, R.D. Wolcott, E. Youn, P.H. Summanen, D. Granpeesheh, D. Dixon, et al.
自閉症児と対照児の糞便微生物叢のパイロシークエンス研究
嫌気性菌, 16 (2010), pp.444-453
PDFを見る記事を見るScopusGoogle Scholarで見る
フォーリー他、2014年
K.A.フォーリー、K.-P. オッセンコップ、M.カヴァリエ、D.F.マクファーベ
リポ多糖または腸内代謝産物であるプロピオン酸の生前および新生児期の曝露は、思春期ラットの発達および行動を性差なく変化させる
PLoS ONE, 9 (2014), p. e87072
CrossRefView in ScopusGoogle Scholar
フォンドら、2014年
G.フォンド、A.ラウンドゥ、N.ハムダニ、W.ブークアチ、A.ダーゲル、J.オリベイラ、M.ロジェ、R.タムーザ、M.ルボワイヤ、L.ボワイヤー
過敏性腸症候群(IBS)における不安とうつの併存症:システマティックレビューとメタアナリシス
Eur. Arch. Psychiatry Clin. Neurosci., 264 (2014), pp.651-660
CrossRefView in ScopusGoogle Scholar
Forsythら、2011年
C.B.フォーサイス、K.M.シャノン、J.H.コルドワー、R.M.ボイト、M.シャイフ、J.A.ジャグリン、J.D. エステス、H.B.ドディア、アー・ケシャバージアン
パーキンソン病初期における腸管透過性の増大とS状結節粘膜のαシヌクレイン染色およびエンドトキシン暴露マーカーとの関連性
PLoS ONE, 6 (2011), p. e28032
CrossRefView in ScopusGoogle Scholar
フォスター、マクヴェイ・ノイフェルド、2013年
J.A.フォスター、K.-A. マクヴェイ・ノイフェルド
腸-脳軸:マイクロバイオームが不安やうつに与える影響について
トレンド・ニューロサイエンス, 36 (2013), pp.305-312
PDFを見る記事を見るScopusGoogle Scholarで見る
フリードランド、2015年
R.P. Friedland
神経変性における微生物叢が関与する分子模倣のメカニズム
J. Alzheimers Dis., 45 (2015), pp.349-362
CrossRefView in ScopusGoogle Scholar
ガシアス他、2016年
M. Gacias, S. Gaspari, P.-M.G. Santos, S. Tamburini, M. Andrade, F. Zhang, N. Shen, V. Tolstikov, M.A. Kiebish, J.L. Dupree, et al.
前頭前野における微生物群主導の転写変化が社会的行動における遺伝的差異を上書きする
eLife, 5 (2016), p. e13442
ScopusGoogle Scholarで見る
Gardenerら、2011年
H. ガーデナー、D.スピーゲルマン、S.L.ブカ
自閉症の周産期および新生児期の危険因子:包括的メタアナリシス
小児科』128 (2011), pp.344-355
CrossRefView in ScopusGoogle Scholar
Gareauら、2011年
M.G.ガロー、E.ワイン、D.M.ロドリゲス、J.H.チョ、M.T.ワリー、D.J.フィルポット、G.マックイーン、P.M.シャーマン
細菌感染により、マウスにストレス誘発性の記憶機能障害を引き起こす
Gut, 60 (2011), pp.307-317
CrossRefView in ScopusGoogle Scholar
GeschwindとRakic、2013年
D.H. Geschwind、P. Rakic
皮質の進化:脳をその表紙で判断する
ニューロン, 80 (2013), pp.633-647
PDFを見る記事を見るScopusGoogle Scholarで見る
Ginhouxら, 2010
F. Ginhoux, M. Greter, M. Leboeuf, S. Nandi, P. See, S. Gokhan, M.F. Mehler, S.J. Conway, L.G. Ng, E.R. Stanley, et al.
フェイトマッピング解析により、成体ミクログリアは原始マクロファージに由来することが明らかになった
サイエンス, 330 (2010), pp.841-845.
CrossRefGoogle Scholar
Glassら、2010年
C.K.グラス、K.サイジョー、B.ウィナー、M.C.マルケト、F.H.ゲイジ
神経変性における炎症のメカニズムの解明
細胞, 140 (2010), pp.918-934
PDFを見る記事を見るScopusGoogle Scholarで見る
ゴメス・デ・アグエロ他、2016年
M. Gomez de Agüero, S.C. Ganal-Vonarburg, T. Fuhrer, S. Rupp, Y. Uchimura, H. Li, A. Steinert, M. Heikenwalder, S. Hapfelmeier, U. Sauer, et al.
母体微生物叢は生後早期の自然免疫の発達を促す
サイエンス, 351 (2016), pp.1296-1302
CrossRefGoogle Scholar
グッドリッチら、2016年
J.K.グッドリッチ、E.R.ダベンポート、J.L.ウォーターズ、A.G.クラーク、R.E.レイリー
宿主の遺伝子とマイクロバイオームとの関連性の種間比較
サイエンス, 352 (2016), pp.532-535
CrossRefView in ScopusGoogle Scholar
ハラチら、2015
Harach, T., Marungruang, N., Dutilleul, N., Cheatham, V., Mc Coy, K.D., Neher, J.J., Jucker, M., Fåk, F., Lasser, T., and Bolmont, T. (2015). 腸内細菌叢がない場合のアルツハイマー病βアミロイド病態の軽減 arXiv, arXiv:1509.02273, https://arxiv.org/abs/1509.02273.
グーグル・スカラー
長谷川ら、2015
S. 長谷川聡、後藤聡、辻秀樹、奥野哲也、浅原拓也、野本和彦、柴田明彦、藤澤由美子、湊智也、岡本明彦、他.
パーキンソン病における腸内細菌異常と血清リポ多糖結合蛋白の低下
PLoS ONE, 10 (2015), p. e0142164
CrossRefView in ScopusGoogle Scholar
ヒル、ルキウ、2015
J.M.ヒル、W.J.ルキウ
微生物が作るアミロイドとアルツハイマー病(AD)の関係
Front. Aging Neurosci., 7 (2015), p. 9
グーグル スカラー
ホバン他、2016年
A.E.ホバン、R.M.スティリング、F.J.ライアン、F.シャナハン、T.G.ディナン、M.J.クレソン、G.クラーク、J.F.クリアン
微生物叢による前頭前野の髄鞘形成の制御機構
Transl. 精神医学, 6 (2016), p. e774
CrossRefView in ScopusGoogle Scholar
ホン・スティーブンス、2016年
S. ホン、B.スティーブンス
ミクログリア 貪食によるクリアー、スカルプト、そして排除
Dev. セル, 38 (2016), pp.126-128
PDFを見る記事を見るScopusGoogle Scholarで見る
蓬莱ら、2015年
R. 蓬莱、C.R. Zárate-Bladés、P. Dillenburg-Pilla、J. Chen、J. L. Kielczewski、P. B. Silver、Y. Jittayasothorn、 C.-C. Chan、H.Yamane、K.Honda、R.R.Caspi
微生物群に依存した自己反応性T細胞レセプターの活性化が免疫学的に特権的な部位に自己免疫を引き起こす
免疫、43(2015)、343-353頁
PDFを見る記事を見るScopusGoogle Scholarで見る
アワーガン、オリバヘムカー、2016年
S.K. Hourigan、M. Oliva-Hemker
小児における糞便微生物移植:簡単なレビュー
小児科医. Res., 80 (2016), pp.2-6.
CrossRefView in ScopusGoogle Scholar
Hsiao et al, 2013
E.Y. Hsiao, S.W. McBride, S. Hsien, G. Sharon, E.R. Hyde, T. McCue, J.A. Codelli, J. Chow, S.E. Reisman, J.F. Petrosino, et al.
神経発達障害に関連する行動・生理的異常は微生物叢が調節する
細胞, 155 (2013), pp.1451-1463
PDFを見る記事を見るScopusGoogle Scholarで見る
フマンら、2016年
J. Humann, B. Mann, G. Gao, P. Moresco, J. Ramahi, L.N. Loh, A. Farr, Y. Hu, K. Durick-Eder, S.A. Fillon, et al.
細菌性ペプチドグリカンが胎盤を通過し、胎児の神経増殖と出生後の異常行動を誘発すること
Cell Host Microbe, 19 (2016), p. 901
PDFを見る記事を見るGoogle Scholar
Ichim et al, 2012
G. Ichim、S. Tauszig-Delamasure、P. Mehlen
ニューロトロフィンと細胞死
Exp. 細胞研究, 318 (2012), pp.1221-1228
PDFを見る記事を見るScopusGoogle Scholarで見る
イワノフ他、2009年
I.I. Ivanov, K. Atarashi, N. Manel, E.L. Brodie, T. Shima, U. Karaoz, D. Wei, K.C. Goldfarb, C.A. Santee, S.V. Lynch, et al.
分節化した糸状菌による腸管Th17細胞の誘導
細胞, 139 (2009), pp.485-498
PDFを見る記事を見るScopusGoogle Scholarで見る
Jašarevićら、2015a
E. ジャシャレビッチ、A.B.ロジャース、T.L.ベール
母体ストレスと微生物伝播の、初期生命プログラミングと神経発達における新規な役割
Neurobiol. ストレス, 1 (2015), pp.81-88
PDFを見る記事を見るScopusGoogle Scholarで見る
ジャシャレビッチ他、2015b
E. ジャシャレビッチ、C.L.ハワートン、C.D.ハワード、T.L.ベール
母体ストレスによる膣内細菌叢の変化は、子孫の腸と脳の代謝リプログラミングと関連する
内分泌学, 156 (2015), pp.3265-3276
CrossRefView in ScopusGoogle Scholar
Kangら、2013年
D.-W. カン、J.G.パーク、Z.E.イルハン、G.ウォールストロム、J.ラベール、J.B.アダムス、R.クラジュマルニク=ブラウン
自閉症児の腸内細菌叢におけるPrevotellaおよびその他の発酵菌の発生率の低下
PLoS ONE, 8 (2013), p. e68322
CrossRefView in ScopusGoogle Scholar
Kangら、2014年
S.S. Kang, P.R. Jeraldo, A. Kurti, M.E.B. Miller, M.D. Cook, K. Whitlock, N. Goldenfeld, J.A. Woods, B.A. White, N. Chia, J.D. Fryer
食事と運動は腸内細菌叢を直交的に変化させ、不安や認知との独立した関連性を明らかにする
Mol. Neurodegener.、9(2014)、p.36
Google Scholar
ケリー他、2016年
J.R. Kelly, Y. Borre, C. O' Brien, E. Patterson, S. El Aidy, J. Deane, P.J. Kennedy, S. Beers, K. Scott, G. Moloney, et al.
憂鬱を移し変える: うつ病に関連する腸内細菌叢がラットの神経行動学的変化を引き起こす
J. Psychiatr. Res., 82 (2016), pp. 109-118
PDFを見る記事を見るGoogle Scholar
Keshavarzianら、2015年
A. Keshavarzian、S.J. Green、P.A. Engen、R.M. Voigt、A. Naqib、C.B. Forsyth、 E. Mutlu、 K.M. Shannon
パーキンソン病における大腸菌の組成について
Mov. Disord., 30 (2015), pp.1351-1360
CrossRefView in ScopusGoogle Scholar
Khandaker et al, 2013
G.M.カンダカー、J.ジンブロン、G.ルイス、P.B.ジョーンズ
出生前の母体感染と神経発達、成人期の統合失調症:集団ベースの研究のシステマティックレビュー
Psychol. 医学, 43 (2013), pp.239-257
ScopusGoogle Scholarで見る
Khosraviら、2014年
A. Khosravi、A. Yáñez、J.G. Price、A. Chow、M. Merad、H. S. Goodridge、S. K. Mazmanian
腸内細菌が造血を促進し、細菌感染を制御する
Cell Host Microbe, 15 (2014), pp.374-381
PDFを見る記事を見るScopusGoogle Scholarで見る
クヌーセル他、2014年
I. クヌーセル、L.チチャ、M.ブリッチギ、S.A.ショーベル、M.ボドマー、J.A.ヘリングス、S.トゥービー、E.P.プリンセン
中枢神経疾患全般にわたる母体免疫活性化と脳発達異常の関係
Nat. Rev. Neurol., 10 (2014), pp. 643-660
CrossRefView in ScopusGoogle Scholar
Koenigら、2011年
J.E.ケーニッヒ、A.スポール、N.スカルフォン、A.D.フリッカー、J.ストンボー、R.ナイト、L.T.アンジェネント、R.E.レー
発達中の乳児の腸内細菌叢における微生物コンソーシアムの連続性
Proc. Natl. Acad. Sci.USA, 108 (Suppl 1) (2011), pp.4578-4585
CrossRefView in ScopusGoogle Scholar
Koprich et al., 2008
J.B.コプリッチ、C.レスケ・ニールセン、P.ミタール、O.アイザックソン
パーキンソン病モデル動物において、IL-1βを介した神経炎症がドーパミンニューロンの変性感受性を高める
J. Neuroinflammation, 5 (2008), p. 8
ScopusGoogleスカラーで見る
Korenら、2012年
O. Koren、J.K. Goodrich、T.C. Cullender、A. Spor、K. Laitinen、H. K. Bäckhed、A. Gonzalez、J. J. Werner、 L.T. Angenent、 R. Knight, et al.
妊娠中の腸内細菌叢の宿主リモデリングと代謝の変化
細胞, 150 (2012), pp.470-480
PDFを見る記事を見るScopusGoogle Scholarで見る
クラジュマルニク・ブラウン他、2015年
R. クラジュマルニク=ブラウン、C.ロズポーン、D.-W. Kang、J.B.Adams
自閉症スペクトラム障害児の腸内細菌:複雑なコミュニティが複雑な疾患にどのように影響するかを研究することの難しさと将来性
Microb. Ecol. Health Dis., 26 (2015), p. 26914
ScopusGoogle Scholarで見る
Krakowiak他、2012年
P. クラコヴィアック、C.K.ウォーカー、A.A.ブレーマー、A.S.ベイカー、S.オゾノフ、R.L.ハンセン、I.ヘルツ=ピッチオット
母親の代謝状態と自閉症をはじめとする神経発達障害のリスク
小児科、129 (2012), pp.e1121-e1128
CrossRefView in ScopusGoogle Scholar
KriegsteinとAlvarez-Buylla、2009年
A. クリーグスタイン、A.アルバレス=ブイリャ
胚性・成体性神経幹細胞のグリア性
Annu. レヴュー・ニューロサイエンス, 32 (2009), pp.149-184
CrossRefView in ScopusGoogle Scholar
クマールら、2016
D.K.V. Kumar, S.H. Choi, K.J. Washicosky, W.A. Eimer, S. Tucker, J. Ghofrani, A. Lefkowitz, G. McColl, L.E.Goldstein, R.E. Tanzi, R.D. Moir
アミロイドβペプチドはアルツハイマー病モデルマウスおよびワームにおいて微生物感染から身を守る
Sci. Transl. Med.、8(2016)、p.340ra72
ScopusGoogle Scholarで見る
クパーマン、コレン、2016年
A.A.クパーマン、O.コレン
妊娠中の抗生物質使用:どの程度悪いのか?
BMC Med.、14(2016)、91頁
ScopusGoogle Scholarで見る
ランギール他、2014年
M.G.ランギル、C.J.ミーハン、J.E.ケーニッヒ、A.S.ダナニ、R.A.ローズ、S.E.ハウレット、R.G.ビーコ
老化したマウスの腸内の微生物シフト
マイクロバイオーム, 2 (2014), p. 50
ScopusGoogle Scholarで見る
ラウダら、2016年
A.P.ラウダ、A.M.ロッシュ、S.シェリル=ミックス、A.ベイリー、A.L.ラフリン、K.ビッティンガー、R.レイテ、M.A.エロビッツ、S.パリー、F.D.ブッシュマン
プラセンタサンプルとコンタミネーションコントロールの比較では、明確なプラセンタマイクロバイオータのエビデンスは得られない
マイクロバイオーム』4(2016)、29頁
ScopusGoogle Scholarで見る
リューら、2015年
J. 劉、孫、王、余、陵、李、張、金、陳、潘、他。
クロストリジウム・ブチリカムの代謝性酪酸を介したマウスの血管性認知症に対する神経保護効果について
BioMed Res. Int., 2015 (2015),p.412946に掲載されました。
ScopusGoogle Scholarで見る
ロイド・プライス他、2016年
J. ロイド=プライス、G・アブ=アリ、C・ハッテンハワー
健康なヒトのマイクロバイオーム
ゲノム・メッド」、8(2016)、51頁
ScopusGoogle Scholarで見る
ルーヴォー他、2015年
A. ルーボー、I.スミルノフ、T.J.キーズ、J.D.エクルス、S.J.ルハニ、J.D.ペスケ、N.C.デレッキ、D.キャッスル、J.W. マンデル、K.S. リー、他。
中枢神経系リンパ管の構造的・機能的特徴
ネイチャー, 523 (2015), pp.337-341
CrossRefView in ScopusGoogle Scholar
Lozuponeら、2012年
C.A.ロズポーン、J.I.ストンボー、J.I.ゴードン、J.K.ヤンソン、R.ナイト
ヒト腸内細菌叢の多様性、安定性、回復力
ネイチャー, 489 (2012), pp.220-230
CrossRefView in ScopusGoogle Scholar
ルチンスキーら、2016a
P. ルシンスキー、S.O.ウィーラン、C.オサリバン、G.クラーク、F.シャナハン、T.G.ディナン、J.F.クライント
成体マイクロバイオータ欠損マウスは樹状突起の形態変化が異なる:扁桃体と海馬での影響の違い
Eur. J. Neurosci. (2016), 10.1111/ejn.13291
2016年6月3日オンライン公開
Google Scholar
ルチンスキー他、2016b
P. ルシンスキー、K.-A. マクヴェイ・ノイフェルド、C.S.オリアック、G.クラーク、T.G.ディナン、J.F.クライアン
バブルの中で育つ: 無菌動物を用いて腸内細菌叢が脳と行動に及ぼす影響を評価する
イント. J. Neuropsychopharmacol., 19 (2016), p. pyw020
CrossRefView in ScopusGoogle Scholar
マッキンタイア他、2015年
D.A. MacIntyre, M. Chandiramani, Y.S. Lee, L. Kindinger, A. Smith, N. Angelopoulos, B. Lehne, S. Arulkumaran, R. Brown, T.G. Teoh, et al.
ヨーロッパ人集団における妊娠中および産褥期の膣内マイクロバイオームについて
Sci. レップ、5 (2015), p. 8988
ScopusGoogle Scholarで見る
マングル他、2016年
Mangul, S., Olde Loohuis, L.M., Ori, A., Jospin, G., Koslicki, D., Yang, H.T., Wu, T., Boks, M.P., Lomen-Hoerth, C., Wiedau-Pazos, M. 他 (2016). Total RNA Sequencingは、ヒト血液中の微生物コミュニティと疾患特異的な効果を明らかにする。bioRxiv, http://dx.doi.org/10.1101/057570.
グーグル・スカラー
Mannionら、2013年
A. マンニョン、G.リーダー、O.ヒーリー
自閉症スペクトラムの児童・青少年における併存する精神障害、睡眠障害、胃腸症状、てんかんの調査について
Res. Autism Spectr. Disord., 7 (2013), pp.35-42
PDFを見る記事を見るScopusGoogle Scholarで見る
マリアット他、2009年
D. マリアット、O.フィルメッセ、F.レベネス、V.ギマラス、H.ソコル、J.ドレ、G.コルティエ、J.-P. Furet
ヒトの微生物叢のファーミキューテス/バクテロイデーテス比は、年齢とともに変化する
BMC Microbiol., 9 (2009), p. 123
CrossRefView in ScopusGoogle Scholar
Marín and Rubenstein, 2003
O. マリーン、J.L.R.ルーベンスタイン
前脳における細胞移動
Annu. レヴュー・ニューロサイエンス, 26 (2003), pp.441-483
CrossRefView in ScopusGoogle Scholar
Matcovitch-Natanら、2016年。
O. Matcovitch-Natan, D.R. Winter, A. Giladi, S. Vargas Aguilar, A. Spinrad, S. Sarrazin, H. Ben-Yehuda, E. David, F. Zelada González, P. Perrin, et al.
マイクログリアの発生は、脳の恒常性を制御する段階的なプログラムに従う
サイエンス, 353 (2016), p. aad8670
ScopusGoogle Scholarで見る
マッコイとタンジー、2008年
M.K.マッコイ、M.G.タンゼイ
中枢神経系におけるTNFシグナル阻害:正常な脳機能と神経変性疾患への影響
J. Neuroinflammation, 5 (2008), p. 45
CrossRefView in ScopusGoogle Scholar
マッケハノン他、2014年
B.O.マッケルハノン、C.マクラケン、S.カーペン、W.G.シャープ
自閉症スペクトラム障害における消化器症状:メタアナリシス
小児科、133(2014)、872-883頁
CrossRefView in ScopusGoogle Scholar
Melloら、2013年
B.S. Mello, A.S. Monte, R.S. McIntyre, J.K. Soczynska, C.S. Custódio, R.C. Cordeiro, J.H. Chaves, S.M. Vasconcelos, H.V. Nobre Jr., F.C. Florenço de Sousa, and al.
リポポリサッカライド(LPS)投与後のマウスの抑うつ様行動に対するドキシサイクリンの影響
J. Psychiatr. Res., 47 (2013), pp.1521-1529
グーグルシュラー
Mennら、2006年
B. メン、J.M.ガルシア=ベルドゥゴ、C.ヤシャイン、O.ゴンサレス=ペレス、D.ロウィッチ、A.アルバレス=ブイラ
成人脳の脳室下帯におけるオリゴデンドロサイトの起源
J. Neurosci., 26 (2006), pp.7907-7918
ScopusGoogle Scholarで見る
宮岡ら、2012
T. 宮岡、和気、古屋、遼生、家田、川上、土江、滝、石原、荒木、堀口純一
単極性精神病性うつ病患者に対する補助療法としてのミノサイクリン:非盲検試験
Prog. Neuropsychopharmacol. Biol. Psychiatry, 37 (2012), pp.222-226
PDFを見る記事を見るScopusGoogle Scholarで見る
メーレ他、2016年
L. メーレ、D.マッテイ、M.M.ハイメサート、S.ベレスウィル、A.フィッシャー、M.アルティス、T.フレンチ、D.ハンバルツムヤン、P.マツィンガー、 I.R. デュネイ、S.A.ウォルフ
Ly6C(hi)単球が抗生物質による腸内細菌叢の変化と成体海馬の神経新生との間にリンクを提供する
セル・レップ、15(2016)、1945-1956頁
PDFを見る記事を見るScopusGoogle Scholarで見る
Molina-Hernándezら、2008年。
M. Molina-Hernández、N.P. Tellez-Alcántara、J. Pérez-García、 J.I. Olivera-Lopez、 M.T. Jaramillo-Jaimes
ミノサイクリンと数種のグルタミン酸拮抗薬との併用による抗うつ様作用について
Prog. Neuropsychopharmacol. Biol. Psychiatry, 32 (2008), pp.380-386
PDFを見る記事を見るScopusGoogle Scholarで見る
MøllgårdとSaunders、1986年
K. モルゴー、N.R.ソーンダース
ヒトの血液脳関門と血液CSF関門の開発について
Neuropathol. 応用神経生物学、12 (1986), pp.337-358
CrossRefView in ScopusGoogle Scholar
Moussaouiら、2014年
N. Moussaoui、V. Braniste、A. Ait-Belgnaoui、M. Gabanou、S. Sekkal、M. Olier、V. Théodorou、P. G.P. Martin、 E. Houdeau
生後間もない頃の腸管グルココルチコイド感受性の変化が、母体欠乏ラットにおける上皮バリア欠損のリスクを形成する
PLoS ONE, 9 (2014), p. e88382
CrossRefView in ScopusGoogle Scholar
モヤとフェレール、2016年
A. モヤ、M.フェレール
機能的冗長性が引き起こす腸内細菌叢の乱れに対する安定性
Trends Microbiol.、24(2016)、402-413頁
PDFを見る記事を見るScopusGoogle Scholarで見る
Mussellら、2008年
M. Mussell、K. Kroenke、R.L. Spitzer、J.B.W. Williams、W. Herzog、B. Löwe
プライマリケアにおける胃腸症状:有病率およびうつ病・不安症との関連性
J. Psychosom. 研究, 64 (2008), pp.605-612
PDFを見る記事を見るScopusGoogle Scholarで見る
ナヤックら、2014
D. ナヤック、T.L.ロート、D.B.マクガバン
ミクログリアの発生と機能
Annu. レヴュー・イミュノール, 32 (2014), pp.367-402
CrossRefGoogle Scholar
Neufeldら、2011年
K.M. Neufeld、N. Kang、J. Bienenstock、J.A. Foster
無菌マウスにおける不安様行動の低減と中枢神経化学的変化
Neurogastroenterol. Motil., 23 (2011), pp.255-264
CrossRefView in ScopusGoogle Scholar
ヌリエル・オハヨン他、2016年
M. ヌリエル・オハヨン、H.ノイマン、O.コレン
妊娠・出産・乳幼児期の微生物変化について
Front. Microbiol.、7 (2016), p. 1031
ScopusGoogle Scholarで見る
O'Mahonyら、2002年
D. オマホニー、P.オリアリー、E.M.M.クイグリー
加齢と腸管運動:高齢者の腸管運動への影響要因の検討
薬物老化, 19 (2002), pp.515-527.
CrossRefView in ScopusGoogle Scholar
オマホニー他、2014年
S.M. O'Mahony、V.D. Felice、K. Nally、H.M. Savignac、M.J. Claesson、P. Scully、 J. Woznicki、 N.P. Hyland、 F. Shanahan、 E.M. Quigley, et al.
幼少期の腸内細菌叢の乱れは、雄ラットの認知行動や不安関連行動に影響を与えることなく、成人期の内臓痛に選択的に影響を与える
ニューロサイエンス, 277 (2014), pp.885-901
PDFを見る記事を見るScopusGoogle Scholarで見る
オマホニー他、2015年
S.M.オマホニー、G.クラーク、Y.E.ボレ、T.G.ディナン、J.F.クライアン
セロトニン、トリプトファン代謝と脳・腸・マイクロバイオーム軸
Behav. ブレイン・レジデンス, 277 (2015), pp.32-48
PDFを見る記事を見るScopusGoogle Scholarで見る
オトゥール、クレッソン、2010年
P.W.オトゥール、M.J.クラエッソン
腸内細菌叢: 乳幼児期から高齢者までの生涯を通じた変化
Int. Dairy J., 20 (2010), pp.281-291
PDFを見る記事を見るScopusGoogle Scholarで見る
オグボナヤ他、2015年
E.S.オグボナヤ、G.クラーク、F.シャナハン、T.G.ディナン、J.F.クライアン、O.F.オリアリー
成体海馬の神経新生がマイクロバイオームによって制御されること
Biol. 精神医学, 78 (2015), pp.e7-e9
PDFを見る記事を見るScopusGoogle Scholarで見る
オーら、2016年
J. Oh, A.L. Byrd, M. Park, H.H. Kong, J.A. Segre, NISC Comparative Sequencing Program(比較シーケンスプログラム
ヒト皮膚マイクロバイオームの時間的安定性
Cell, 165 (2016), pp. 854-866
PDFを見る記事を見るScopusGoogle Scholarで見る
オッペンハイム、1989年
R.W.オッペンハイム
神経栄養説と自然発生的な運動神経死
トレンド・ニューロサイエンス, 12 (1989), pp.252-255
PDFを見る記事を見るScopusGoogle Scholarで見る
パルら、2015
G.D. Pal, M. Shaikh, C.B. Forsyth, B. Ouyang, A. Keshavarzian, K.M. Shannon
パーキンソン病における消化管炎症のマーカーとしてのリポポリサッカライド結合蛋白の異常について
Front. ニューロサイエンス, 9 (2015), p.306
ScopusGoogle Scholarで見る
パオリチェッリ他、2011年
R.C. Paolicelli, G. Bolasco, F. Pagani, L. Maggi, M. Scianni, P. Panzanelli, M. Giustetto, T.A. Ferreira, E. Guiducci, L. Dumas, et al.
ミクログリアによるシナプス刈り込みは正常な脳の発達に必要である
サイエンス, 333 (2011), pp.1456-1458
CrossRefView in ScopusGoogle Scholar
パリクシャク他、2015年
N.N. Parikshak, M.J. Gandal, D.H. Geschwind
神経発達・神経変性疾患におけるシステム生物学と遺伝子ネットワーク
Nat. Rev. Genet., 16 (2015), pp. 441-458
CrossRefView in ScopusGoogle Scholar
朴とプー、2013年
H. パーク、M.-M. プー
神経回路の発達と機能におけるニュートロフィンの制御
Nat. Rev. Neurosci., 14 (2013), pp. 7-23
CrossRefGoogle Scholar
Parkら、2013年
A.J.パーク、J.コリンズ、P.A.ブレナーハセット、J.E.ギア、E.F.ベルドゥ、P.ベルシック、S.M.コリンズ
慢性うつ病モデルマウスにおける大腸機能と微生物叢プロファイルの変化
Neurogastroenterol. Motil.、25 (2013)
733-e575
グーグルシュラー
パラーチョ他、2005年
H.M.R.T.パラチョ、M.O.ビンガム、G.R.ギブソン、A.L.マッカートニー
自閉スペクトラム症児の腸内細菌叢と健常児の腸内細菌叢の違いについて
J. Med. Microbiol., 54 (2005), pp.987-991
CrossRefView in ScopusGoogle Scholar
Phillips and Powley, 2007
R.J.フィリップス、T.L.パウリー
消化管の神経支配:老化のパターン
Auton. ニューロサイエンス, 136 (2007), pp.1-19
PDFを見る記事を見るGoogle Scholar
プレスラー、オーヴィン、2013年
R. プレスラー、S.オーヴァン
脳の成熟度を種間で比較: 新生児へのブメタニドの使用可能性を示唆するトランスレーショナルリサーチの一例
Front. Neurol., 4 (2013), p. 36
グーグルシュラー
ラキック, 1988
P. ラキッチ
大脳皮質領域の特定
サイエンス, 241 (1988), 170-176頁
ScopusGoogle Scholarで見る
ランペリ他、2015年
S. ランペリ、S.L.シュナー、C.コンソランディ、S.トゥローニ、M.セヴェルニーニ、C.ピーノ、P.ブリギディ、A.N.クリッテンデン、A.G.ヘンリー、M.カンデラ
ハザ族狩猟採集民の腸内細菌叢のメタゲノムシークエンシング
Curr. Biol.、25(2015)、1682-1693ページ
PDFを見る記事を見るScopusGoogle Scholarで見る
ロメロら、2014a
R. ロメロ、S.S.ハッサン、P.ガジェ、A.L.タルカ、D.W.ファドロシュ、L.ニキータ、M.ガルッピ、R.F. ラモント、P.チャエムサイソン、J.ミランダ、他。
正常な妊婦の膣内細菌叢の組成と安定性は、非妊婦のそれとは異なる
マイクロバイオーム, 2 (2014), p. 4
ScopusGoogle Scholarで見る
ロメロら、2014b
R. ロメロ、S.S.ハッサン、P.ガジャー、A.L.タルカ、D.W.ファドロシュ、J.ビエダ、P.チャエムサイソン、J.ミランダ、T.チャイラポンサ、J.ラベル
その後、自然早産となった妊婦と正期産の妊婦の膣内細菌叢について
マイクロバイオーム, 2 (2014), p. 18
ScopusGoogle Scholarで見る
ローゼンバーグ、ジルバー=ローゼンバーグ、2016年
E. ローゼンバーグ、I.ジルバー=ローゼンバーグ
微生物が動植物の進化を促す:ホロゲノムの考え方
MBio, 7 (2016), p. e01395
グーグルシュラー
ラウンド&マズマニアン, 2009
J.L.ラウンド、S.K.マズマニアン
腸内細菌叢は健康時と疾患時の腸管免疫応答を形成する
Nat. Rev. Immunol., 9 (2009), pp. 313-323
CrossRefView in ScopusGoogle Scholar
ラッセル他、2013年
S.L.ラッセル、M.J.ゴールド、B.P.ウィリング、L.ソーソン、K.M.マクナグニー、B.B.フィンレイ
周産期の抗生物質投与がマウス微生物叢、免疫応答、アレルギー性喘息に及ぼす影響
腸内細菌, 4 (2013), pp.158-164
CrossRefView in ScopusGoogle Scholar
サラザール他、2014年
N. サラサール、S.アルボレヤ、L.バルデス、C.スタントン、P.ロス、L.ルイス、M.グイモンデ、C.G.デロスレイエス=ガビラン
人生の極限期におけるヒト腸内細菌叢。変化に対抗する方法としての食生活の介入
Front. Genet.、5 (2014), p. 406
ScopusGoogle Scholarで見る
Schaferら、2012年
D.P.シェーファー、E.K.レアマン、A.G.カウツマン、小山倫明、A.R.マーディンリー、山崎倫明、R.M. ランソホフ、M.E. グリーンバーグ、 B.A.Barres, B. Stevens
マイクログリアは生後の神経回路を活性と補体依存的に彫刻する
Neuron, 74 (2012), pp.691-705
PDFを見る記事を見るScopusGoogle Scholarで見る
シェパーヤンス他、2015年
F. Scheperjans, V. Aho, P.A.B. Pereira, K. Koskinen, L. Paulin, E. Pekkonen, E. Haapaniemi, S. Kaakkola, J. Eerola-Rautio, M. Pohja, et al.
腸内細菌叢はパーキンソン病と臨床表現型に関連する
Mov. Disord., 30 (2015), pp. 350-358
CrossRefView in ScopusGoogle Scholar
Schloissnigら、2013年
S. Schloissnig、M. Arumugam、S. Sunagawa、M. Mitreva、J. Tap、A. Zhu、A. Waller、D. R. Mende、J. R. Kultima、 J. Martin, et al.
ヒト腸内細菌叢のゲノム変異ランドスケープ
ネイチャー, 493 (2013), pp.45-50
CrossRefView in ScopusGoogle Scholar
Sempleら、2013年
B.D. Semple、K. Blomgren、K. Gimlin、D.M. Ferriero、L.J. Noble-Haeusslein
齧歯類とヒトの脳の発達: 種を超えた成熟と傷害に対する脆弱性のベンチマークを特定する。
Prog. 神経生物学、106-107(2013)、pp.1-16
PDFを見る記事を見るScopusGoogle Scholarで見る
Sevelstedら、2015年
A. Sevelsted、J. Stokholm、K. Bønnelykke、H. Bisgaard
帝王切開と慢性免疫疾患
小児科、135(2015)、e92-e98頁
CrossRefView in ScopusGoogle Scholar
セベランス他、2013年
E.G.セヴェランス、K.L.グレシット、C.R.ストーリングス、A.E.オリゴーニ、S.クシャラニ、エフエムルイケ、エフビーディカーソン、リッチヨルケン
統合失調症における細菌転座マーカーの不一致パターンと自然免疫のアンバランスへの示唆
Schizophr. Res., 148 (2013), pp.130-137.
PDFを見る記事を見るScopusGoogle Scholarで見る
セベランス他、2014年
E.G.セベランス、R.H.ヨルケン、W.W.イートン
統合失調症における自己免疫疾患、消化器疾患、マイクロバイオーム:直感を超えるもの
Schizophr. Res.、176(2014)、23-35ページ
Google Scholar
スライカーマン他、2016年
R.F.スライカーマン、J.トンプソン、K.E.ウォルディ、R.マーフィー、C.ウォール、E.A.ミッチェル
生後1年目の抗生物質とその後の神経認知のアウトカムについて
Acta Paediatr. (2016), 10.1111/apa.13613
2016年10月4日オンライン公開
Google Scholar
スミスほか、2007年
S.E.P. Smith, J. Li, K. Garbett, K. Mirnics, P.H. Patterson
母体免疫活性化はインターロイキン-6を介して胎児の脳発達を変化させる
J. Neurosci., 27 (2007), pp.10695-10702
ScopusGoogle Scholarで見る
ソンら、2015年
J.S. Son, L.J. Zheng, L.M. Rowehl, X. Tian, Y. Zhang, W. Zhu, L. Litcher-Kelly, K.D. Gadow, G. Gathungu, C.E. Robertson, et al.
サイモンズ・シンプレックス・コレクションにおける自閉症スペクトラム障害児と神経質な兄弟姉妹の糞便微生物相の比較
PLoS ONE, 10 (2015), p. e0137725
CrossRefView in ScopusGoogle Scholar
ステンスバール他、2013年
L.G. Stensballe, J. Simonsen, S.M. Jensen, K. Bønnelykke, H. Bisgaard
妊娠中の抗生物質の使用は、幼児期の喘息リスクを高める
J. 小児科, 162 (2013), pp.832-838.e3
PDFを見る記事を見るScopusGoogle Scholarで見る
Stephanら、2012年
A.H.ステファン、B.A.バレス、B.スティーブンス
補体系:発生と疾病におけるシナプス刈り込みの予期せぬ役割
Annu. Rev.Neurosci.、35 (2012), pp.369-389
CrossRefView in ScopusGoogle Scholar
Stiles and Jernigan, 2010
J. スタイルズ、T.L.ジャーニガン
脳の発達の基礎知識
Neuropsychol. Rev., 20 (2010), pp.327-348.
CrossRefView in ScopusGoogle Scholar
スティリング他、2015年
R.M.スティリング、F.J.ライアン、A.E.ホバン、F.シャナハン、G.クラーク、M.J.クラエッソン、T.G.ディナン、J.F.クリアン
微生物と神経発達--幼少期の微生物相の欠如は扁桃体の活動関連転写経路を増加させる
脳内ビヘイビア. 免疫, 50 (2015), pp.209-220
PDFを見る記事を見るScopusGoogle Scholarで見る
須藤ら、2004
N. 須藤、千田、相葉、園田、大山、X.-N.Yu. Yu、C. Kubo、Y. Koga
出生後の微生物コロニー形成がマウスのストレス応答に関する視床下部-下垂体-副腎系をプログラムする
J. Physiol., 558 (2004), pp.263-275
ScopusGoogle Scholarで見る
サンら、2016年
J. 孫、王、Z.Ling、X.Yu、W.Chen、H.Li、J.Jin、M.Pang、H. Zhang、J. Yu、J. Liu
Clostridium butyricumは腸内細菌叢の調節を介して糖尿病マウスの脳虚血・再灌流障害を抑制する
Brain Res., 1642 (2016), pp.180-188
PDFを見る記事を見るScopusGoogle Scholarで見る
Tillischら、2013年
K. Tillisch, J. Labus, L. Kilpatrick, Z. Jiang, J. Stains, B. Ebrat, D. Guyonnet, S. Legrain-Raspaud, B. Trotin, B. Naliboff, et al.
プロバイオティクスを含む発酵乳製品の摂取は脳活動を調節する
消化器病学, 144 (2013), pp.1394-1401
ScopusGoogle Scholarで見る
栃谷ら、2016年
S. 栃谷、池野、伊藤、櫻井、山内、松崎、松崎英樹
母体腸内細菌叢を撹乱する非吸収性抗生物質の妊娠マウスへの投与は、子孫の行動の変化と関連する
PLoS ONE, 11 (2016), p. e0138293
CrossRefGoogle Scholar
ウンガー他、2016年
M.M. Unger, J. Spiegel, K.-U. Dillmann、D. Grundmann、H. Philippeit、J. Bürmann、K. Faßbender、A. Schwiertz、K. -H. シェーファー
短鎖脂肪酸と腸内細菌叢は、パーキンソン病患者と年齢をマッチさせた対照群との間で異なる
パーキンソニズムRelat. Disord. (2016), 10.1016/j.parkreldis.2016.08.019
2016年8月26日オンライン公開
Google Scholar
van Tongerenら、2005年
S.P. van Tongeren, J.P.J. Slaets, H.J.M. Harmsen, G.W. Welling
糞便微生物叢組成と虚弱体質
Appl. Environ. 微生物学, 71 (2005), pp.6438-6442
ScopusGoogle Scholarで見る
Varvelら、2012年
N.H. Varvel, S.A. Grathwohl, F. Baumann, C. Liebig, A. Bosch, B. Brawek, D.R. Thal, I.F. Charo, F.L. Heppner, A. Aguzzi, et al.
ミクログリア再増殖モデルにより、中枢神経系ミエロイド細胞を置換するための強固な恒常性プロセスが明らかになった
Proc. Natl. Acad. Sci. USA, 109 (2012), pp.18150-18155
CrossRefView in ScopusGoogle Scholar
Williamsら、2011年
B.L. Williams、M. Hornig、T. Buie、M.L. Bauman、M. Cho Paik、I. Wick、A. Bennett、O. Jabado、D. L. Hirschberg、W. I. Lipkin
自閉症・胃腸障害児の腸内における炭水化物の消化・輸送障害と粘膜異種細菌の存在
PLoS ONE, 6 (2011), p. e24585
CrossRefView in ScopusGoogle Scholar
Williamsら、2012年
B.L. Williams、M. Hornig、T. Parekh、W.I. Lipkin
自閉症および胃腸障害児の腸管生検サンプルにおけるSutterella種の検出、定量および系統的特徴付けのための新規PCRベースの手法の応用
MBio, 3 (2012)
e00261-11
Google Scholar
ヤスールら、2016
M. ヤスール、T. ヴァタネン、H. シルヤンダー、A.-M. Hämäläinen, T. Härkönen, S.J. Ryhänen, E.A. Franzosa, H. Vlamakis, C. Huttenhower, D. Gevers, et al., DIABIMMUNE Study Group
乳児腸内細菌叢の自然史と抗生物質投与が細菌株の多様性と安定性に与える影響
Sci. Transl. メド、8(2016)、p.343ra81
ScopusGoogle Scholarで見る
ヤツネンコ他、2012年
T. Yatsunenko, F.E. Rey, M.J. Manary, I. Trehan, M.G. Dominguez-Bello, M. Contreras, M. Magris, G. Hidalgo, R.N. Baldassano, A.P. Anokhin, et al.
年齢や地域によって異なるヒト腸内細菌叢の見方
ネイチャー, 486 (2012), pp.222-227
CrossRefView in ScopusGoogle Scholar
ユルミヤら、2015
R. イルミヤ、N.リマーマン、R.レシェフ
ミクログリア病としてのうつ病
Trends Neurosci., 38 (2015), pp.637-658.
PDFを見る記事を見るScopusGoogle Scholarで見る
ヨルケンら、2015年
R.H. Yolken, E.G. Severance, S. Sabunciyan, K.L. Gressitt, O. Chen, C. Stallings, A. Origoni, E. Katsafanas, L.A.B. Schweinfurth, C.L.G. Savage, et al.
統合失調症患者の口腔咽頭ファージオームが対照群と異なることをメタゲノミックシークエンスが示す
シゾファー(Schizophr. ブル, 41 (2015), pp.1153-1161
CrossRefView in ScopusGoogle Scholar
ツァイゼル, 2004
S.H. Zeisel
脳の発達に必要なコリンの栄養学的重要性
J. Am. Coll. Nutr., 23 (6, Suppl) (2004), pp.621S-626S
CrossRefGoogle Scholar
ツァイシグとブルムバーグ、2014年
S. ツァイシグ、R.S.ブルンバーグ
生命の始まり:幼少期における抗生物質による微生物叢の摂理と健康と病気におけるその役割
Nat. Immunol., 15 (2014), pp.307-310.
CrossRefView in ScopusGoogle Scholar
Zhan et al, 2014
Y. Zhan, R.C. Paolicelli, F. Sforazzini, L. Weinhard, G. Bolasco, F. Pagani, A.L. Vyssotski, A. Bifone, A. Gozzi, D. Ragozzino, C.T.Gross.
ニューロン-ミクログリア間のシグナル伝達が欠損すると、脳の機能的結合が損なわれ、社会的行動も損なわれる
Nat. ニューロサイエンス, 17 (2014), pp.400-406
CrossRefView in ScopusGoogle Scholar
Zhengら、2015a
J. 鄭、X.シャオ、Q.チャン、L.マオ、M.ユー、J.シュウ
胎盤マイクロバイオームと低出生体重児の関連について
栄養素, 7 (2015), pp. 6924-6937
CrossRefView in ScopusGoogle Scholar
Zhengら、2015b
L.-S. 鄭、金子直樹、澤本欣也
ミノサイクリン投与によるインターフェロンα誘導性神経原性障害およびうつ病様行動の改善マウス
フロント Cell. Neurosci., 9 (2015), p. 5
CrossRefGoogle Scholar
Zhengら、2016年
P. Zheng, B. Zeng, C. Zhou, M. Liu, Z. Fang, X. Xu, L. Zeng, J. Chen, S. Fan, X. Du, et al.
腸内細菌叢のリモデリングは宿主の代謝を介した経路でうつ病様行動を誘発する
Mol. Psychiatry, 21 (2016), pp.786-796
CrossRefView in ScopusGoogle Scholar
ズッケロとバレス、2015年
J.B.ズケロ、B.A.バレス
哺乳類の発生と疾病におけるグリア
開発』142号(2015年)、3805-3809頁
CrossRefView in ScopusGoogle Scholar
引用元: (752)
アルツハイマー病リスクのある高齢者の認知力を高める食事について
2023年、ニュートリション
抄録を表示する
マイクロバイオームによる自然免疫系機能の制御: 腫瘍免疫とがん免疫療法への影響
2023年、免疫学セミナー
抄録を表示する
双極性うつ病患者における脳腸内細菌叢マルチモーダル予測モデル
2023年、Journal of Affective Disorders誌
抄録を表示する
酸化亜鉛ナノ粒子の肺曝露による大脳皮質損傷は、肺-腸-脳軸の破壊が関与する
2023年、トキシコロジー
抄録を表示する
広域抗生物質が腸・微生物・脾臓・脳軸に与える影響について
2023年、脳・行動・免疫 - 健康
抄録を表示する
ハンチンチン関連蛋白質1の神経化学的表現とネズミ小腸粘膜下層における分泌運動ニューロンおよび血管拡張ニューロンの関係
2023年、ニューロサイエンス研究
抄録を表示する
Scopusの引用論文をすべて見る
© 2016 Elsevier Inc.
エルゼビアのロゴとワードマーク
ScienceDirectについて
リモートアクセス
ショッピングカート
広告を出す
お問い合わせ・サポート
ご利用条件
個人情報保護方針
当社は、サービスの提供や強化、コンテンツや広告のカスタマイズのためにCookieを使用しています。継続することで、クッキーの使用に同意することになります。
著作権 © 2023 Elsevier B.V.またはそのライセンサーもしくは貢献者。ScienceDirect® はElsevier B.V.の登録商標です。
RELXグループホームページ
ピーディーエフ
ヘルプ
フィードバック
この記事が気に入ったらサポートをしてみませんか?
