
CDCのガイダンス|COVID-19抗体検査の暫定ガイドラインについて 松廼屋 論点解説!
こんにちは!
matsunoya です。
今回の「松廼屋 論点解説!」では、新型コロナウイルス感染症の検査から、今、なにかと話題が多い抗体検査をテーマとして取り上げます。
https://note.com/matsunoya_note
Here: https://note.com/matsunoya_note/n/n485e792ddcbd
CDCのガイダンス|COVID-19抗体検査の暫定ガイドラインについて 松廼屋 論点解説!
新型コロナウイルス感染症の検査には、現在、PCR検査、抗体検査、抗原検査という3つのそれぞれメカニズムが異なる検査があります。
薬学生の皆さんは、全ての検査の基本的なメカニズムは大学のコアカリキュラムのなかで学習しますから、すでに習っていれば理解できるはずです。
この note では、最近、米国の Centers for Disease Control and Prevention (CDC|アメリカ疾病予防管理センター) から発行された「COVID-19抗体検査の暫定ガイドライン」(発行日|2020年5月23日)を紹介します。
このガイドラインを読むと、現時点でのCOVID-19抗体検査がどのようなもので、どういった活用の仕方があるのかなど、科学的および規制として、正しい枠組みが理解できます。
とりあえず、一緒に CDC 「COVID-19抗体検査の暫定ガイドライン」を読んでみましょう。そして、関連する話題として、FDA「EUA認定の血清学テストのパフォーマンス」も読みます。
原文の英語と日本語の対訳を、段落ごとに示します。
英語と日本語で並行して読みながら、新型コロナウイルス感染症の検査のひとつである抗体検査に関する概要と各論、そしてその検出のメカニズムの特徴と性能に応じた結果の考察、公衆衛生上の活用の仕方について、理解を深めることができます。
参考資料|
CDC | Interim Guidelines for COVID-19 Antibody Testing in Clinical and Public Health Settings
https://www.cdc.gov/coronavirus/2019-ncov/lab/resources/antibody-tests-guidelines.html
現時点で上記のサイトからダウンロードした暫定ガイダンスのPDF
(ダウンロードした日|2020.05.27)
英語版|
関連する話題|
FDA | EUA Authorized Serology Test Performance
EUA認定の血清学テストのパフォーマンス
Source:
関連する note|
速報|openFDA API "Independent Evaluations of COVID-19 Serological Tests" を FDA がシェア 松廼屋 論点解説!
https://note.com/matsunoya_note/n/n2159d90d0ad2
それでは、本文を読んでみましょう。
以下、原文を CDC https://www.cdc.gov/coronavirus/2019-ncov/lab/resources/antibody-tests-guidelines.html から引用し、基本的には自動翻訳によって日本語に訳し、部分的に校正した対訳を掲載します。
準備運動|
🌞朝英語
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) May 28, 2020
CDC|COVID-19抗体検査の暫定ガイドラインから
Recommendations for persons who test positive for anti-SARS-CoV-2 antibodies
☑抗SARS-CoV-2抗体が陽性であると診断された人への推奨
この👆項の冒頭の文章を
「何も見ずに」聴きとって翻訳してみよう🙂 pic.twitter.com/gLViJh6jW0
|
🌞朝英語 (2)
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) May 28, 2020
CDC|COVID-19抗体検査の暫定ガイドラインから
Recommendations for persons who test positive for anti-SARS-CoV-2 antibodies
☑抗SARS-CoV-2抗体が陽性であると診断された人への推奨
この👆項の2段落目の文章を
「何も見ずに」聴きとって翻訳してみよう😃 pic.twitter.com/3jo0KD4izG
|
🌞朝英語 (3)
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) May 28, 2020
CDC|COVID-19抗体検査の暫定ガイドラインから
Recommendations for persons who test positive for anti-SARS-CoV-2 antibodies
☑抗SARS-CoV-2抗体が陽性であると診断された人への推奨
この👆項の3段落目の文章を
「何も見ずに」聴きとって翻訳してみよう🥎#薬剤師 #医療従事者 pic.twitter.com/uH6hqXitBq
|
🌞昼英語
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) May 28, 2020
CDC|COVID-19抗体検査の暫定ガイドラインから
Optimizing Testing Outcomes|Test performance
☑テスト結果の最適化|テスト性能
この👆項の冒頭の文章を
「何も見ずに」聴きとって翻訳してみよう🥎#薬剤師 #医療従事者 #eラーニング #松廼屋 論点解説!
👉 https://t.co/D8WiZKLFiz pic.twitter.com/BRAC52yp4r
|
🌞昼英語 (2)#松廼屋 論点解説!
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) May 29, 2020
CDC|COVID-19抗体検査の暫定ガイドラインから😃https://t.co/D8WiZKLFiz#薬剤師 #医師 #英語 #eラーニング
Optimizing Testing Outcomes|Test performance
☑テスト結果の最適化|テスト性能
この項の第2段落の文章を
「何も見ずに」聴きとって翻訳してみよう🔊 pic.twitter.com/IbB19k8tGJ
|
🌞昼英語 (3)
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) May 28, 2020
CDC|COVID-19抗体検査の暫定ガイドラインから
Optimizing Testing Outcomes|Test performance
☑テスト結果の最適化|テスト性能
この👆項の第3段落の文章を
「何も見ずに」聴きとって翻訳してみよう🥎#薬剤師 #英語 #eラーニング #松廼屋 論点解説!https://t.co/D8WiZKLFiz pic.twitter.com/YqD9DDUN8x
|
🌞昼英語 (4)
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) May 28, 2020
CDC|COVID-19抗体検査の暫定ガイドラインから
Optimizing Testing Outcomes|Testing strategies
☑テスト結果の最適化|テスト戦略
この👆項の冒頭の文章を
「何も見ずに」聴きとって翻訳してみよう🥎#薬剤師国家試験 #eラーニング #松廼屋 論点解説!https://t.co/D8WiZKLFiz pic.twitter.com/7OBIJVNcP7
|
🌞昼英語 (5)
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) May 28, 2020
CDC|COVID-19抗体検査の暫定ガイドラインから
Optimizing Testing Outcomes|Testing strategies
☑テスト結果の最適化|テスト戦略
この👆項の第2段落の文章を
「何も見ずに」聴きとって翻訳してみよう🥎#薬剤師 #医師 #eラーニング #松廼屋 論点解説!https://t.co/D8WiZKLFiz pic.twitter.com/pCErtccDij
|
🌞昼英語 (6)
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) May 28, 2020
CDC|COVID-19抗体検査の暫定ガイドラインから
Optimizing Testing Outcomes|Testing strategies
☑テスト結果の最適化|テスト戦略
この👆項の第3段落の文章を
「何も見ずに」聴きとって翻訳してみよう🥎#薬剤師 #医師 #eラーニング #松廼屋 論点解説!https://t.co/D8WiZKLFiz pic.twitter.com/hOHDZaSOCK
|
🌞朝英語 (4)
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) May 29, 2020
CDC|COVID-19抗体検査の暫定ガイドラインから#松廼屋 論点解説!👉 https://t.co/D8WiZL3gH9
Current Status of Antibody Testing in the United States|FDA-authorized serologic tests
☑FDA認可の血清学的検査
この👆項の冒頭の文章を
「何も見ずに」聴きとって翻訳してみよう🔊 pic.twitter.com/DxviskBl3j
|
🌞朝英語 (5)
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) May 29, 2020
CDC|COVID-19抗体検査の暫定ガイドラインから#松廼屋 論点解説!👉 https://t.co/D8WiZKLFiz
Current Status of Antibody Testing in the United States|FDA-authorized serologic tests
☑FDA認可の血清学的検査
この👆項の冒頭の文章を
「何も見ずに」聴きとって翻訳してみよう🔊 pic.twitter.com/c8RorGpfDo
|
#note matsunoya_note に Table の補足説明の図を追加しました😃
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) May 30, 2020
見てねー👉 https://t.co/D8WiZKLFiz#薬剤師国家試験 #薬剤師 #薬剤師国家試験対策 https://t.co/wdATra60Xp pic.twitter.com/0FGKJB7Rwi
|
#note matsunoya_note に Table 1 の補足説明の図を追加しました😃見てねー👉 https://t.co/D8WiZL3gH9#薬剤師国家試験 #薬剤師 #薬剤師国家試験対策 https://t.co/0phrh5PRv9 pic.twitter.com/U5ZXzD7VIQ
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) May 30, 2020
|
💡Mats' ✒ワンポイント
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) May 30, 2020
1. @Mats_blnt_pharm Tweet https://t.co/f8EOarkt89 画像をクリックするとこの画面(下図)になる。
2. RTもとの動画▶ をクリックすると、音声が流れます。
なんだろー🙂、この高機能LMS #eラーニング な雰囲気。。とても、いいね!😌♫
※LMS: Learning Management System pic.twitter.com/llygNHn7pe
|
#note matsunoya_note に Table 1 の補足説明の図を追加しました😃見てねー👉
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 1, 2020
CDCのガイダンス|COVID-19抗体検査の暫定ガイドラインについて #松廼屋 論点解説!https://t.co/D8WiZL3gH9#薬剤師国家試験 #薬剤師 #薬剤師国家試験対策 #医師 #医療従事者
感度・特異性・有病率と検査の性能の関係📊 https://t.co/vxjtggxLiF pic.twitter.com/aZUxTDYfkq
|
#note matsunoya_note に Table 1 の補足説明図を追加しました🙂見てねー👉
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 3, 2020
CDCのガイダンス|COVID-19抗体検査の暫定ガイドラインについて #松廼屋 論点解説!https://t.co/D8WiZKLFiz#薬剤師国家試験 #薬剤師 #薬剤師国家試験対策 #医師 #医療従事者
感度・特異性・有病率⇒検査性能を算出する式 https://t.co/P7ursT0jGG pic.twitter.com/7LUIOEYfcD
|
🌞Q. What is the sentence entering 〔 〕?
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 3, 2020
A list of all tests authorized for〔A〕under〔B〕is maintained on an〔C〕. All currently authorized tests are〔D〕(providing a result that is〔E〕rather than〔F〕(providing a〔G〕). #薬剤師国家試験 #note 👉https://t.co/EtXiQLPJRA https://t.co/AToHuAVGhN pic.twitter.com/A9DIt9K6Xx
|
🌞Q. What is the sentence entering〔 〕?
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 4, 2020
Serologic testing technologies include single-use,〔A〕tests where the〔B〕is demonstrated by a〔C〕on a〔D〕and laboratory-based〔E〕that allow for processing of〔F〕at the same time.#薬剤師国家試験 #note 👉https://t.co/EtXiQLPJRA https://t.co/0wtYGFiDU5 pic.twitter.com/wOzEhESo4P
|
🌛☆夜英語 (1)
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 4, 2020
FDA|EUA認定の血清学テストのパフォーマンスから#松廼屋 論点解説!👉 対訳https://t.co/FL1YQzhFFQ
FDA|
EUA Authorized Serology Test Performance
About this page (1/9)
☑「何も見ずに」聴きとって翻訳してみよう🔊#薬剤師国家試験対策 #薬剤師国家試験 #薬剤師 #英語 pic.twitter.com/dJxEcJEKN4
|
🌛☆夜英語 (2)
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 4, 2020
FDA|EUA認定の血清学テストのパフォーマンスから#松廼屋 論点解説!👉 対訳https://t.co/FL1YQz04Oi
FDA|
EUA Authorized Serology Test Performance
About this page (2/9)
☑「何も見ずに」聴きとって翻訳してみよう🔊#薬剤師国家試験対策 #薬剤師国家試験 #薬剤師 #英語 pic.twitter.com/5B0evfZWfN
|
🌛☆夜英語 (3)
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 4, 2020
FDA|EUA認定の血清学テストのパフォーマンスから#松廼屋 論点解説!👉 対訳https://t.co/FL1YQz04Oi
FDA|
EUA Authorized Serology Test Performance
About this page (3/9)
☑「何も見ずに」聴きとって翻訳してみよう🔊#薬剤師国家試験対策 #薬剤師国家試験 #薬剤師 #英語 pic.twitter.com/xI3xa6DjQo
|
🌛☆夜英語 (4)
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 4, 2020
FDA|EUA認定の血清学テストのパフォーマンスから#松廼屋 論点解説!👉 対訳https://t.co/FL1YQzhFFQ
FDA|
EUA Authorized Serology Test Performance
About this page (4/9)
☑「何も見ずに」聴きとって翻訳してみよう🔊#薬剤師国家試験対策 #薬剤師国家試験 #薬剤師 #英語 pic.twitter.com/kalEV5SKER
|
🌛☆夜英語 (5)
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 4, 2020
FDA|EUA認定の血清学テストのパフォーマンスから#松廼屋 論点解説!👉 対訳https://t.co/FL1YQz04Oi
FDA|
EUA Authorized Serology Test Performance
About this page (5/9)
☑「何も見ずに」聴きとって翻訳してみよう🔊#薬剤師国家試験対策 #薬剤師国家試験 #薬剤師 #英語 pic.twitter.com/QhW6xOfi4r
|
🌛☆夜英語 (6)
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 4, 2020
FDA|EUA認定の血清学テストのパフォーマンスから#松廼屋 論点解説!👉 対訳https://t.co/FL1YQz04Oi
FDA|
EUA Authorized Serology Test Performance
About this page (6/9)
☑「何も見ずに」聴きとって翻訳してみよう🔊#薬剤師国家試験対策 #薬剤師国家試験 #薬剤師 #英語 pic.twitter.com/idvMJT0Opd
|
🌛☆夜英語 (7)
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 4, 2020
FDA|EUA認定の血清学テストのパフォーマンスから#松廼屋 論点解説!👉 対訳https://t.co/FL1YQzhFFQ
FDA|
EUA Authorized Serology Test Performance
About this page (7/9)
☑「何も見ずに」聴きとって翻訳してみよう🔊#薬剤師国家試験対策 #薬剤師国家試験 #薬剤師 #英語 pic.twitter.com/muIJHMOA0r
|
🌛☆夜英語 (8)
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 4, 2020
FDA|EUA認定の血清学テストのパフォーマンスから#松廼屋 論点解説!👉 対訳https://t.co/FL1YQz04Oi
FDA|
EUA Authorized Serology Test Performance
About this page (8/9)
☑「何も見ずに」聴きとって翻訳してみよう🔊#薬剤師国家試験対策 #薬剤師国家試験 #薬剤師 #英語 pic.twitter.com/U8qOnjBnkf
|
🌛☆夜英語 (9)
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 4, 2020
FDA|EUA認定の血清学テストのパフォーマンスから#松廼屋 論点解説!👉 対訳https://t.co/FL1YQzhFFQ
FDA|
EUA Authorized Serology Test Performance
About this page (9/9)
☑「何も見ずに」聴きとって翻訳してみよう🔊#薬剤師国家試験対策 #薬剤師国家試験 #薬剤師 #英語 pic.twitter.com/d7lD6TIBVa
|
🌞朝英語 (6)
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 5, 2020
FDA|EUA認定の血清学テストのパフォーマンスから#松廼屋 論点解説!👉対訳https://t.co/FL1YQzhFFQ
FDA|
EUA Authorized Serology Test Performance
About this page (10)
☑「何も見ずに」聴きとって翻訳してみよう🥎#薬剤師国家試験対策 #薬剤師国家試験 #薬剤師 #医師 #英語 pic.twitter.com/cpOcNUUzLs
|
🌞Q. What is the sentence entering〔 〕?
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 4, 2020
The〔 〕is described by their "sensitivity," or their ability to〔 〕, and their 〔 〕or their ability to〔 〕. A test's sensitivity can be estimated by〔 〕whether or not it is able to〔 〕. #薬剤師 #note👉https://t.co/FL1YQzhFFQ https://t.co/bwK71CG5u2 pic.twitter.com/Pr1W4Zj5wp
|
🌞Q. What is the sentence entering〔 〕?
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 5, 2020
These〔A〕of〔B〕are just that:〔C〕. They include〔D〕, which are the range of〔E〕we are about〔F〕a test's〔G〕will fall within given how〔H〕in the〔I〕.#松廼屋 論点解説!👉対訳https://t.co/FL1YQzhFFQ
#薬剤師 #医師 #英語 #note https://t.co/OzdTlWB8vR
|
🌞Q. What is the sentence entering〔 〕?
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 5, 2020
Tests are also described by 〔A〕. These measures are calculated using a〔B〕. Every test returns some〔C〕results. The〔D〕help those who〔E〕. The〔F〕of a test depend heavily on〔G〕. #薬剤師 #医療従事者 #note👉https://t.co/FL1YQzhFFQ https://t.co/pXyQyr1yhg
|
🌞Q. What is the sentence entering〔 〕?
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 5, 2020
Always refer to the〔A〕to put〔B〕and to understand how to〔C〕. 〔D〕also is providing a〔E〕of a single test or〔F〕based on their〔G〕and the〔H〕in the〔I〕.#松廼屋 論点解説!👉対訳 #薬剤師 #医師 #英語 #notehttps://t.co/FL1YQz04Oi https://t.co/jQzpWhux4i
|
🌞昼英語 (7)
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 8, 2020
CDC|COVID-19抗体検査の暫定ガイドラインから#松廼屋 論点解説!👉対訳 https://t.co/t2UxBvLAMH
Optimizing Testing Outcomes|
Limitations of Serologic Tests (1/3)
☑「何も見ずに」聴きとって翻訳してみよう🥎#薬剤師国家試験対策 #薬剤師国家試験 #薬剤師 #医師 #英語 pic.twitter.com/Xa1g7Je3t0
|
🌞昼英語 (8)
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 8, 2020
CDC|COVID-19抗体検査の暫定ガイドラインから#松廼屋 論点解説!👉対訳 https://t.co/t2UxBvLAMH
Optimizing Testing Outcomes|
Limitations of Serologic Tests (2/3)
☑「何も見ずに」聴きとって翻訳してみよう🥎🥎#薬剤師国家試験対策 #薬剤師国家試験 #薬剤師 #医師 #英語 pic.twitter.com/OASxtKbT36
|
🌞昼英語 (9)
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 8, 2020
CDC|COVID-19抗体検査の暫定ガイドラインから#松廼屋 論点解説!👉対訳 https://t.co/t2UxBvLAMH
Optimizing Testing Outcomes|
Limitations of Serologic Tests (3/3)
☑「何も見ずに」聴きとって翻訳してみよう🥎🥎🥎#薬剤師国家試験対策 #薬剤師国家試験 #薬剤師 #医師 #英語 pic.twitter.com/bluvzBJSYp
|
🌞Q. What is the sentence entering〔 〕?
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 8, 2020
At〔A〕, the〔B〕from〔C〕are〔D〕. Representatives from〔E〕, and〔F〕are working with members of〔G〕to determine whether〔H〕are indicative of〔I〕against〔J〕.#松廼屋 論点解説!対訳👉 https://t.co/t2UxBvLAMH#薬剤師 #医師 #英語 #note https://t.co/tb2TUV0CXp
|
🌞朝英語 (7)
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 8, 2020
CDC|COVID-19抗体検査の暫定ガイドラインから#松廼屋 論点解説!👉対訳 https://t.co/Np4ahNUnn2
Optimizing Testing Outcomes|
Recommendations for Use of Serologic Tests
☑「何も見ずに」聴きとって翻訳してみよう#薬剤師国家試験対策 #薬剤師国家試験 #薬剤師 #医師 #英語 pic.twitter.com/xUVTpbCwwn
|
🌞朝英語 (8)
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 8, 2020
CDC|COVID-19抗体検査の暫定ガイドラインから#松廼屋 論点解説!👉対訳 https://t.co/Np4ahNCMvu
Optimizing Testing Outcomes|
Choice of test and testing strategy (1/4)
☑「何も見ずに」聴きとって翻訳してみよう#薬剤師国家試験対策 #薬剤師国家試験 #薬剤師 #医師 #英語
|
🌞朝英語 (8)
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 8, 2020
CDC|COVID-19抗体検査の暫定ガイドラインから#松廼屋 論点解説!👉対訳 https://t.co/p63ANLEaLX
Optimizing Testing Outcomes|Choice of test and testing strategy (1/4)
☑「何も見ずに」聴きとって翻訳してみよう#薬剤師国家試験対策 #薬剤師国家試験 #薬剤師 #医師 #英語 pic.twitter.com/m7cRLlqtgq
|
🌞朝英語 (9)
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 8, 2020
CDC|COVID-19抗体検査の暫定ガイドラインから#松廼屋 論点解説!👉対訳 https://t.co/p63ANLEaLX
Optimizing Testing Outcomes|Choice of test and testing strategy (2/4)
☑「何も見ずに」聴きとって翻訳してみよう#薬剤師国家試験対策 #薬剤師国家試験 #薬剤師 #医師 #英語 pic.twitter.com/0sJLxowjzx
|
🌞朝英語 (10)
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 13, 2020
CDC|COVID-19抗体検査の暫定ガイドラインから#松廼屋 論点解説!👉対訳 https://t.co/p63ANLVLDv
Optimizing Testing Outcomes|Choice of test and testing strategy (3/4)
☑「何も見ずに」聴きとって翻訳してみよう#薬剤師国家試験対策 #薬剤師国家試験 #薬剤師 #医師 #英語 pic.twitter.com/SBFhkfJuaP
|
🌞朝英語 (11)
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 14, 2020
CDC|COVID-19抗体検査の暫定ガイドラインから#松廼屋 論点解説!👉対訳 https://t.co/p63ANLVLDv
Optimizing Testing Outcomes|Choice of test and testing strategy (4/4)
☑「何も見ずに」聴きとって翻訳してみよう#薬剤師国家試験対策 #薬剤師国家試験 #薬剤師 #医師 #英語 pic.twitter.com/65soARiufH
|
🌞Q. What is the sentence entering〔 〕?
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 14, 2020
Serologic assays that have〔A〕are preferred for public health or clinical use since their〔B〕have been reviewed by〔C〕.
Serologic test results should be〔D〕in the〔E〕of the〔F〕.#松廼屋 論点解説!👉対訳 https://t.co/p63ANLVLDv https://t.co/7lBEwGthrw
|
Q. What is the sentence entering〔 〕?
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 15, 2020
Assure a〔A〕by choosing tests with sufficiently high〔B〕and testing〔C〕with a high〔D〕of having 〔E〕 (e.g., persons with〔F〕), or if a high〔G〕cannot be assured with〔H〕, use〔I〕.#松廼屋 論点解説!👉対訳 https://t.co/p63ANLEaLX https://t.co/OAn9Xbzp8X
|
🌞Q. What is the sentence entering〔 〕?
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 16, 2020
The〔A〕may indicate〔B〕, but〔C〕are not〔D〕. Over time, it may be〔E〕in samples that are〔F〕to ensure that〔G〕as〔H〕and〔I〕are expected to〔J〕.
〔K〕should〔L〕until〔M〕.#松廼屋 論点解説!👉対訳 https://t.co/p63ANLVLDv https://t.co/sMW5QBLguR
|
YouTube|Playlist
CDC|COVID-19抗体検査の暫定ガイドラインについて 松廼屋 論点解説!
https://www.youtube.com/playlist?list=PLuPATLvMiAKr837gvcz2P761e2yW7AlF6
※Twitterで使用した動画を YouTube 再生リストですべてご覧になる場合は、こちらからどうぞ。
|
この eラーニングの 文字数と学習時間|
43549 文字|86分(500文字/min)- 123分(350文字/min)
©2020 松廼屋 Mats.theBASE All rights reserved.
※対訳は、あくまでこのコンテンツ制作者(滝沢幸穂 | Yukiho Takizawa, PhD)の私見に基づくもので、補助的な学習ツールです。
※以下の対訳では、自動翻訳に独自の校正を追加しています。
※補助的な学習ツールである当該コンテンツの著作権は、松廼屋にあります。業務上の無断使用および複写・配布などはご遠慮ください。当コンテンツの著作権に抵触する行為は、お断りします。
※なんらかの判断等への基本情報としての責任は持てませんのでご了承ください。判断を必要とする場合は、出典の原文を参考としてください。

CDC | Interim Guidelines for COVID-19 Antibody Testing in Clinical and Public Health Settings
臨床および公衆衛生環境におけるCOVID-19抗体検査の暫定ガイドライン
Data that will inform serologic testing guidance is rapidly evolving. Recommendations on the use of serologic tests to determine protective immunity and infectiousness among persons recently infected with SAR-CoV-2 will be updated as new information becomes available.
血清学的検査ガイダンスを通知するデータは急速に進化しています。SAR-CoV-2に最近感染した人の防御免疫および感染性を決定するための血清学的検査の使用に関する推奨事項は、新しい情報が利用可能になると更新されます。
Summary
概要
Serologic methods have been developed and will have important public health and clinical uses to monitor and respond to the COVID-19 pandemic.
血清学的方法が開発されており、血清学的方法にはCOVID-19のパンデミックを監視し、それに対応するための重要な公衆衛生および臨床用途があります。
Serologic assays for SARS-CoV-2 now have Emergency Use Authorization (EUA) by the U.S. Food and Drug Administration (FDA), which has independently reviewed their performance.
Currently, there is no identified advantage of assays whether they test for IgG, IgM and IgG, or total antibody.
SARS-CoV-2の血清学的アッセイには、現在、米国食品医薬品局(FDA)による緊急使用許可(EUA)があり、独自にそのパフォーマンスを確認しています。
現在、IgG、IgMおよびIgG、または総抗体のいずれの検査にも、アッセイの優位性は確認されていません。
It is important to minimize false positive test results by choosing an assay with high specificity and by testing populations and individuals with an elevated likelihood of previous exposure to SARS-CoV-2. Alternatively, an orthogonal testing algorithm (i.e., employing two independent tests in sequence when the first test yields a positive result) can be used when the expected positive predictive value of a single test is low.
特異性の高いアッセイを選択し、SARS-CoV-2への以前の暴露の可能性が高い集団および個人をテストすることにより、偽陽性のテスト結果を最小限に抑えることが重要です。あるいは、単一のテストの期待される陽性予測値(陽性適中度|positive predictive value)が低い場合は、直交テストアルゴリズム(つまり、最初のテストで肯定的な結果が得られたときに2つの独立したテストを順番に使用)を使用できます。
Antibodies most commonly become detectable 1-3 weeks after symptom onset, at which time evidence suggests that infectiousness likely is greatly decreased and that some degree of immunity from future infection has developed. However, additional data are needed before modifying public health recommendations based on serologic test results, including decisions on discontinuing physical distancing and using personal protective equipment.
抗体は最も一般的には症状の発症後1〜3週間で検出可能になります。その時点で、感染性が大幅に低下している可能性が高く、将来の感染に対するある程度の免疫が発達していることが証拠により示唆されています。ただし、血清学的検査結果に基づいて、物理的な距離の中止や個人用保護具の使用の決定などの公衆衛生の推奨事項を変更する前に、追加データが必要です。
Background
背景
Serologic assays for SARS-CoV-2, now broadly available, can play an important role in understanding the virus’s epidemiology in the general population and identifying groups at higher risk for infection. Unlike viral direct detection methods such as nucleic acid amplification or antigen detection tests that can detect acutely infected persons, antibody tests help determine whether the individual being tested was ever infected—even if that person never showed symptoms. Serologic tests detect waning or past SARS-CoV-2 virus infection indirectly, by measuring the host humoral immune response to the virus. Therefore, serology assays do not typically replace direct detection methods as the primary tool for diagnosing an active SARS-CoV-2 infection, but they do have several important applications in monitoring and responding to the COVID-19 pandemic.
現在広く利用可能なSARS-CoV-2の血清学的アッセイは、一般集団におけるウイルスの疫学を理解し、感染リスクが高いグループを特定する上で重要な役割を果たすことができます。急性感染者を検出できる核酸増幅または抗原検出検査などのウイルス直接検出法とは異なり、抗体検査は、検査を受けている個人がこれまでに感染したかどうかを判断するのに役立ちます。血清学的検査は、ウイルスに対する宿主の体液性免疫反応を測定することによって、減弱しているまたは過去のSARS-CoV-2ウイルス感染を間接的に検出します。したがって、血清学的アッセイは、通常、直接的な検出方法に代わって、アクティブなSARS-CoV-2感染を診断するための主要なツールとしては機能しませんが、COVID-19パンデミックのモニタリングと応答についてのいくつかの重要なアプリケーションとなります。
Although serologic tests should not be used at this time to determine if an individual is immune, these tests can help determine the proportion of a population previously infected with SARS-CoV-2 and provide information about populations that may be immune and potentially protected. Thus, demographic and geographic patterns of serologic test results can help determine which communities may have experienced a higher infection rate and therefore may have higher rates of herd immunity. In some instances, serologic test results may assist with identifying persons potentially infected with SARS-CoV-2 and determining who may qualify to donate blood that can be used to manufacture convalescent plasma as a possible treatment for those who are seriously ill from COVID-19.
現時点では血清学的検査を使用して免疫があるかどうかを判断するべきではありませんが、これらの検査は、以前にSARS-CoV-2に感染した集団の割合を判断し、免疫があり防御されている可能性のある集団に関する情報を提供するのに役立ちます。したがって、血清学的検査結果の人口統計学的および地理的パターンは、どのコミュニティがより高い感染率を経験した可能性があり、したがって集団免疫のより高い率を有する可能性があるかを決定するのに役立ちます。場合によっては、血清学的検査結果は、SARS-CoV-2に感染している可能性のある人物を特定し、COVID-19で重病の人のための可能な治療として、回復期血漿の製造に使用できる献血に適格な人物を特定するのに役立ちます。
Development of Antibodies and Immunity
抗体の開発と免疫
Nearly all immune competent individuals will develop an immune response following SARS-CoV-2 infection. Like infections with other pathogens, SARS-CoV-2 infection elicits development of IgM and IgG antibodies, which are the most useful for assessing antibody response because little is known about IgA response in the blood.
ほぼすべての免疫適格者は、SARS-CoV-2感染後に免疫応答を発症します。他の病原体による感染症と同様に、SARS-CoV-2感染症はIgMおよびIgG抗体の発生を誘発します。血液中のIgA応答についてはほとんど知られていないため、これらは抗体応答の評価に最も役立ちます。
Antibodies in some persons can be detected within the first week of illness onset. SARS-CoV-2 infections are somewhat unusual because IgM and IgG antibodies arise nearly simultaneously in serum within 2 to 3 weeks after illness onset. Thus, detection of IgM without IgG is uncommon. How long IgM and IgG antibodies remain detectable following infection is not known.
一部の人の抗体は、発症から1週間以内に検出されます。IgM抗体とIgG抗体が発症から2〜3週間以内に血清中にほぼ同時に発生するため、SARS-CoV-2感染はやや珍しいです。したがって、IgGなしでのIgMの検出は一般的ではありません。IgM抗体とIgG抗体が感染後に検出可能な状態にある期間は不明です。
In addition, development of neutralizing antibodies can also be assessed. Neutralizing antibodies inhibit viral replication in vitro, and as with many infectious diseases, their presence correlates with immunity to future infection, at least temporarily.
さらに、中和抗体の発生も評価できます。中和抗体は、インビトロでのウイルス複製を阻害し、多くの感染症と同様に、それらの存在は、少なくとも一時的に将来の感染に対する免疫と相関します。
Recurrence of COVID-19 illness appears to be very uncommon, suggesting that the presence of antibodies could confer at least short-term immunity to infection with SARS-CoV-2. Consistent with this observation, experimental primary infection in primates and subsequent development of antibodies resulted in protection from reinfection after the primates were rechallenged. Additionally, antibody development in humans correlates with a marked decrease in viral load in the respiratory tract. Taken together, these observations suggest that the presence of antibodies may decrease a person’s infectiousness and offer some level of protection from reinfection. However, definitive data are lacking, and it remains uncertain whether individuals with antibodies (neutralizing or total) are protected against reinfection with SARS-CoV-2, and if so, what concentration of antibodies is needed to confer protection.
COVID-19疾患の再発は非常にまれであるように見え、これは抗体の存在がSARS-CoV-2による感染に対して少なくとも短期的な免疫を与えることができることを示唆しています。この観察と一致して、霊長類における実験的一次感染およびその後の抗体の発生は、霊長類が再攻撃された後の再感染からの防御をもたらした。さらに、ヒトでの抗体の発生は、気道でのウイルス量の顕著な減少と相関しています。まとめると、これらの観察結果は、抗体の存在が人の感染力を低下させ、再感染からある程度の防御を提供する可能性があることを示唆しています。ただし、明確なデータはなく、抗体(中和または全体)を持つ個人がSARS-CoV-2による再感染から保護されているかどうかは不明です。
Current Status of Antibody Testing in the United States
米国における抗体検査の現状
Antigenic targets
抗原標的
The two major antigenic targets of SARS-CoV-2 virus against which antibodies are detected are spike glycoprotein (S) and nucleocapsid phosphoprotein (N). While S protein is essential for virus entry and is present on the viral surface, N protein is the most abundantly expressed immunodominant protein that interacts with RNA. Multiple forms of S protein — full-length (S1+S2) or partial (S1 domain or receptor binding domain [RBD]) — are used as antigens. The protein target determines cross-reactivity and specificity because N is more conserved across coronaviruses than S, and within S, RBD is more conserved than S1 or full-length S.
抗体が検出されるSARS-CoV-2ウイルスの2つの主要な抗原標的は、スパイク糖タンパク質(S)とヌクレオカプシドリンタンパク質(N)です。Sタンパク質はウイルスの侵入に不可欠であり、ウイルス表面に存在しますが、Nタンパク質は、RNAと相互作用する最も豊富に発現する免疫優性タンパク質です。Sタンパク質の複数の形態—完全長(S1 + S2)または部分的(S1ドメインまたは受容体結合ドメイン[RBD])—が抗原として使用されます。NはSよりもコロナウイルス全体で保存されており、S内では、RBDはS1または完全長Sより保存されているため、タンパク質ターゲットは交差反応性と特異性を決定します。
Types of Antibody Testing
抗体検査の種類
Different types of assays can be used to determine different aspects of immune response and functionality of antibodies. The tests can be broadly classified to detect either binding or neutralizing antibodies.
免疫応答のさまざまな側面と抗体の機能を決定するために、さまざまなタイプのアッセイを使用できます。テストは、結合抗体または中和抗体のいずれかを検出するために広く分類できます。
Binding antibody detection: These tests use purified proteins of SARS-CoV-2, not live virus, and can be performed in lower biosafety level laboratories (e.g., BSL-2). With specific reagents, individual antibody types, like IgG, IgM, and IgA, can be determined. In general, IgM is one of the first types of antibodies produced after infection and is most useful for determining recent infection, while IgG generally develops after IgM and may remain detectable for months or years. IgA is important for mucosal immunity and can be detected in mucous secretions like saliva in addition to blood, though its significance in this disease is still to be determined. Depending on the complexity of assays, these tests can be performed rapidly (less than 30 minutes) in a field setting or in a few hours in a laboratory.
Tests that detect binding antibodies fall into two broad categories.
結合抗体検出:これらのテストは、生ウイルスではなく、SARS-CoV-2の精製タンパク質を使用し、バイオセーフティレベルの低いラボ(BSL-2など)で実行できます。特定の試薬を使用すると、IgG、IgM、IgAなどの個々の抗体タイプを決定できます。一般に、IgMは感染後に生成される最初のタイプの抗体の1つであり、最近の感染を決定するのに最も役立ちますが、IgGは一般にIgMの後に発症し、数か月または数年間検出可能なままです。IgAは粘膜免疫に重要であり、血液に加えて唾液などの粘液分泌物でも検出できますが、この疾患におけるその重要性はまだ明らかにされていません。アッセイの複雑さに応じて、これらのテストはフィールド設定で、または実験室で数時間で迅速に(30分未満)実行できます。
結合抗体を検出するテストは、2つの広いカテゴリーに分類されます。
Point-of-care (POC) tests generally are lateral flow devices that detect IgG or IgG and IgM, or total antibody in serum, plasma, whole blood, and/or saliva. An advantage of some point-of-care tests using whole blood is that they can be performed on blood samples obtained by fingerstick rather than venipuncture.
ポイントオブケア(POC)テストは一般に、IgG、IgGおよびIgM、または血清、血漿、全血、唾液中の総抗体を検出する側方流動デバイスです。全血を使用するいくつかのポイントオブケア検査の利点は、静脈穿刺ではなく指先で採取した血液サンプルに対して実施できることです。
Laboratory tests use ELISA (Enzyme-Linked Immunosorbent Assay) or CIA (chemiluminescent immunoassay) methods for antibody detection, which for some assays may require trained laboratorians and specialized instruments. Based on the reagents, IgG, IgM, and IgA can be detected separately or combined as total antibody.
臨床検査では、抗体の検出にELISA(酵素免疫測定法)またはCIA(化学発光免疫測定法)を使用しますが、一部の測定法では、訓練を受けた研究者や専門の機器が必要になる場合があります。試薬に基づいて、IgG、IgM、およびIgAを個別に検出することも、総抗体として組み合わせて検出することもできます。
Neutralizing antibody detection: FDA has not yet authorized the use of neutralization tests for SARS-CoV-2. Neutralization tests determine the functional ability of antibodies to prevent infection of virus in vitro. The test involves incubating serum or plasma with live virus followed by infection and incubation of cells. Testing will require either BSL-3 or BSL-2 laboratories, depending on what form of the SARS-CoV-2 virus is used.
Two types of neutralization tests are conducted.
中和抗体検出:FDAは、SARS-CoV-2の中和試験の使用をまだ承認していません。中和試験は、インビトロでウイルスの感染を防ぐ抗体の機能的能力を決定します。テストでは、血清または血漿を生ウイルスとインキュベートし、その後感染させ、細胞をインキュベートします。テストには、使用されるSARS-CoV-2ウイルスの形式に応じて、BSL-3またはBSL-2のいずれかのラボが必要です。
2種類の中和試験が行われます。
Virus neutralization tests (VNT), such as the plaque-reduction neutralization test (PRNT) and microneutralization, use a SARS-CoV-2 virus from a clinical isolate or recombinant SARS-CoV-2 expressing reporter proteins. This testing requires BSL-3 laboratories and may take up to 5 days to complete.
Pseudovirus neutralization tests (pVNT) use recombinant pseudoviruses (like vesicular stomatitis virus, VSV) that incorporate the S protein of SARS-CoV-2. This testing can be performed in BSL-2 laboratories depending on the VSV strain used.
プラーク減少中和試験(PRNT)やマイクロ中和などのウイルス中和試験(VNT)では、臨床分離株または組換えSARS-CoV-2発現レポータータンパク質からのSARS-CoV-2ウイルスを使用します。このテストにはBSL-3ラボが必要であり、完了するまでに最大5日かかる場合があります。
疑似ウイルス中和テスト(pVNT)は、SARS-CoV-2のSタンパク質を組み込んだ(水疱性口内炎ウイルス、VSVなどの)組換え疑似ウイルスを使用します。この試験は、使用するVSV株に応じてBSL-2ラボで実施できます。
FDA-authorized serologic tests
FDA認可の血清学的検査
FDA now requires commercially marketed serologic tests to receive Emergency Use Authorization (EUA). Tests that are not commercially marketed do not require FDA authorization but developers may voluntarily request authorization. Multiple agencies — including FDA, the National Cancer Institute/National Institutes of Health (NCI/NIH), CDC, and the Biomedical Advanced Research and Development Authority (BARDA) — are collaborating with members of academia and the medical community to evaluate several serology tests using a well-characterized set of clinical samples (serum or plasma) collected before and during the current COVID-19 outbreak. A list of all tests authorized for emergency use under EUA is maintained on an FDA website.
FDAは現在、緊急使用許可(EUA)を受けるために市販の血清学的検査を要求しています。市販されていないテストはFDAの承認を必要としませんが、開発者は自発的に承認を要求できます。FDA、国立がん研究所/国立衛生研究所(NCI / NIH)、CDC、および生物医学高度研究開発局(BARDA)を含む複数の機関が、学界のメンバーや医学界と協力して、いくつかの血清学検査を評価しています。それらの血清学検査の評価には、現在のCOVID-19アウトブレイクの前および最中に収集された、十分に特徴付けられた臨床サンプル(血清または血漿)のセットを使用します。EUAの下で緊急使用が許可されているすべてのテストのリストは、FDAのWebサイトで管理されています。
All currently authorized tests are qualitative (providing a result that is positive, negative, or indeterminate) rather than quantitative (providing a quantitative assessment of antibody levels).
Both laboratory and rapid serologic assays have received EUA. Serologic testing technologies include single-use, low-throughput lateral flow tests where the presence of antibody is demonstrated by a color change on a paper strip and laboratory-based immunoassays that allow for processing of many samples at the same time.
The EUA letter of authorization includes the settings in which the test is authorized, based on FDA’s determination of appropriate settings for use during the public health emergency.
現在承認されているすべてのテストは、定量的(抗体レベルの定量的評価を提供)ではなく、定性的(陽性、陰性、または不確定の結果を提供)です。
実験室および迅速な血清学的アッセイの両方がEUAを受けています。血清学的検査技術には、使い捨ての低スループットのラテラルフローテストが含まれます。この検査では、抗体の存在が紙の色の変化によって示され、実験室ベースのイムノアッセイにより、同時に多くのサンプルを処理できます。
EUAの許可書には、公衆衛生上の緊急時に使用するためのFDAの適切な設定の決定に基づいて、テストが許可される設定が含まれています。
Optimizing Testing Outcomes
テスト結果の最適化
Test performance
テスト性能
The utility of tests depends on the sensitivity and specificity of the assays; these performance characteristics are determined by using a defined set of negative and positive samples. In addition, the predictive values of a test should be considered because these values affect the overall outcome of testing. Positive predictive value is the probability that individuals with positive test results are truly antibody positive. Negative predictive value is the probability that individuals with negative test results are truly antibody negative. Positive and negative predictive values are determined by the percentage of truly antibody positive individuals in the tested population (prevalence, pre-test probability) and the sensitivity and specificity of the test.
テストの有用性は、アッセイの感度と特異性に依存します。これらのパフォーマンス特性は、定義された一連のネガティブサンプルとポジティブサンプルを使用して決定されます。さらに、これらの値はテストの全体的な結果に影響を与えるため、テストの予測値を考慮する必要があります。陽性予測値(陽性適中度|positive predictive value)は、陽性のテスト結果を持つ個人が本当に抗体陽性である確率です。陰性予測値(negative predictive value)とは、検査結果が陰性の個人が真に抗体陰性である確率です。陽性と陰性の予測値は、テストされた母集団における真に抗体陽性の個人の割合(有病率、テスト前の確率)とテストの感度と特異度によって決定されます。
For example:
In a high-prevalence setting, the positive predictive value increases — meaning it is more likely that persons who test positive are truly antibody positive – than if the test is performed in a population with low-prevalence. When a test is used in a population where prevalence is low, the positive predictive value drops because there are more false-positive results, since the pre-test probability is low.
Likewise, negative predictive value is also affected by prevalence. In a high-prevalence setting, the negative predictive value declines whereas in a low-prevalence setting, it increases.
例えば:
有病率が高い環境では、陽性予測値(陽性適中度|positive predictive value)が増加します。つまり、陽性率が低い集団で試験を実施する場合よりも、陽性と判定された人が真に抗体陽性である可能性が高くなります。有病率が低い母集団でテストを使用すると、事前テストの確率が低いため、偽陽性の結果が多くなるため、陽性予測値(陽性適中度|positive predictive value)が低下します。
同様に、陰性予測値(negative predictive value)も有病率の影響を受けます。有病率が高い設定では陰性予測値(negative predictive value)は低下しますが、有病率が低い設定では増加します。
In most of the country, including areas that have been heavily impacted, the prevalence of SARS-CoV-2 antibody is expected to be low, ranging from <5% to 25%, so that testing at this point might result in relatively more false positive results and fewer false-negative results.
In some settings, such as COVID-19 outbreaks in food processing plants and congregate living facilities, the prevalence of infection in the population may be significantly higher. In such settings, serologic testing at appropriate intervals following outbreaks might result in relatively fewer false positive results and more false-negative results.
深刻な影響を受けている地域を含む国のほとんどで、SARS-CoV-2抗体の有病率は低く、5%未満から25%の範囲であると予想されているため、この時点でのテストは相対的により擬陽性の結果およびより偽陰性の結果をもたらす可能性があります。
食品加工工場や集合生活施設でのCOVID-19の発生など、一部の環境では、人口の感染率が大幅に高くなる可能性があります。このような状況では、発生後に適切な間隔で血清学的検査を行うと、偽陽性結果が比較的少なくなり、偽陰性結果が多くなる可能性があります。
Testing strategies
テスト戦略
In the current pandemic, maximizing specificity and thus positive predictive value in a serologic algorithm is preferred in most instances, since the overall prevalence of antibodies in most populations is likely low. For example, in a population where the prevalence is 5%, a test with 90% sensitivity and 95% specificity will yield a positive predictive value of 49%. In other words, less than half of those testing positive will truly have antibodies. Alternatively, the same test in a population with an antibody prevalence exceeding 52% will yield a positive predictive greater than 95%, meaning that less than one in 20 people testing positive will have a false positive test result.
現在のパンデミックでは、ほとんどの集団における抗体の全体的な有病率が低い可能性が高いため、血清学的アルゴリズムで特異性を最大化し、したがって血清学的アルゴリズムで陽性予測値(陽性適中度|positive predictive value)を最大化することがほとんどの場合推奨されます。たとえば、有病率が5%である集団では、90%の感度と95%の特異性を備えた検定では49%の陽性予測値(陽性適中度|positive predictive value)が得られます。言い換えれば、陽性と判定された者の半数以下が真に抗体を持つことになる。または、52%を超える抗体陽性率の集団で同じテストを行うと、95%を超える陽性予測が得られます。つまり、陽性と判定された20人に1人未満が偽陽性の検査結果になります。
Three strategies can be used to improve positive predictive value:
Choosing a test with a very high specificity, perhaps 99.5% or greater, will yield a high positive predictive value in populations tested with prevalence >5%.
Another strategy is to focus testing on persons with a high pre-test probability of having SARS-CoV-2 antibodies, such as persons with a history of COVID-19-like illness.
A third approach is to employ an orthogonal testing algorithm in which persons who initially test positive are tested with a second test. Effective orthogonal algorithms are generally based on testing a patient sample with two tests, each with unique design characteristics (e.g., antigens or formats).
陽性予測値(陽性適中度|positive predictive value)を改善するために3つの戦略を使用できます。
非常に高い特異性(おそらく99.5%以上)のテストを選択すると、有病率> 5%でテストされた母集団で陽性予測値(陽性適中度|positive predictive value)が得られます。
別の戦略は、COVID-19のような病気の病歴のある人など、SARS-CoV-2抗体を持っている可能性が高い検査前確率のある人に検査を集中させることです。
3番目のアプローチは、直交テストアルゴリズムを使用することです。このアルゴリズムでは、最初に陽性をテストした人が2番目のテストでテストされます。効果的な直交アルゴリズムは、通常、患者のサンプルを2つのテストでテストすることに基づいており、それぞれが独自の設計特性(抗原やフォーマットなど)を備えています。
Algorithms can be designed to maximize overall specificity while retaining maximum sensitivity. For example, in the example above with a population prevalence of 5%, a positive predictive value of 95% can be achieved if samples initially positive are tested with a second different orthogonal assay that also has 90% sensitivity and 95% specificity. The performance of orthogonal testing algorithms has not been systematically evaluated but can be estimated using an on-line calculator from the FDA. See Table 1 for the potential improvement benefits of the orthogonal testing algorithm.
アルゴリズムは、最大の感度を維持しながら、全体的な特異性を最大化するように設計できます。たとえば、母集団の有病率が5%の上記の例では、最初に陽性のサンプルが、90%の感度と95%の特異性を持つ2番目の異なる直交アッセイでテストされる場合、95%の陽性予測値(陽性適中度|positive predictive value)を達成できます。直交テストアルゴリズムのパフォーマンスは体系的に評価されていませんが、オンライン計算機(FDAから)を使用して推定できます。直交テストアルゴリズムの潜在的な改善の利点については、表1を参照してください。
An on-line calculator from the FDA
Table 1 補足資料
各セルの式の表示

有病率 2%|感度 90%|特異性 95%

有病率 5%|感度 90%|特異性 95%

有病率 10%|感度 90%|特異性 95%

有病率 30%|感度 90%|特異性 95%

有病率 5%|感度 90%|特異性 99.5%

有病率 52%|感度 90%|特異性 95%

Limitations of Serologic Tests
血清学的検査の制限
At present, the immunologic correlates of immunity from SARS-CoV-2 infection are not well defined. Representatives from BARDA, CDC, FDA, NIH, the Office of the Assistant Secretary for Health (OASH), Department of Defense (DoD), and White House Office of Science and Technology Policy (OSTP) are working with members of academia and the medical community to determine whether positive serologic tests are indicative of protective immunity against SARS-CoV-2. This work includes assessing the level of antibodies required for protection from reinfection, the duration of that protection, and the factors associated with development of a protective antibody response.
現在、SARS-CoV-2感染による免疫の免疫学的相関は明確に定義されていません。陽性の血清学的検査がSARS-CoV-2に対する防御免疫を示すかどうかを決定するために、BARDA、CDC、FDA、NIH、保健福祉省の保健担当次官補局(OASH:Office of the Assistant. Secretary for Health)、国防総省(DoD)、およびホワイトハウス科学技術政策局(OSTP)の代表者は、学界および医療機関コミュニティのメンバーと協力しています。この作業には、再感染からの防御に必要な抗体のレベル、その防御期間、および防御抗体反応の発生に関連する要因の評価が含まれます。
The kinetics of antibody response, longevity of antibodies, the ability of antibodies to protect from repeat infection, the protective titer of neutralizing antibody, and the correlation of binding antibody titers to neutralization ability are yet to be determined. Although animal challenge studies demonstrate protection in the short run, demonstration of long-term protection in humans will require future study. Hence, pending additional data, the presence of antibodies cannot be equated with an individual’s immunity from SARS-CoV-2 infection.
抗体反応の速度論、抗体の寿命、繰り返し感染から抗体を保護する能力、中和抗体の防御力価、中和抗体価と結合抗体価の相関はまだ決定されていません。動物チャレンジ研究は短期的には防御を実証しますが、人間における長期防御の実証は将来の研究を必要とするでしょう。したがって、追加データが出るまでの間、抗体の存在は、SARS-CoV-2感染に対する個人の免疫と同一視することはできません。
Some tests may exhibit cross-reactivity with other coronaviruses, such as those that cause the common cold. This could result in false-positive test results. Some persons may not develop detectable antibodies after coronavirus infection. In others, it is possible that antibody levels could wane over time to undetectable levels. IgM and IgG antibodies are not present early in infection. Thus, serologic test results do not indicate with certainty the presence or absence of current or previous infection with SARS-CoV-2.
一部のテストでは、一般的な風邪を引き起こすものなど、他のコロナウイルスとの交差反応を示す場合があります。これにより、偽陽性のテスト結果が生じる可能性があります。一部の人はコロナウイルス感染後に検出可能な抗体を開発しないかもしれません。他の場合では、抗体レベルが時間の経過とともに検出できないレベルに低下する可能性があります。IgMおよびIgG抗体は感染の初期には存在しません。したがって、血清学的検査結果は、SARS-CoV-2による現在または以前の感染の有無を確実に示すものではありません。
Recommendations for Use of Serologic Tests
血清学的検査の使用に関する推奨事項
Information that might impact serologic recommendations is rapidly evolving, particularly evidence of whether positive serologic tests indicate protective immunity or decreased transmissibility among those recently ill. These recommendations will be updated as new information becomes available.
血清学的推奨事項に影響を与える可能性のある情報、特に陽性の血清学的検査が防御免疫を示すか、最近病気になった人の間での感染性の低下を示すかどうかの証拠は急速に進化しています。これらの推奨事項は、新しい情報が利用可能になると更新されます。
Choice of test and testing strategy
テストとテスト戦略の選択
Serologic assays that have Emergency Use Authorization (EUA) are preferred for public health or clinical use since their test performance data have been reviewed by FDA.
Serologic test results should be interpreted in the context of the expected predictive values, positive and negative.
Positive predictive value should be optimized, particularly if results are returned to individuals, in the following ways: Currently, there is no substantive performance advantage of assays whether they test for IgG, IgM and IgG, or total antibody.
緊急使用許可(EUA)を備えた血清学的アッセイは、その試験成績データがFDAによって確認されているため、公衆衛生または臨床使用に適しています。
血清学的検査結果は、予想される予測値である陽性および陰性の文脈で解釈されるべきです。
陽性予測値(陽性適中度|positive predictive value)は、特に結果が個人に返される場合、次の方法で最適化する必要があります。
Assure a high positive predictive value (e.g., 95%) by choosing tests with sufficiently high specificity and testing persons or populations with a high pre-test probability of having antibodies (e.g., persons with a history of symptoms compatible with COVID-19 or who are exposed to areas or institutions experiencing outbreaks),
OR
If a high positive predictive value cannot be assured with a single test, use an orthogonal testing algorithm. See Table 1 for examples of using one or two tests in populations with various prevalences of SARS-CoV-2 antibodies.
十分に高い特異性を備えた検査を選択し、抗体を有する検査前確率が高い人物または集団(COVID-19と互換性のある症状の既往歴のある人物またはアウトブレイクを経験している地域または施設にさらされている人)を検査することにより、高い陽性予測値(陽性適中度|positive predictive value)(95%など)を保証する。
または
単一のテストで高い陽性予測値(陽性適中度|positive predictive value)を保証できない場合は、直交テストアルゴリズムを使用します。SARS-CoV-2抗体のさまざまな有病率の集団で1つまたは2つのテストを使用する例については、表1を参照してください。
Currently, there is no substantive performance advantage of assays whether they test for IgG, IgM and IgG, or total antibody.
Thus, immunoglobulin class should not determine the assay chosen in most circumstances. The detection of IgM antibodies may indicate a more recent infection, but the dynamics of the IgM antibody response are not well defined at present. Over time, it may be important to characterize and evaluate the performance of assays in samples that are IgM negative and IgG positive to ensure that assays remain fit for purpose in population studies as the pandemic progresses and more individuals are expected to have lower IgM levels.
Serologic testing should not be used to determine immune status in individuals until the presence, durability, and duration of immunity is established.
現在、IgG、IgMおよびIgG、または総抗体のいずれを検査しても、アッセイの実質的な性能上の優位性はありません。したがって、免疫グロブリンのクラスは、ほとんどの状況で選択されるアッセイによって決定すべきではありません。IgM抗体の検出は、より最近の感染を示している可能性がありますが、IgM抗体反応のダイナミクスは、現時点では十分に定義されていません。時間の経過とともに、IgM陰性およびIgG陽性のサンプルにおけるアッセイの性能を特徴付けて評価し、パンデミックが進行し、IgMレベルが低下すると予想される個人が増えるにつれて、アッセイが集団研究の目的に適したままであることを確認することが重要になる場合があります。
血清学的検査は、免疫の存在、持続性、および持続期間が確立されるまで、個人の免疫状態を決定するために使用されるべきではありません。
Serologic testing can be offered as a method to support diagnosis of acute COVID-19 illness for persons who present late. For persons who present 9-14 days after illness onset, serologic testing can be offered in addition to recommended direct detection methods such as polymerase chain reaction. This will maximize sensitivity as the sensitivity of nucleic acid detection is decreasing and serologic testing is increasing during this time period.
Serologic testing should be offered as a method to help establish a diagnosis when patients present with late complications of COVID-19 illness, such as multisystem inflammatory syndrome in children.
血清学的検査は、急性COVID-19疾患の発生を遅れて診断するサポートをする方法として提供できます。発症後9〜14日の人は、推奨されるポリメラーゼ連鎖反応のような直接検出方法に加えて、血清学的検査を提供できます。この期間中、核酸検出の感度が低下し、血清学的検査が増加するため、これにより感度が最大になります。
血清学的検査は、患者がCOVID-19疾患の晩期合併症(小児の多系統炎症性症候群など)を発症したときに診断を確立するのに役立つ方法として提供する必要があります。
Recommendations for persons who test positive for anti-SARS-CoV-2 antibodies
抗SARS-CoV-2抗体が陽性であると診断された人への推奨
Although the presence of anti-SARS-CoV-2 antibodies when detected using a testing algorithm with high positive predictive value for the context of use likely indicates at least some degree of immunity, until the durability and duration of immunity is established, it cannot be assumed that individuals with truly positive antibody test results are protected from future infection.
使用の文脈において、高い陽性予測値(陽性適中度|positive predictive value)を持つテストアルゴリズムを使用して検出された場合、抗SARS-CoV-2抗体の存在は、少なくともある程度の免疫を示している可能性を示唆しますが、免疫の耐久性と持続時間が確立されるまでは、抗体検査結果が真に陽性である個人が将来の感染から防御されていることは想定できません。
Asymptomatic persons who test positive by serologic testing and who are without recent history of a COVID-19 compatible illness have a low likelihood of active infection and should follow general recommendations to prevent infection with SARS-CoV-2 and otherwise continue with normal activities, including work.
血清学的検査で陽性と診断され、COVID-19適合性疾患の最近の病歴がない無症状の人は、活動性感染の可能性が低い。彼らは、SARS-CoV-2による感染を防ぐための一般的な推奨事項に従うか、もしくは、作業を含む通常の活動を継続するべきです。
Persons who have had a COVID-19-compatible or confirmed illness should follow previous guidance regarding resumption of normal activities, including work.
There should be no change in clinical practice or use of personal protective equipment (PPE) by health care workers and first responders who test positive for SARS-CoV-2 antibody.
COVID-19と互換性があるか、病気が確認されている人は、仕事を含む通常の活動の再開に関する以前のガイダンスに従ってください。
SARS-CoV-2抗体の検査で陽性であった医療従事者であるファーストレスポンダーによる臨床診療または個人用保護具(PPE)の使用に変更はありません。
Additional considerations on the use of serologic tests
血清学的検査の使用に関する追加の考慮事項
Serologic test results should not be used to make decisions about grouping persons residing in or being admitted to congregate settings, such as schools, dormitories, or correctional facilities.
血清学的検査結果を使用して、学校、寮、矯正施設などに居住している、または集まった環境に収容されている人をグループ化することについての決定を下すべきではありません。
Serologic test results should not be used to make decisions about returning persons to the workplace.
Until more information is available about the dynamics of IgA detection in serum, testing for IgA antibodies is not recommended.
血清学的検査結果は、職場への復帰を決定するために使用すべきではありません。
血清中のIgA検出のダイナミクスに関する詳細情報が利用可能になるまで、IgA抗体のテストは推奨されません。
* Detection of specific antibody in serum, plasma, or whole blood that indicates new or recent infection provides presumptive laboratory evidence of COVID-19 illness according to the Council of State and Territorial Epidemiologists (CSTE) interim case definition for COVID-19pdf iconexternal icon.
*新たな感染または最近の感染を示す、血清、血漿、または全血中の特異的抗体の検出により、国会議員および領土疫学者(CSTE)によるCOVID-19の暫定症例定義に従って、COVID-19疾患の推定検査室証拠が提供されます。
Council of State and Territorial Epidemiologists (CSTE) interim case definition for COVID-19.
https://www.aphl.org/programs/preparedness/crisis-management/documents/serologic-Testing-for-COVID-19.pdf
Additional Resources
追加のリソース
American Medical Association. Serological Testing for SARS-CoV-2 Antibodies.
アメリカ医師会。SARS-CoV-2抗体の血清学的検査
https://www.ama-assn.org/delivering-care/public-health/serological-testing-sars-cov-2-antibodies
Infectious Diseases Society of America. IDSA COVID19 Antibody Testing Primer.
アメリカ感染症学会。IDSA COVID19抗体検査プライマー。PDF
Association of Public Health Laboratories and Council of State and Territorial Epidemiologists. Public Health Considerations: Serologic Testing for COVID-19. Version 1-May 7, 2020.
公衆衛生研究所と州評議会および領土疫学者協会。公衆衛生の考慮事項:COVID-19の血清学的検査。バージョン1-2020年5月7日。PDF
Table 1: Predictive value positive using one test or two orthogonal tests, by the background prevalence in the population tested.
表1:1つのテストまたは2つの直交テストを使用した予測値陽性、テストされた母集団のバックグラウンド有病率別

PPV =ポジティブな予測値
SE =感度
SP =特異度
Source: https://www.cdc.gov/coronavirus/2019-ncov/lab/resources/antibody-tests-guidelines.html
Table 1 補足資料
Sensitivity = 90%, Specificity = 95%

Sensitivity = 90%, Specificity = 99.5%
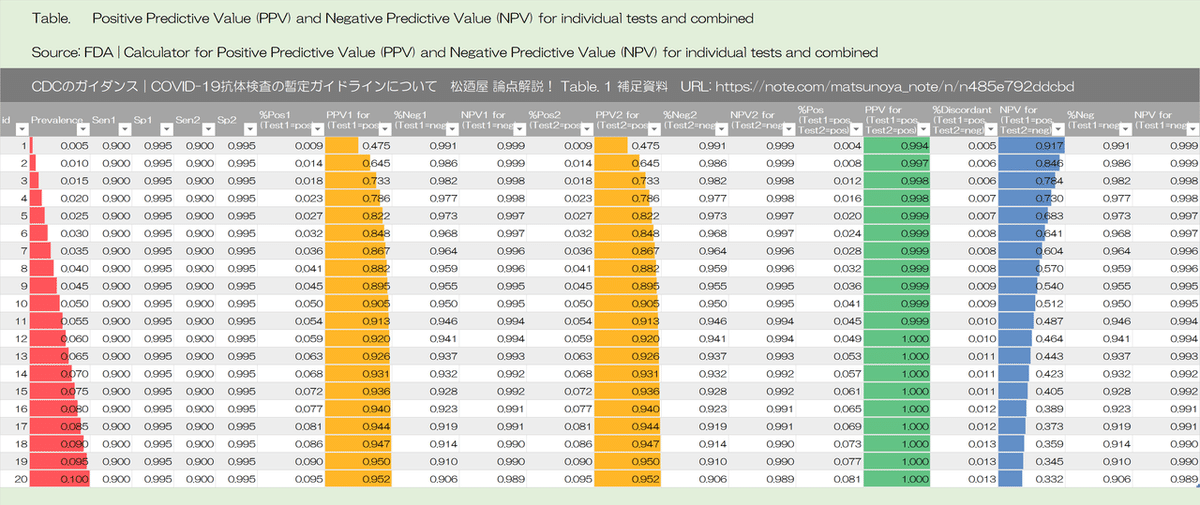
Sensitivity = 90%, Specificity = 90% - 99%

Sensitivity = 90% - 99%, Specificity = 95%
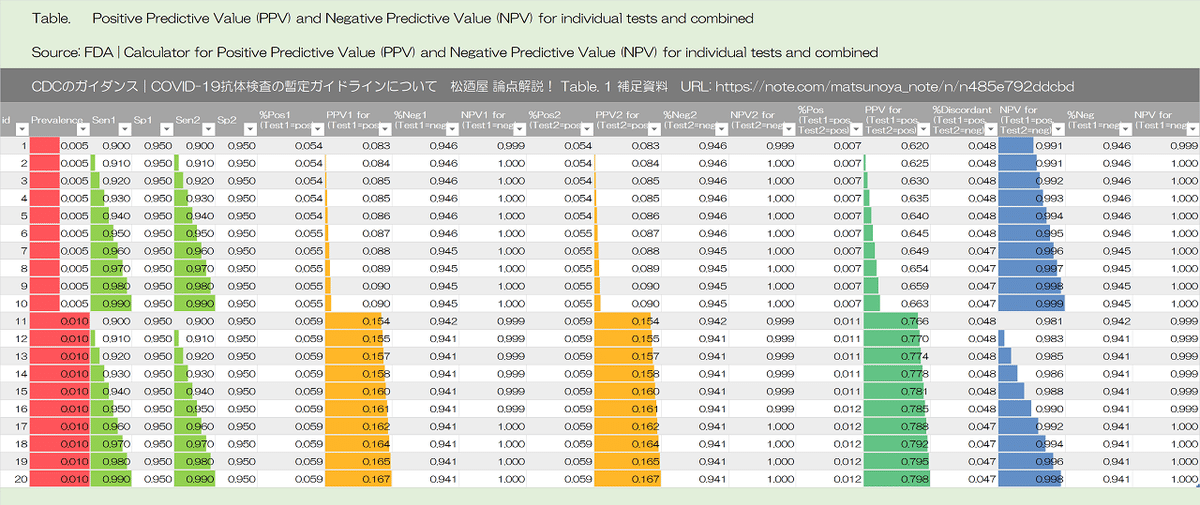
Sensitivity = 90% - 99%, Specificity = 99.5%

いかがでしたか?
出典原文には必要なリンクなども入っています。ここで学習したら、直接サイトへいって、原文ままで読んで、理解して考えてみましょう。
参考資料|
CDC | Interim Guidelines for COVID-19 Antibody Testing in Clinical and Public Health Settings
https://www.cdc.gov/coronavirus/2019-ncov/lab/resources/antibody-tests-guidelines.html
関連する話題|
FDA | EUA Authorized Serology Test Performance
EUA認定の血清学テストのパフォーマンス
各メーカーの各抗体検査キットの感度・特異性、有病率5%の場合のパフォーマンス見積もりなどはこちらです。医師、薬剤師 の皆さま、必読です。
一部抜粋して、対訳を掲載します。
以下、一部抜粋と対訳。
EUA Authorized Serology Test Performance
EUA認定の血清学テストのパフォーマンス
About this page
このページについて
Serology tests detect the presence of antibodies in the blood when the body is responding to a specific infection, like COVID-19. In other words, the tests detect the body's adaptive immune response to the infection caused by the virus rather than detecting the virus itself. In the early days of an infection when the body's adaptive immune response is still building, antibodies may not be detected. This limits the test's effectiveness for diagnosing COVID-19, and this is one reason serology tests should not be used as the sole basis to diagnose COVID-19. Serology tests could play a role in the fight against COVID-19 by helping healthcare professionals identify individuals have developed an adaptive immune response to SARS-CoV-2. In addition,
血清学検査は、COVID-19のような特定の感染に身体が反応しているときに、血液中の抗体の存在を検出します。言い換えれば、テストはウイルス自体を検出するのではなく、ウイルスによって引き起こされた感染に対する身体の適応免疫応答を検出します。体の適応免疫応答がまだ構築されている感染の初期には、抗体が検出されない場合があります。これは、COVID-19を診断するためのテストの有効性を制限します。これは、COVID-19を診断するための唯一の基礎として血清学テストを使用してはならない1つの理由です。血清学検査は、医療専門家がSARS-CoV-2に対する適応免疫応答を発症したことを特定するのを支援することにより、COVID-19との戦いに役割を果たす可能性があります。加えて、
these test results can aid in determining who may donate a part of their blood called convalescent plasma, which may serve as a possible treatment for those who are seriously ill from COVID-19. However, to use these tests properly, it is important to understand their performance characteristics and limitations. Moreover, studies are underway to address questions that will better inform the appropriate use of these tests, such as whether the presence of antibodies conveys a level of immunity that would prevent or minimize the severity of re-infection as well as the duration for which immunity lasts.
これらのテスト結果は、回復期血漿と呼ばれる血液の一部を寄付する可能性のある人を決定するのに役立ちます。これは、COVID-19で重篤な病気を患っている人の治療の可能性があります。ただし、これらのテストを適切に使用するには、それらのパフォーマンス特性と制限を理解することが重要です。さらに、抗体の存在が再感染の重症度を防止または最小化する免疫レベルと免疫の持続期間に繋がるかどうかなど、これらのテストの適切な使用をよりよく知らせる質問に対処するための研究が進行中です。
The performance of these tests is described by their "sensitivity," or their ability to identify those with antibodies to SARS-CoV-2 (true positive rate), and their "specificity," or their ability to identify those without antibodies to SARS-CoV-2 (true negative rate). A test's sensitivity can be estimated by determining whether or not it is able to detect antibodies in blood samples from patients who have been confirmed to have COVID-19 with a nucleic acid amplification test, or NAAT. In some validation studies of these tests, like the one FDA is conducting in partnership with NIH, CDC, and BARDA, the samples used, in addition to coming from patients confirmed to have COVID-19 by a NAAT, may also be confirmed to have antibodies present using other serology tests.
これらのテストのパフォーマンスは、「感度」、またはSARS-CoV-2に対する抗体を持つものを識別する能力(真陽性率)、またはSARSCoV-2に対する抗体がないものを識別する能力(真の陰性率)、および「特異性」、によって説明されます。検査の感度は、核酸増幅検査またはNAATでCOVID-19が確認されている患者からの血液サンプルで抗体を検出できるかどうかを判断することによって推定できます。これらのテストの一部の検証研究では、FDAがNIH、CDC、およびBARDAと共同で実施しているように、使用されるサンプルは、NAATによってCOVID-19であることが確認された患者からのものであるのに加えて、他の血清学テストを使用して抗体が存在することを確認するかもしれない。
A test's specificity can be estimated by testing large numbers of samples collected and frozen before SARS-CoV-2 is known to have circulated to demonstrate that the test does not produce positive results in response to the presence of other causes of a respiratory infection, such as other coronaviruses.
These estimates of sensitivity and specificity are just that: estimates. They include 95% confidence intervals, which are the range of estimates we are about 95% sure a test's sensitivity and specificity will fall within given how many samples were used in the performance validation.
テストの特異性は、SARS-CoV-2が循環していることが判明する前に収集および凍結された多数のサンプルをテストすることで推定できます。これにより、テストが他の 他のコロナウイルスのような呼吸器感染症の原因の存在に対応して陽性結果をもたらさないことが実証されます。
これらの感度と特異度の推定は、単なる推定です。これらには95%の信頼区間が含まれます。これは、パフォーマンス検証で使用されたサンプルの数を考えると、テストの感度と特異度が約95%以内に収まると推定される推定の範囲です。
The more samples used to validate a test, the smaller the confidence interval becomes, meaning that we can be more confident in the estimates of sensitivity and specificity provided.
Tests are also described by their Positive and Negative Predictive values (PPV and NPV). These measures are calculated using a test's sensitivity, its specificity, and using an assumption about the percentage of individuals in the population who have antibodies to SARS-CoV-2 (which is called "prevalence" in these calculations).
テストの検証に使用するサンプルが多いほど、信頼区間は小さくなり、提供される感度と特異度の推定値に自信を持つことができます。
テストは、陽性予測値(陽性適中度|positive predictive value)および陰性予測値(negative predictive value)(PPVおよびNPV)によっても記述されます。これらの測定値は、テストの感度、その特異性、およびSARS-CoV-2に対する抗体を持つ集団の個体の割合に関する仮定(これらの計算では「有病率」と呼ばれます)を使用して計算されます。
Every test returns some false positive and false negative results. The PPV and NPV help those who are interpreting these tests understand, given how prevalent individuals with antibodies are in a population, how likely it is that a person who receives a positive result from a test truly does have antibodies to SARS-CoV-2 and how likely it is that a person who receives a negative result from a test truly does not have antibodies to SARS-CoV-2.
すべてのテストは、いくつかの偽陽性と偽陰性の結果を返します。PPVとNPVは、抗体を持つ流行している個人が集団内にどの程度いるか、テストから陽性結果を受け取った人が本当にSARS-CoV-2に対する抗体を持っている可能性がどれほど高いか、また、テストで陰性の結果を受け取った人が本当にSARS-CoV-2に対する抗体を持っていない可能性はどのくらいあるかを、これらのテストを解釈している人々が理解するのに役立ちます。
The PPV and NPV of a test depend heavily on the prevalence of what that test is intended to detect. Because all tests will return some false positive and some false negative results, including tests that detect antibodies to SARS-CoV-2, broad use of the tests, when not appropriately informed by other relevant information, such as clinical history or diagnostic test results, could identify too many false-positive individuals.
We do not currently know the prevalence of SARS-CoV-2 antibody positive individuals in the U.S. population, and prevalence may change based on the duration the virus is in the country and the effectiveness of mitigations.
試験テストのPPVとNPVは、そのテストが検出することを意図しているものの有病率に大きく依存します。SARS-CoV-2に対する抗体を検出するテストを含むすべてのテストはいくつかの偽陽性およびいくつかの偽陰性の結果を返すため、臨床歴や診断テスト結果などの他の関連情報によって適切に事実が与えられない場合、テストの幅広い使用は、あまりにも多くの偽陽性の個人を識別するかもしれないです。
現在のところ、米国の人口におけるSARS-CoV-2抗体陽性の個人の有病率は不明であり、有病率は、ウイルスが国内にいる期間と緩和策の有効性に基づいて変化する可能性があります。
Moreover, prevalence may vary widely between locations and between different groups of people, such as health care workers, due to different rates of infection. In low prevalence populations, which will be much of the asymptomatic general population, the result of a single antibody test is not likely to be sufficiently accurate to make an informed decision regarding whether or not an individual has had a prior infection or truly has antibodies to the virus. A second test, typically one assessing for the presence of antibodies to a different viral protein, generally would be needed to increase the accuracy of the overall testing results.
さらに、感染率が異なるため、有病率は場所によって、また医療従事者などの人々のグループによって大きく異なる場合があります。無症候性が多い一般的な集団である低い有病率の集団では、単一の抗体検査の結果は、個人が以前に感染したか、または本当にウイルスに対する抗体を持っているかどうかに関する情報に基づいた決定をするのに十分正確ではない可能性があります。2番目のテストは、通常、別のウイルスタンパク質に対する抗体の存在を評価するテストであり、テスト結果全体の精度を上げるために一般的に必要になります。
For this page, FDA has summarized the expected performance of the tests it has authorized based on the information FDA reviewed when deciding whether or not to grant these tests an Emergency Use Authorization and assuming a prevalence of 5% for PPV and NPV calculations. For tests that had multiple validation studies or where the tests showed variable performance in samples collected at different times after symptom onset, FDA experts selected the results they considered to be most representative of expected test performance. This is an incomplete representation of the performance of these tests.
このページでは、FDAは、これらのテストに緊急使用許可を付与するかどうかを決定する際にFDAが確認した情報に基づいて、承認したテストの予想されるパフォーマンスを要約し、PPVおよびNPV計算の有病率を5%と想定しています。複数の検証研究が行われたテスト、または症状の発症後の異なる時間に収集されたサンプルでテストのパフォーマンスが変動するテストの場合、FDAの専門家は、期待されるテストパフォーマンスの最も代表的なものと見なした結果を選択しました。これは、これらのテストのパフォーマンスの不完全な表現です。
Always refer to the complete instructions for use to put these estimates into the proper context and to understand how to use and interpret these tests. FDA also is providing a calculator that will allow users to see the estimated performance of a single test or two independent tests based on their performance characteristics and the estimated prevalence of SARS-CoV-2 antibodies in the target population.
これらの見積もりを適切な文脈に入れ、これらのテストを使用および解釈する方法を理解するには、使用するための完全な指示を常に参照してください。FDAは計算機も提供しています。これにより、ユーザーは、パフォーマンス特性とターゲット母集団におけるSARS-CoV-2抗体の推定有病率に基づいて、単一のテストまたは2つの独立したテストの推定パフォーマンスを確認できます。
__________
YouTube|Playlist
CDC|COVID-19抗体検査の暫定ガイドラインについて 松廼屋 論点解説!
https://www.youtube.com/playlist?list=PLuPATLvMiAKr837gvcz2P761e2yW7AlF6
※Twitterで使用した動画を YouTube 再生リストですべてご覧になる場合は、こちらからどうぞ。
©2020 松廼屋 Mats.theBASE All rights reserved.
松廼屋 論点解説!
https://note.com/matsunoya_note
いかがでしたか?
サポートする 👉
note ヘルプセンター|無料記事をオススメする
|
note ヘルプセンター|領収書を発行する
ご参考になれば幸いです。
様々なお問い合わせ、エクセルデータベース・ピボットテーブルおよびグラフでの「見える化」や図表の制作およびご提供のご依頼などはこちらからどうぞ。
お問合せ|
松廼屋 Mats.theBASE
https://matsunoya.thebase.in/
CONTACT https://thebase.in/inquiry/matsunoya
授業や補習等で、グループや担当教官の方がeラーニング教材および解説コンテンツを含む資材を活用するご希望があれば、CONTACTからお問い合わせください。代理店等は置いておりません。直接、松廼屋 Mats.theBASEのサイトからお問い合わせを承ります。
わかりやすい論点解説動画や最新の科学的根拠へのリンク、科学的根拠に基づくポイントのまとめ、オリジナルの美しいグラフ等でサクッと学べる eラーニング教材をご提供いたします。
このCONTENTSを含む松廼屋 Mats.theBASEのコンテンツは、全て、eラーニング教材をご購入する可能性のあるお客様に提供する「商品の品質や内容を知っていただくことを目的とした情報開示およびサービス」です。転用・複製等の著作権違反行為は禁止されていますので、ご遠慮ください。
このコンテンツの制作者|
滝沢 幸穂
PhD (Pharmacokinetics)
MOS(Microsoft Office Specialist)
https://www.facebook.com/Yukiho.Takizawa
お疲れ様でした。
いかがでしたか?
☕🍰
またのご利用をお待ちしております。
ご意見ご感想などお寄せくださると励みになりうれしいです。
https://note.com/matsunoya_note
お仕事のご依頼はこちらからどうぞ
お問合せ|
松廼屋 Mats.theBASE
https://matsunoya.thebase.in/
CONTACT https://thebase.in/inquiry/matsunoya
Mail info_01.matsunoya@vesta.ocn.ne.jp
授業や補習等で、グループや担当教官の方がeラーニング教材および解説コンテンツを含む資材を活用するご希望があれば、CONTACTからお問い合わせください。代理店等は置いておりません。直接、松廼屋 Mats.theBASEのサイトからお問い合わせを承ります。
お友達や知り合いに、matsunota_note で学習したeラーニングを勧めてみたい方は、いいね!、口コミ、おススメなど、よろしくお願いします!
note での学習コンテンツを増やしていきたいと思っています。
医療、健康分野のリカレント教育における「最強コンテンツ」を note コミュニティで誰でもいつでも学習できる、
note matsunoya_note
https://note.com/matsunoya_note
はそんな場にしたい。
あなたのサポートがあれば、それは可能です。
サポート感謝します!
滝沢
楽しく!驚くほど効率的に。
※以上のコンテンツの著作権は、松廼屋にあります。
業務上の無断使用および複写・配布などはご遠慮ください。
当コンテンツの著作権に抵触する行為は、お断りします。
👉Twitter @Mats_blnt_pharm
https://twitter.com/Mats_blnt_pharm
新型コロナウイルス感染症の抗体検査について検査結果を科学的に正しく理解し規制等として正しく運用するにはとても参考になる資料だと思う🙂
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) May 27, 2020
CDC | Interim Guidelines for COVID-19 Antibody Testing in Clinical and Public Health Settingshttps://t.co/dNUObxZVc9
👆原文まま読むことをおススメ https://t.co/Bv9OHdlvAY
|
FDA がEUA認定した抗体検査キットのパフォーマンス一覧
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) May 27, 2020
👇これも考察の参考になる資料です。
FDA | EUA Authorized Serology Test Performancehttps://t.co/OjOX474EWE
各メーカーの各抗体検査キットの感度・特異性、有病率5%の場合のパフォーマンス見積もりなど#医師 #薬剤師 の皆さま、必読🙂
|
新しい #note を書きました。今日、Twitter でツイートしていた openFDA API のサクッとしたご紹介です🙂
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) June 6, 2020
速報|openFDA API "Independent Evaluations of COVID-19 Serological Tests" を FDA がシェア #松廼屋 論点解説!https://t.co/5dpOgwH59x
matsunoya #note @Mats_blnt_pharm #医療従事者
|
e-ラーニングの『松廼屋 Mats.theBASE』
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) May 27, 2020
YouTube Playlist🙂
👉 https://t.co/eaEymXXjTs
YouTube Playlist
☑薬剤師国家試験対策ノート
👉 https://t.co/EdlIcW1PrX#薬剤師国家試験対策 #薬剤師国家試験 #薬剤師 #薬学生#eラーニング #松廼屋 @Mats_blnt_pharm
|
マガジンをお気に入りに登録♪
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) May 26, 2020
薬剤師国家試験対策ノート on note|matsunoya
👉 https://t.co/a9LjZAwzMN#松廼屋|論点解説 薬剤師国家試験対策ノート問102-127【衛生】論点:感染症法/類型|https://t.co/092GnVpeXb
matsunoya_note #note @Mats_blnt_pharm
|
https://t.co/xEP3CSoxBz
— MATSUNOYA.BlNt.Pharm (@Mats_blnt_pharm) December 20, 2019
PowerPoint Template 有料コンテンツ販売を開始https://t.co/wLE5Q0QRTs
ITEMhttps://t.co/o2A1Wp8Bae#松廼屋 Mats.theBASE
ITEMhttps://t.co/GiM3w9jFtR
パワーポイント テンプレートファイルを #note からダウンロード🍀
Cool なプレゼンならコレ👉#500円😃#パワポ https://t.co/oQNwfmjqRj
|
👉松廼屋 Mats.theBASE
https://matsunoya.thebase.in/
Here: https://note.com/matsunoya_note/n/n485e792ddcbd
関連する note|
速報|openFDA API "Independent Evaluations of COVID-19 Serological Tests" を FDA がシェア 松廼屋 論点解説!
https://note.com/matsunoya_note/n/n2159d90d0ad2
©2020 松廼屋 Mats.theBASE All rights reserved.
マガジン|薬剤師国家試験対策ノート on note
https://note.com/matsunoya_note/m/m5863f5f6c903
ここから先は

マガジン matsunoya excel と matsunoya powerpoint のコンテンツのうち、新型コロナウイルス感染症 CO…
医療、健康分野のリカレント教育における「最強コンテンツ」を note で誰でもいつでも学習できる、 https://note.com/matsunoya_note はそんな場にしたい。あなたのサポートがあれば、それは可能です。サポート感謝します!松廼屋 matsunoya
