
179)メラトニンはミトコンドリアを増やして心不全とサルコペニアを予防する
体がみるみる若返るミトコンドリア活性化術179
ミトコンドリアを活性化して体を若返らせる医薬品やサプリメントを解説しています。
【加齢に伴うミトコンドリア機能の低下が様々な病気を引き起こす】
加齢によって全身筋肉量と筋力が低下し運動機能が低下します。この状態をサルコペニア(加齢性筋肉減弱現象)と言います。さらに、加齢とともに心身の活力(運動機能や認知機能等)が低下した「虚弱」な状態をフレイルと言います。
近年、サルコペニアやフレイルという老化現象や、様々な老化性疾患の発症に、ミトコンドリア機能の低下の関与が重要視されています。筋肉やその他の組織のミトコンドリアの量や機能の低下が、組織や臓器の機能低下の原因になっているからです。
糖尿病やメタボリック症候群、神経変性疾患、循環器疾患、がんなど多くの疾患の発症がミトコンドリアの機能障害との関連が強いことが明らかになっています。
健康的な加齢、老化関連疾患の予防、長寿達成のためには、ミトコンドリアの品質と機能を高めることが最も重要と言えます。

【ミトコンドリアは自分で若返っている】
自動車が故障して止まったり、車体に傷をつけた場合、人間が修理しなければ元の状態に戻れません。
しかし、生き物は、傷ついたり病気になっても、自分で元の状態に治すことができます。骨折したり、怪我をしても、その傷は時間が経つと自然に治ります。生き物には、再生力や回復力や治癒力があるからです。
細胞は、自分で若返らせるようなこともやっています。例えば、ダメージを受けたり古くなったミトコンドリアを廃棄し、新しいミトコンドリアを増やすことによって、細胞内のミトコンドリアを若返らせています。
ミトコンドリアの完全性を維持し、正常なミトコンドリア機能を確保するために、細胞内ではミトコンドリアの品質を管理するメカニズムが存在します。細胞に備わったミトコンドリア品質管理システムを利用して、ミトコンドリアの正常な機能を回復させ、損傷したミトコンドリアの構成要素を排除および交換することにより、ミトコンドリアの機能を正常化させ、病的な細胞を正常に戻すことができます。

【古くなったミトコンドリアはオートファジーで除去される】
オートファジー (Autophagy) は細胞内タンパクや小器官を二重の脂質膜で包み込み、これをリソソームに輸送して分解する仕組みです。「auto-」はギリシャ語の「自分自身」を表す接頭語で「phagy」は「食べること」の意で、「自食(じしょく)」と日本語訳されています。
細胞質に隔離膜と呼ばれる扁平な小胞が現れ、膜は細胞質内の異常タンパク質や細胞内小器官を取り込みながら伸長し、先端どうしが融合して、オートファゴソームが形成されます。 オートファゴソームがリソソームと融合して内包物は分解されます。自己消化で得られたアミノ酸は栄養源として再利用されます(図)。

細胞は栄養飢餓に陥るとオートファジーにより細胞質内のタンパク質や小器官(ミトコンドリアや小胞体など)の一部を分解および再利用し、細胞の生存に必要なエネルギーやアミノ酸を得ています。
さらに、オートファジーを使い老廃物や損傷したミトコンドリア、病原体、異常タンパク質を除去しており、それにより神経変性疾患、がん、糖尿病、心不全、各種の炎症や感染症など、さまざまな疾患の発症を抑制していることが明らかになっています。つまり、オートファジーは細胞内の老化した成分を除去して細胞を若返らせる作用があります。
オートファジーの機序でミトコンドリアを分解することをミトファジーと言います。カロリー制限や絶食はミトファジーを亢進して異常なミトコンドリアの除去を亢進します。ポリアミンの一種のスペルミジンには、オートファジーを誘導して細胞を若返らせる作用が報告されています。
【ミトコンドリアは増やすことができる】
細胞内でミトコンドリアが新しく生じることをミトコンドリア新生 (Mitochondrial biogenesis)と言います。
ダメージを受けて機能異常を起こしたミトコンドリアは、ミトコンドリアに特異的なオートファジーによる除去システムのミトファジー(mitophagy)によって分解され、新しいミトコンドリアがミトコンドリア新生(mitochondrial biogenesis)によって作られます。
このようなミトファジーとミトコンドリア新生のバランスによってミトコンドリアの品質が決まります。これは、ミトコンドリアの品質を良くすることも可能であることを意味します。

AMP活性化プロテインキナーゼ(AMPK)はミトファジー(ミトコンドリアの分解)を誘導し、ミトコンドリア新生を促進します。AMPKを活性化する薬として糖尿病治療薬のメトホルミンやブルーベリーに含まれるプテロスチルベンがあります。
つまり、メトホルミンやプテロスチルベンはミトコンドリアの品質を良くする効果が期待できます。運動やカロリー制限やケトン食や魚油もAMPKを活性化します。
ミトコンドリア新生で最も重要な働きを担っているのが、PGC-1α(Peroxisome Proliferative activated receptor gamma coactivator-1α)です。日本語訳は「ペルオキシソーム増殖因子活性化受容体γコアクチベーター1α」です。PGC-1αは転写因子のPPAR-γと結合して、PPAR-γの転写活性を高める因子として見つかりました。
PGC-1αは核内受容体を中心とするさまざまな転写因子と結合し標的遺伝子の発現を制御する転写コアクチベーターです。骨格筋、心筋、脂肪、脳などの臓器においてミトコンドリアの生合成および酸化的リン酸化を促進するなど細胞のエネルギー産生を制御する役割が知られています。
運動すると骨格筋のPGC-1α量が増えます。運動や絶食やメトホルミンがAMP活性化プロテインキナーゼ(AMPK)を活性化し、AMPKはサーチュインを活性化して転写因子のPGC-1αとFOXOファミリータンパク質を活性化し、ミトコンドリア機能や代謝を制御することが知られています(下図)。
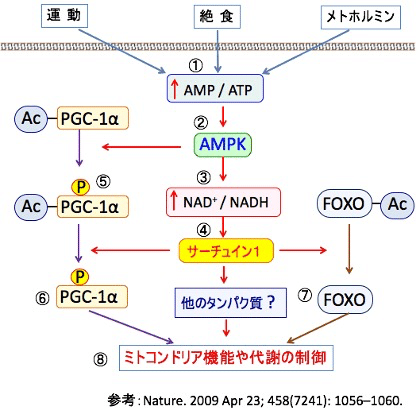
【PGC-1αを活性化するとミトコンドリアが増える】
細胞内のミトコンドリアの増殖を刺激することによって、細胞内のミトコンドリアの数と量を増やすことができます。
その方法として、ペルオキシソーム増殖因子活性化受容体(PPAR)のリガンド(ベザフィブラート、ドコサヘキサエン酸など)、AMPプロテインキナーゼ(AMPK)を活性化するメトホルミン、カロリー制限、ケトン体のβヒドロキシ酪酸などが報告されています。
ミトコンドリアが増えることを「ミトコンドリア新生」や「ミトコンドリア発生」と呼んでいます。細胞内でミトコンドリアが新しく発生することです。通常、既存のミトコンドリアが増大して分かれて増えていきます。
前述のように、ミトコンドリア新生で最も重要な働きを担っているのが、PGC-1αです。PPARのリガンド(ベザフィブラート、ドコサヘキサエン酸など)やメトホルミンやカロリー制限やβヒドロキシ酪酸はこのPGC-1αを活性化する作用があります(下図)。

【メラトニンはミトコンドリアを酸化障害から保護する】
メラトニンは主に松果体から分泌されるホルモンで、睡眠覚醒サイクルなどの日内リズムの調節に重要な役割を果たしています。
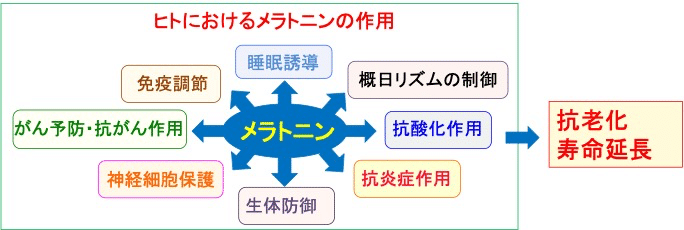
メラトニンは、ヒトにおいて、睡眠誘導や概日リズムの制御、抗酸化作用、抗炎症作用、免疫調節、生体防御、神経細胞保護、発がん予防やがん細胞の増殖抑制作用など多彩な作用を発揮します。これらの作用は抗老化と寿命延長効果を発揮します。
松果体は脊椎動物しか存在しません。したがって、最初はメラトニンは脊椎動物においてのみ存在すると考えられていました。しかし、1984年に昆虫にメラトニンが存在することが報告されて以降、メラトニンは細菌やプランクトンや植物を含めて、自然界に広く存在していることが明らかになっています。
さらに、メラトニンがミトコンドリアで産生されており、ミトコンドリアを持たない赤血球以外のほとんどの細胞でメラトニンが産生されていることが明らかになっています。
細菌がメラトニンを合成していることが明らかになっています。この細菌のメラトニンは活性酸素を消去することによって、細胞を酸化傷害から守る役割を担っています。
ミトコンドリアや葉緑体においてもメラトニンが合成されています。これもミトコンドリアや葉緑体が酸素を利用する過程で発生する活性酸素を消去して、細胞を酸化障害から防ぐためです。メラトニンは非常に強い抗酸化作用を有しています。
動物においても、メラトニンはミトコンドリアで合成されて、ミトコンドリアで発生する活性酸素の消去において重要な働きを担っています。メラトニン合成の律速酵素であるアリルアルキルアミンN-アセチルトランスフェラーゼ(arylalkylamine N-acetyltransferase :AANAT)の活性がミトコンドリアで確認されており、高レベルのメラトニンがミトコンドリアにおいて見出されています。つまり、メラトニンはミトコンドリアをターゲットにした抗酸化物質として、ミトコンドリアを酸化傷害から守る役割を担っていると考えられています。
メラトニンは生物最古の抗酸化物質と考えられています。酸素を使ってエネルギーを産生する好気性細菌は、自身でメラトニンを産生し、活性酸素によるダメージを防いでいると考えられています。メラトニンを産生する細菌が原始真核生物に寄生してミトコンドリアになった後も、ミトコンドリア内でメラトニンの合成が維持されています。現在生きている人間に存在するメラトニンは、数十億年にわたって地球上に存在しているシアノバクテリアに存在するものと同一です。
ミトコンドリアおよび葉緑体は、生物におけるフリーラジカル生成の主な細胞小器官です。このため、これらの細胞小器官はフリーラジカルとそれに伴う酸化ストレスから保護する対策が必要です。その役割を担っているのがメラトニンです。メラトニンは強力なフリーラジカル捕捉剤であり抗酸化剤です。メラトニンはミトコンドリアと葉緑体を活性酸素から守るために働きます。

【ミトコンドリアはPGC-1を活性化してミトコンドリアを増やし、心不全を改善する】
メラトニンは抗酸化作用によってミトコンドリアを守るだけでなく、ミトコンドリアを増やす作用もあります。
ミトコンドリアが心不全を改善することは多くの実験や疫学研究で明らかになっています。この作用はPGC-1β遺伝子を欠損させると見られなくなるので、ミトコンドリアがPGC-1βの発現を亢進してミトコンドリア新生を活性化し、心不全を改善すると考えられています。
以下のような報告があります。
Melatonin protects against the pathological cardiac hypertrophy induced by transverse aortic constriction through activating PGC-1β: In vivo and in vitro studies(メラトニンはPGC-1βを活性化することで大動脈横行狭窄による病的な心臓肥大を防ぐ:生体内および生体外研究) Pineal Res. 2017 Oct;63(3).
この研究では、横断性大動脈狭窄(transverse aortic constriction)によって引き起こされる心臓肥大に対するメラトニンの薬理学的効果を検討しています。
横断性大動脈狭窄は、心不全を起こすための実験モデルの一つです。ラットやマウスなどを用いて、大動脈の特定の部位を狭窄させることで、心臓にかかる負荷を増加させます。これにより、心室の圧力負荷が増加し、心臓のリモデリング(再構築)が起こります。結果として、心筋肥大や心不全の進行が模倣されます。
雄の C57BL/6 マウスに 0 日目に 大動脈狭窄または模擬手術を施し、その後 4 週間または 8 週間メラトニン (20 mg/kg/日、飲水経由) を投与しました。大動脈狭窄手術後の 8 週間生存率は、メラトニンによって大幅に増加しました。8 週間のメラトニン投与により、心臓肥大が著しく改善されました。
対照群(メラトニンを投与していないグループ)と比較して、4 週間および 8 週間のメラトニン治療は肺うっ血を軽減し、α-ミオシン重鎖の発現レベルを亢進し、β-ミオシン重鎖および心房性ナトリウム利尿ペプチドの発現レベルを低下し、心臓線維症の程度を緩和しました。
さらに、メラトニン治療は圧負荷によって引き起こされる心臓収縮機能の悪化を遅らせました。メラトニンのこれらの効果は、ペルオキシソーム増殖因子活性化受容体ガンマ共活性化因子 1 ベータ (PGC-1β) の発現の顕著な亢進および酸化ストレスの抑制を伴いました。
in vitro 研究では、メラトニンはアンジオテンシン II 誘発性心筋細胞肥大および酸化ストレスからも保護することが示され、これらの効果は低分子干渉 RNA を使用して PGC-1β の発現をノックダウンすることでほぼ解消されました。つまり、メラトニンがPGC-1βを活性化することにより、圧負荷によって引き起こされる病的な心臓肥大を防ぐことを示しています。
PGC-1βはPGC-1αと同じファミリーに属する転写共役因子です。PGC-1αは主にエネルギー代謝やミトコンドリアの生合成を調節する役割を持っており、特に筋肉での発現が高いです。一方、PGC-1βはより広範囲の組織で発現し、代謝に関連するさまざまなプロセスに関与しています。
心不全は、心臓が十分な血液を体に送り出すことができないことを特徴とする多因子臨床症候群です。近年の医療管理の進歩にもかかわらず、心不全患者の予後不良率は依然として非常に高くなっています。
心血管の健康における内因性メラトニンの重要性と、さまざまな心臓病および心臓代謝障害におけるメラトニン補給の利点は、十分な証拠によって裏付けられています。
疫学的研究は、急性および慢性の心不全患者では松果体メラトニン分泌と循環メラトニン濃度が低下することが示されています。つまり、ミトコンドリアの減少は心不全の発症と関連しています。
PGC-1βの発現亢進によって心臓のミトコンドリアが増えます。メラトニンはPGC-1βの発現亢進によって心筋細胞のミトコンドリアを増やします。メラトニンは抗酸化作用によってもミトコンドリアを守ります。
メラトニンの投与は、酸化ストレス、アポトーシス、線維症、病理学的リモデリングなど、心不全に関連する主要な病理学的プロセスを逆転させます。
【メラトニンはサルコペニアを予防する】
メラトニンは心筋細胞だけでなく骨格筋の筋肉細胞の働きを良くする効果があります。以下のような総説論文があります。
The role of melatonin in sarcopenia: Advances and application prospects(サルコペニアにおけるメラトニンの役割:進歩と応用の展望)Exp Gerontol. 2021 Jul 1;149:111319.
【要旨の抜粋】
サルコペニアは加齢性疾患であり、高齢者の深刻な健康問題になっている。転倒や脱力感や機能障害のリスクが大幅に高まるだけでなく、自分の世話をする能力も低下する。
サルコペニアは、高齢者の生活の質と疾患の予後に直接影響を与える。しかし、この病気に対する薬物介入は不足している。
メラトニンは、体内で生成される生物学的ホルモンであり、抗酸化作用など多くの生物学的効果がある。もともとは睡眠補助剤として使用されていたが、現在では新しい適応症の数が増えている。サルコペニアへの効果も注目され始めている。
メラトニンは骨格筋細胞のミトコンドリアを保護し、筋線維の数を維持できることが知られている。老化した筋肉組織の病理学的変化を部分的に逆転させ、サルコペニア患者の筋力を高める。
メラトニンはサルコペニアと密接に関連しており、サルコペニアに幅広い効果があり、サルコペニアの予防と治療に応用できる可能性がある。
以上のように、メラトニンは酸化ストレスの軽減、抗炎症作用、ミトコンドリア新生の亢進など複数のメカニズムで心筋細胞や骨格筋細胞の働きを高めます。まだ限られていますが、科学的証拠は、メラトニンが老化した筋肉やサルコペニアに特徴的な他の細胞の変化を大幅に改善することを示唆するという点で一貫しています。
高齢者ではメラトニンはほとんど産生されていません。これが、高齢者における心臓機能の低下(心不全)と骨格筋の減少(サルコペニア)の原因の一つとなっている可能性があります。
したがって、高齢者は心不全とサルコペニアを予防する目的で、毎日数十mgのメラトニンを摂取するメリットはあると言えます。
心臓機能が低下している人は、メラトニンをやや多めに服用することは有益です。マウスの実験では1日に体重1kg当たり10mgから20mgで投与されています。
マウスと人間のように体重差が大きい場合は、体表面積で換算する必要があります。通常、マウスで10mg/kg体重は人間では1〜2mg/kg体重になります。つまり、体重60kgで1日に60mgから120mgの摂取になります。
睡眠障害の場合は、1日に1から5mg程度を摂取します。がん治療の場合は、1日に10mgから40mgを摂取します。進行がんの治療では1日100mgから500mg程度の高用量メラトニン投与も行われています。1日500mgを毎日数ヶ月間服用しても、副作用はほとんど起こりません。
また、メラトニンは睡眠誘導作用がありますが、朝や昼間に数十mgのメラトニンを服用しても、眠気はほとんど起こりません。
心臓機能の低下や筋力低下(サルコペニア)が起こってくる高齢者はメラトニンを1日に100mg程度摂取することを試す価値はあります。私も心臓機能の低下と筋力低下を予防する目的で、数年前から高用量(1日に100mgから250mg)のメラトニンを摂取していますが、副作用は経験しません。

