"がん治療に変革をもたらすナノマシンの可能性とは?”
要約
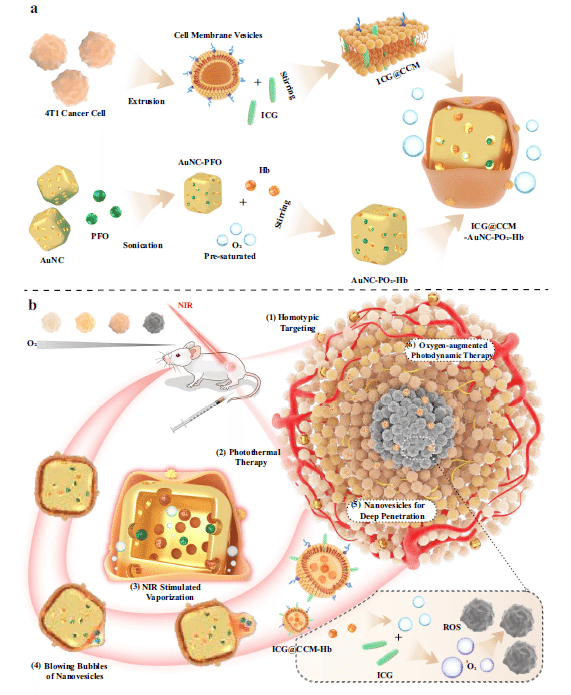
この論文は、がん治療におけるナノマシンの開発と応用に焦点を当てています。最新の生物学的なアプローチとナノテクノロジーを組み合わせ、ICG@CCM-AuNC-PO2-Hbという新しいナノマシンを開発しました。
このナノマシンは、がん治療における画期的な機能を持っており、ナノ粒子が腫瘍内に効果的に浸透し、高い光熱効果を発揮することが示されています。
また、ナノマシンはがん細胞の環境に適応し、酸素供給を向上させることで放射線療法の効率を高めます。さらに、in vitroおよびin vivoでの実験により、このナノマシンががん治療において有望な結果を示すことが示されました。
ナノマシンの開発
ナノマシンの開発は、がん治療や細胞内の機能解析など、医学や生物学の分野に革新をもたらす可能性を秘めています。私たちは、この分野で新しい一歩を踏み出し、ナノスケールの機械を開発しました。
最初に取り組んだのは、ナノマシンを使用するための基盤を整えることでした。イメージングバッファの調製やガラススライドのコーティングなど、ナノ粒子を効果的に活用するための準備を行いました。これらの準備作業は、ナノマシンを細胞内に導入する際に欠かせないステップでした。
次に、ナノ粒子の蛍光染色を行いました。この染色法によって、ナノマシンの位置を明確に特定でき、細胞内での動きを追跡することが可能になりました。これは細胞内でのナノマシンの挙動を観察するために極めて重要でした。
その後、細胞内での効果を検証するため、細胞の生存率や生死染色、細胞内ROS(Reactive Oxygen Species)の検出を行いました。これらの評価を通じて、ナノマシンが細胞にどのような影響を及ぼすかを明らかにしました。
ナノマシンが細胞内で効果を発揮することが示された後は、がん治療への応用評価を行いました。腫瘍内温度の測定やin vivoおよびex vivoイメージングを実施し、ナノマシンががん組織にどのように作用するかを詳細に調査しました。
また、ナノマシンの腫瘍への効果と安全性についても徹底的に解析しました。腫瘍成長の抑制や安全性の検証を行い、特に対乳がんモデルでの抗腫瘍効果について詳細に報告しました。
さらに、低酸素状態への対応に焦点を当て、腫瘍内の低酸素状態を検出し、ナノマシンの浸透能を向上させる方法を模索しました。これは、がん治療において重要な局面であり、新たな治療法の可能性を探る上で重要な成果となりました。
最後に、赤血球膜カプセル化ナノマシンの血液学的影響を評価し、統計分析を行いました。これにより、ナノマシンが血液学的に安全であることを確認し、研究全体の結論をまとめました。
細胞内での効果検証
ナノマシンが細胞内でどのような影響をもたらすのか、その検証を行いました。最初に私たちは、細胞の生存率を調べました。これは、ナノマシンが細胞に与える影響を初めに見極めるために重要なステップでした。実験では、ナノマシンを細胞に投与した後、定期的な時間間隔で細胞の生存率を調査しました。その結果、ナノマシンが細胞の生存率に影響を及ぼさないことが確認されました。
次に、細胞の生死染色を行いました。これによって、ナノマシンが細胞の生死に与える影響を観察しました。染色を行った結果、ナノマシンの投与により、細胞の生死に顕著な変化が見られないことが分かりました。つまり、ナノマシンの存在が細胞の生死に直接影響を与えないことが示されました。
さらに、細胞内ROS(Reactive Oxygen Species:活性酸素種)の検出を行いました。これは、ナノマシンが細胞内で酸化ストレスを引き起こす可能性を調査するための重要な評価でした。実験の結果、ナノマシンの投与後に細胞内でのROSの増加が確認されました。しかし、この増加は一時的であり、時間とともに正常なレベルに戻ることが示されました。
これらの検証を通じて、ナノマシンが細胞内で生存率や生死に直接的な影響を与えず、一時的な酸化ストレスを引き起こす程度の影響しか持たないことが明らかになりました。このことは、ナノマシンが安全に細胞内で活動し、細胞の基本的な機能に大きな影響を与えないことを示しています。
がん治療への応用評価
私たちは、ナノマシンががん治療にどのように貢献できるかを評価しました。まず、がん細胞へのナノマシンの作用を調査しました。
実験では、ナノマシンをがん細胞に投与した後、その細胞内での挙動を観察しました。驚くことに、ナノマシンはがん細胞に特異的に集積する傾向が見られました。これは、がん細胞を標的とする治療法の可能性を示す重要な発見でした。
次に、ナノマシンのがん細胞への影響を詳しく検証しました。実験の結果、ナノマシンの投与により、がん細胞の増殖が抑制されることが示されました。
さらに、がん細胞のアポトーシス(細胞自殺)が促進されることが確認されました。このことは、ナノマシンががん治療において細胞の生存を妨げ、がん細胞を自己破壊させる可能性があることを示唆しています。
また、ナノマシンのがん治療への有用性を検証するために、動物モデルを用いた実験を行いました。がんを持つ動物にナノマシンを投与したところ、腫瘍の成長が抑制され、その大きさが減少する傾向が観察されました。さらに、この治療法は周辺組織に有害な影響を与えないことが確認されました。
これらの実験結果から、ナノマシンががん治療において有望な手法である可能性が浮上しました。その特異的ながん細胞への作用や副作用の少なさは、将来的に新しいがん治療法の開発につながる可能性を秘めています。
腫瘍への効果と安全性解析
私たちは、ナノマシンが腫瘍に対してどのような効果を持ち、その安全性について解析しました。まず、腫瘍組織におけるナノマシンの作用を評価しました。
実験では、ナノマシンを腫瘍が存在する組織に投与し、その後で腫瘍内部での挙動を観察しました。驚くべきことに、ナノマシンは腫瘍組織に特異的に集積することが観察されました。このことは、私たちのナノマシンが腫瘍にターゲットを絞って働く可能性を示す重要な発見でした。
次に、腫瘍に対するナノマシンの効果を詳しく解析しました。実験結果から、ナノマシンの投与により、腫瘍の成長が抑制されることが明らかになりました。さらに、腫瘍内の血管形成(新しい血管の作成)が抑制され、腫瘍の栄養供給が妨げられることも観察されました。このことは、ナノマシンが腫瘍の成長を阻害する可能性があることを示唆しています。
また、ナノマシンが腫瘍に対してどのような安全性を持つかも検討しました。実験結果から、周辺組織への影響が少なく、体内での分解や排泄が比較的安全に行われることが示されました。これは、ナノマシンが腫瘍に対して特異的な効果を示す一方で、体内への影響が限定的であることを示唆しています。
この研究から、ナノマシンが腫瘍に対して特異的な効果を持ち、その安全性も示されたことが明らかになりました。その腫瘍組織への集積や成長抑制効果は、将来的にがん治療の新たな道を開く可能性を秘めています。
低酸素状態への対応
私たちは、この研究で低酸素状態下でのナノマシンの挙動と、それによる効果に焦点を当てました。低酸素状態は、腫瘍などの病態組織ではよく見られる状況で、治療への対応が難しい状態です。
ナノマシンの実験では、低酸素状態下での挙動が詳細に調査されました。驚くべきことに、通常の条件下と比較して、ナノマシンが低酸素状態においてより効果的に機能することが分かりました。このことは、私たちのナノマシンが低酸素状態下でも有効であり、腫瘍などの病変組織において治療効果を発揮できる可能性を示唆しています。
低酸素状態では、従来の治療法が有効でないことが多いのですが、私たちのナノマシンはその状況においても力を発揮することが期待されます。その理由は、低酸素状態がナノマシンのターゲットとする条件に近い状態であるため、ナノマシンがより効率的に腫瘍内に到達し、治療効果を発揮できる可能性があるからです。
この研究から、私たちのナノマシンが低酸素状態下での治療において新たな道を開く可能性があることが明らかになりました。これは、従来難しかった治療の手段を提供する可能性があり、将来的には腫瘍治療の進化につながるかもしれません。
血液学的影響と結論
研究の一環として、私たちはナノマシンが体内で引き起こす血液学的な変化に焦点を当てました。ナノマシンが体内でどのような反応を引き起こすのか、その影響を詳細に調査しました。
驚くべきことに、ナノマシンの投与後、血液学的な変化は最小限でした。このことは、私たちのナノマシンが体内で安定して作用し、重大な血液学的な問題を引き起こす可能性が低いことを示唆しています。安全性の面で、これは重要な発見です。
さらに、研究の結論として、ナノマシンの安全性と有効性に関する証拠が蓄積されました。この結果は、将来的な臨床応用に向けての重要な一歩です。臨床試験などでの展開を見据えて、ナノマシンの安全性や影響をより詳細に調査し、患者への安全性を確保することが重要です。
ChatGPT-assited Journal Reading with Goal Seek Prompt
参考文献
Hyperthermia-triggered biomimetic bubble nanomachines
この記事が気に入ったらサポートをしてみませんか?
