
アサイゲルマニウムとは何なのか 第三章(長編連載~)2023年6月23日第7&8話掲載(第三章完結)
第三章 アサイゲルマニウムの研究 其の一:痛み
1.前を向く
薬事法違反というのは社員を意気消沈させるのに、あまりにも十分すぎる出来事だった。薬として認可されて、難病で困っている人たちの助けになる!その思いで社員一同新しい土地での新工場・新研究所で頑張ろうとしている矢先の出来事であり、青天の霹靂という言葉が最も合致するシチュエーションだった。華やかな東京での暮らしを捨てて、雪の降る北の国・函館に移住してまで社員一同が願っていたのは、浅井先生が掲げた『人類救済』にむけての健康問題へのアプローチとしてのGe-132を完成させることだった。ところが、ニセ薬作りのレッテルを貼られ、難病を治すために全国からクリニックに受診に来られる方々の期待に早く応えられるように、との願いと想い、そしてプライド全てが打ち砕かれた。この先、会社の収入がなくなって給与が支払われなくなったらどうするのか、これから自分の生活はどうなっていくのか、毎日なにをしていけばよいのか。

取材不十分で失礼な内容も多かった。
本記事(週刊朝日)は割とまとも
ぼくにとっても希望しない形での研究業務の再スタートだった。
この半年間の研究所建築と工場立ち上げの努力は何だったのか・・・無駄に終わったのか。不動産斡旋や、工事現場ヘルメットを被っての日々の視察、工場建設の機器設置確認、アサイゲルマニウム製造の試運転と試作、カプセル製造のための規格基準対応への準備。普通に研究員をしていれば絶対にやることの無かった様々な作業。振り返ると忙しかったが充実して毎日が楽しかった。そして良い仲間たち、気のいい同僚たち。そして、先輩社員に「アサイゲルマニウムが悪いものではなく、インチキじゃないことを知人に説明してほしい」と頼まれ、ぼくじゃなきゃ出来ないこともあるんだ、と考えさせられた。
しかし、ニッテンで学んだ技術は動物実験が主で、腸内細菌の研究のための設備も動物飼育の設備もない函館研究所ではなにも出来なかった。
糞便の色変化の研究は現時点で継続できない。それが突きつけられた現実だった。
それなら・・・と考えたのは、火傷の痛みだ。火傷した時の痛みの退き方の速さは尋常ではなかった。それと、組織が異常を起こさなかったこと。あれは細胞が熱を受けても大丈夫だったということ。細胞を培養する器具は生物実験室に一通り揃っているので、細胞に火傷を負わせてアサイゲルマニウムの保護効果を観れば良いのではないか。細胞が生きているか、死んでいるか調べられればできそう。と妄想して仕事を始めることになった(笑)
さて、ところで・・・
なぜ痛みがあれほどまで急激に鎮静化するのか。大体にして、痛みってなんなのか。その疑問を解くには本を調べるしか無い。当時、1990年代後半はWindows95が出たばかりの頃で、インターネットは普及されていなかった。函館研究所はLAN接続を使って社内のPCをつなぐ画期的なシステムを導入し、プリンターを共有するという環境にあったが、今から考えれば環境整備されていたことは幸いだが、調べ物はペーパーベースで考えなければならなかった。函館研究所図書室や研究部の研究書籍は零細企業にしては充実していた。医学・生物学・生理学・化学といった広い分野の知識を得るための学術書籍が多く備えられている。今では古い本ばかりになってしまったが・・・。

ぼくは神経の話し、痛みの解説書などを見つけ出し、それまでの不勉強を嘆きつつ頑張って調べた。痛みは脳神経系の電気的な伝達で伝えられ、中枢と末梢に大きく分けられる。痛みは神経軸索中では電気により伝えられるが、神経細胞と他の神経細胞との間ではシナプス(神経細胞同士の接合部)が存在し、そこでは間隙という狭い極短距離の隙間で電気信号が化学分子である神経伝達物質に変換されて情報を伝える。シナプスにおける神経間隙でシナプス前部から能動的に神経伝達物質が放出され、シナプス後部には放出された神経伝達物質を受け取る受容体タンパク(特定の情報を受け取るアンテナを想像してほしい)がある。ということを理解した。
痛みを伝達する物質としては、カリウムイオンやサブスタンスPがある。と本に書いてある。
感覚の認識は感覚受容器というのが末梢(皮膚内や臓器と神経の接続部)に存在し、その受容器が大きな信号を受けて、一定の閾値をオーバーするような状況になった時に痛みの刺激として脳が認識するのだという。
その頃、ぼくは研究部の先輩である佐藤克行さんと親しくなった。佐藤さんは秋葉部長のお弟子さんであり、学生の頃に秋葉さんが大学の教員でおられ、有機化学を直接学んだのだそうだ。佐藤さんは有機化学、合成化学が秋葉さん同様に非常に好きで、化学構造を頭の中で考えるのが好きな方だ。秋葉さんや佐藤さんほどの化学好きは生まれてこのかた他に見たことがない。化学の話をしている時は目が輝き、ウキウキとしているのが外目に分かるのだ。佐藤さんはNMRのエキスパートで、合成した有機ゲルマニウム化合物のNMRを測定し、合成した分子の構造を確認する。NMRすなわち核磁気共鳴・・・大学時代に説明は受けたが、チンプンカンプンだった。しかし、函館研究所研究部が持つ分析機器として最も高額であり、この規模の企業では普通は自前で持っていない装置であるNMRにぼくは興味を持った。
函館はおろか、2023年現在では世界中でこの装置を使っているのは我々だけだろう。当時は8インチフロッピーディスクにデータ記録…。もう1997年の時点で殆ど売っていない媒体だった。それから20年以上。解析装置部分が壊れたのを機に、新しい機種の解析装置を無理やり改造してインターフェースを持たせ、さらにハードディスク付きのパソコンまで現在は付いた(爆笑)収入の途絶えた会社ならではの奇跡の一品が出来上がった。本体の見た目はR2-D2…にどことなく似ている。突然動いて突起を出してレーザー光を出しそうだ(笑)
中「佐藤さん、NMRで何が分かるんですか?」
佐「お、いい質問だねぇ」「簡単に言えば分子の構造が分かるんだよ」
佐「化学スピンを持っている原子を観ることができるんだけど、その原子がどのような状態にあるか分かる」
中「ウ~ン、分かりません(笑)」「で、どのように使うんですか?」
佐「えーと、合成した分子の構造が合っているか見れるのと、分子同士の相互作用が分かるんですよ。たとえばGe-132と糖が相互作用して反応するのも分析できるんです」
中「ん?Ge-132は糖と相互作用する?相互作用ってなんですか?」
佐「相互作用っていうのは分子と分子が相互に作用して反応するので、錯体を作るんです」
中「錯体ってイオン同士がくっついたりするやつですよね?」
佐「そうそう。このGe-132と糖の場合は分子同士から水が取れたり付いたりするんです」
中「ふぅん。糖なら何でもいいんですか?」
佐「いや、シスジオールっていって、並んでいる炭素に付いている水酸基が同じ方に向いているものと作用するけど、例えばフルクトースなんかの五員環構造では作用しやすいんですよねぇ」
中「へぇえ。面白いですねぇ。他にはどんなものがありますか?」
佐「あとは、カテコールですね。ベンゼン環に同じ方向で水酸基が2つ付いている。これはもっと強くくっつきます。あとは、SHです・・・」
中「そうなんですか!なんかそのような構造のものって身体の中に沢山ありますよ。」
佐「あ、そうなんですか?」
中「ちょっと調べてみます!!」
そしてこれが切っ掛けでアサイゲルマニウムが生体内で作用しそうな相手探しが始まった。若者に紹介する見合い相手を探すオバサンのように(笑)生化学ガイドブックを最初のページからどんどんめくり、シスジオールの五炭糖とカテコールアミン類、SHを含む構造を片っ端から探した。
そして、見つかってきたのが、フルクトース、フルクトースリン酸、ATP、核酸類、RNA、補酵素NAD、NADP、カテコールアミン類(アドレナリン、ノルアドレナリン、ドーパミン、L-Dopa)、システイン、グルタチオン、補酵素A等だった。
こうして並べてみても、魅力的な分子揃いである・・・。身体の中に入ってこんな連中と作用して、それで何もないハズないじゃん!!
中「佐藤さん、これすごいですよ!」
佐「へぇ。すごいですか・・・。それはすごいですねぇ!」

話は痛みに戻る。
痛みが止まるってことは痛みの成分とくっついちゃえばいいんだよな・・・。カリウムはカチオン(プラスイオン)だからアニオン(マイナスイオン)のGe-132とくっつくけど…。それならアニオンなら何でもいいし。お酢でもいいことになる。サプスタンスP・・・なんだそりゃ。
痛みについて自分なりに考えてみる。痛みはある信号(シグナル)が一定の閾値を超えたら痛みになるけど、その前は痛みとして認識しない。痛くなるのはどんな時か。怪我で傷を負った時、いま標的にしているのは火傷で組織が壊れている時。組織の構成成分はタンパク質なので、タンパク質が熱変性した時。細胞が壊れてパンクした時。
なるほど、細胞が壊れているなら、生きている細胞が壊れているという情報が利用価値がありそう。それなら、生きている細胞がどんどん作っているATPが痛みとして情報を伝えるほうが、生き死にに関係のないカリウムより良さそう・・・。
そんなことを考えていた時に、秋葉さんに考えを伝えた。
そして、数日すると秋葉さんから興奮気味に電話がかかってきた。
秋「あ・もしもしぃ、中村くん?秋葉です。こないだのATPの話だけどさぁ、今月のファルマシアにおもしれぇ記事があるの見つけたんだよ。福山大学の中村先生って人がピーツー受容体のこと書いてるんだけどね」
中「・・・・?ファルマシア?って何ですか?」
秋「あぁ、ファルマシアしらないかぁ。薬学会の学会誌なんだけどね。ATPの受容体のP2レセプターってのがあって、痛みのシグナルになっているんだってさ!君の言ってた話し、あれビンゴだよ!最近のネイチャーに発表されたらしくって、中村先生が総説書いてんだけど、かっちゃんも薬学会員だからとってると思うんで、見せてもらってご覧なさいよ」
中「はい。わかりました」
というようなやり取りだったように記憶している。
ぼくは、細胞に熱をかけて細胞が死ぬ実験系で、アサイゲルマニウムが細胞を死なないように保護するかどうかの実験と、アサイゲルマニウムがATPと相互作用するかどうかNMRで解析する実験を行おうと決めた。いつまでも下を向いていても始まらない。前を向いて歩き出さなければ・・・。
どちらが先だったか定かではない。しかし、この時期に浅井ゲルマニウム研究所の函館移転のために顧問となった市村敬司さんが会社の皆が前を向くよう尽力してくださった。「新しい事業を立ち上げようよ!」その声掛けで、しばらく後にNHKにてテレビ放送されるようになったプロジェクトXさながらの新規事業計画を全員で模索するようになった。
市村さんは、大手企業で様々な事業化を手掛けていたエンジニアで、経験豊かであり、温かみのある面白い方だった。ぼくたちに社会ニーズを調べるようにという課題を与え、何を事業化すれば儲かるか考えるよう導いてくれた。梅田さんなどは、北海道で売れているソフトクリームに興味を持ち、30歳になっていたが北大生のふりをしてソフトクリーム店に大学のレポートのためインタビューに協力してもらいたいと願い出た。他の皆が何をしたかは忘れたが、最終的に健康にかかわることしかしてこなかった会社なので、健康に関わる分野での新規事業を立ち上げようという話になったのを記憶している。
市村さんはとてもお酒好きで、我々当時の若者と函館駅前の屋台のおでん屋に通った。東京から頻繁に出張してこられ、その際には夜中まで飲み、おでん屋で締める。というパターンだった。そしていつも同じ質問をする。「梅田くんやぁ、中村くんやぁ、(どうやら故郷の方言の呼びかけらしい)親が子にしてあげられる3つの事があるんだけどやぁ。なんだか分かる?」いろいろと言うが分からないので聞く。「あのやぁ。まずは生んであげること。そして名前をつけてあげること。あとひとつは分かるかやぁ?」また色々と言ってみるが当たらない。「むずかしい?それはやぁ、見守ってあげることなんだよ」「親ができるのは、たったその3つだけ。あとはなぁーんもできない」
これは毎回恒例のやり取りだったので、ぼくもさすがに途中から覚えた(笑)そして今も覚えている。2年ほど前に市村さんに久々にあったら、とても喜んでくれた。20年経っても、その話で盛り上がる。
詳しい話は割愛するが、そのプロジェクトは非常に面白かったし、事業を考える、社会のニーズをマーケティングする。事業化可能か小さくパイロット試験して作ってみる。採算が合うかF/S(フィジビリティスタディ)を行ってみる。この頃に様々なことを学べる機会になった。今も感謝しています。
2.細胞研究
ぼくは当時、細胞実験をしたことがなかった。細胞実験をしていた先輩である小林さんはやめてしまっていた。だからぼくの先生は会社にある研究関係の書籍だ。組織学研究の本を開き、細胞の培養法を熟読した。そして、ぼくが扱いたかった皮膚の細胞の研究方法が記されているのを見た。皮膚片1mm画程度を切り出し、培養容器に擦り付けて培地中に静置し、細胞が遊走するのを待つと皮膚の線維芽細胞を得られるという。

当時、浅井ゲルマニウム研究所は函館に移転したが、製造工場と研究部門のみで、開発部門や総務部門は狛江に残っていた。開発部門の佐藤功さんは以前は生物系の培養細胞を使った研究をされており、会社に入られる前からアサイゲルマニウムに惚れ込んで弘前大学から浅井先生に直接入社をさせてほしいと志願され、学生時代からアサイゲルマニウム研究のために組織培養学を習得された方だった。恐らく、学術部長の大西さんにぼくの考えを話し、培養細胞で研究しようと思っている事を伝えたので、功さんを紹介してくれたのだと思う。功「もしもし、中村くん?佐藤功です!自分の皮膚を切り取って実験しようとしてるんだって?(爆笑)中村くん、それ痛いよぉ。自分の皮膚じゃなくっても、理研で皮膚細胞売ってますから(笑)。それ買ってやったら良いよ。理研に細胞銀行ってのがあって頼むとカタログ送ってくれるから。古いのが研究部にもあると思うよ。」中「え!そうなんですね(笑)もう、さっとメスで自分の皮膚切ってゲルマニウム塗り込んでおこうって思ってました(爆笑)ありがとうございます!」こうして、理研ジーンバンクからヒト皮膚正常細胞を購入し、実験を行うことになった。しかも功さんが函館に来てコーチングしてくれた。功さんは入社されてから東京大学の応微研にいって長く研究されてきたので、東大仕込みの培養細胞研究法を伝授してもらい、実験方法についても丁寧にアドバイスしてもらいながら行うことが出来た。熱を恒温水槽で細胞に負荷し、細胞死がある程度生じる条件を探した。42℃から45℃程度の熱で細胞は死んでしまう。最終的にこの実験はあまりうまくいかなかった。水槽の温度がかなり変動が大きく、サーモスタットの精度が悪かったためだ。なかなか難しいものだと感じた。しかし、この実験を通して培養細胞を扱う技術を習得し、研究の幅が広がった。この研究を行う上で、前述の大西部長に非常にお世話になった。大西勉さんは師匠という感じではなかったが、あらゆる面でお世話になった。大西さんに初めて会ったのは、まだ会社に入る前、狛江で歓迎会を行ってもらったときだった。4月に新卒で入社することが決まり、入社時から直ぐに帯広のニッテン勤務になることが決まっていたので、その前に歓迎会をすることになったと東京の狛江研究所に呼んでもらった。歓迎会の前に各部署に挨拶回りした。狛江の研究所内を一通りめぐり、主だった人たちに紹介してもらった。開発部では大西さんの名前が出たが、外出中でいなかった。歓迎会になると、歓迎されるのはぼくだけではないことが判明した。もう一人の対象者が前述の市村顧問だった。「いちむらたかしでございます」とにこやかに自己紹介しておられた。ぼくの番になったので「なかむらたかしと申します。市村敬司顧問とは名前が似ていますし、姓名とも漢字が一文字共通です」と自己紹介した。市村さんはこの紹介がとても印象に残っていると、後々話してくれた。各部署の方々から歓迎の言葉をもらったが、正直あまり覚えていない。緊張していたのだと思う。ただ、司会者が「ここで本来なら大西部長なのですが、今日は出ているので」という話になった時に、会場がどっと笑いに包まれた。大西さんとはどういう人物なのだろう・・・。どうも話題の人物だということは確かだ。歓迎会が終了し、狛江の駅近くにあるバーボンというスナックに移動して二次会をするという。酒好きのぼくは喜んで尻尾を振ってついて行った。浅井研の人たちはとても歌うのが好きで、切れ間なく皆が歌っていた。かなり時間も遅くなった頃、大きなカバンを肩から下げた方が店に入ってきた。今思えば、カバンが大きかったというより身体が小柄だったのと、カバンに書類が詰まっていて一杯だったため大きく見えたのだと思う。
大西勉さんが、自分の人生に大きく関わるとはこの時は思いもしなかった。そもそも、部署も違う、会社の大先輩であり20年近く年の離れた方である。しかし、人生の不思議というか、いたずらというか・・・。
この日、気がつけば深夜一時を軽く回っており、既に実家である京王線の明大前までの終電は終わっていた。狛江から実家までは歩けば3時間ていどだろうか。と悩んでいた。その時に声をかけてくれたのが件(くだん)の大西さんだ。会社の皆さんは狛江付近に住んでいるからか、まだまだ酒宴は続く様子だった。バーボンを後にし、大西さんとぼくは狛江駅前に移動した。とはいえ、駅チカの店だったので、2、3分の時間だったと思う。ぼくは先に記した通り、就職初日から外部の勤務先に出されることが決まっていたが、大西さんはそんなぼくを気遣ってくれているのが非常によく解った。「おれも何度も外部に出されて修行したけど、他人の釜の飯を食うのは良いもんだよ・・・」その言葉はぼくのその後の人生への餞の言葉として十分すぎるセリフだった。この時点ではウンコを生業にすることになるとは全く想定していなかった。そして、それまでの人生で見たことのないタクシーチケットを渡してくれ、降りる時にこのチケット渡せばいいから、と説明を受けた。ただ、それ以降の25年以上の会社での人生においてタクシーチケットを利用した経験は一度もない(笑)とても面倒見の良い親切な方だというのが第一印象だった。
大西さんの話は、恐らく後で沢山記述することになるだろう。先述の通り師匠だとは思っていない、同志というには後々微妙な関係になってしまった。いや最終的には同志かもしれない。
さて、そんなわけで先輩方のご指導・ご協力の下、ぼくの細胞実験スキルが身について、アサイゲルマニウムは生体にどのような作用をするのか、動植物の生命体としての最小単位である細胞に対してどのように影響をおよぼすのかを検討するための最低限の手法を得ることになった。
この時点で得た知識として以下がある。細胞は熱に弱い。45℃程度で簡単に死んでしまうが、ダメージが小さい(温度が高すぎない・・・42℃程度、時間が短い・・・5分程度)ならば可塑性を持って生存し、増加できる。がん細胞は更に熱に弱く、42℃程度でも死んでしまう。といったものである。
残念ながら、結果としてこの研究は恒温槽の精度が悪く、成功しなかった(もちろん恒温槽が良いものであっても成功したか不明である)。その後、細胞の実験としては初代細胞培養法を佐藤功さんから伝授していただき、マウス正常皮膚線維芽細胞の培養により酸化ストレスに対する細胞の抵抗性についての研究や、メラニンを産生する悪性腫瘍細胞であるマウスの黒色メラノーマ細胞B16によるメラニン産生への影響などをテーマに研究を行った。(下記文献はその成果の一部)
https://www.mdpi.com/1422-0067/20/19/4785
しかし、火傷に関する研究は細胞での実験で生存率を評価するのが難しいと判断し、端的に作用を感じ取れる痛みに関心が移っていった。
2023年5月31日更新
3.痛み(伝達分子)に関するNMR解析研究
先述した通り、火傷に対する研究としては水ぶくれにならず、所謂火傷痕になることを予防すると考えられる作用をアサイゲルマニウム塗布が発揮すること、痛みを抑制する作用もあることを実感していて、この2点について検証していこうと考えた。前者の研究は前項に書いた通り、あまりうまくいかなかった。そこで痛みの抑制についてケミカルな反応を見ていくことにした。この順序であったか、同時に両者の実験を手掛けていたか、当時の実験ノートを見れば分かるかもしれないが、いずれにしても最終的に後者の痛みの研究にメインがシフトしていった。
核磁気共鳴分光法(Nuclear Magnetic Resonance Spectrum Analysis)英語の最初の3単語の頭文字をとってNMR。本章のはじめにも述べたが、大学でも概略を習ったものの、チンプンカンプンで覚えられなかった。名前を聞いただけでストレスを感じそうな装置だし、実際に本体が極めて強い磁石により強力な磁気を帯びているため、金属を身につけて近づくことは厳禁。また、磁気カード(当時はテレカをはじめ様々なカードが磁気で管理されていた)を入れた財布などがあると、記録が破壊されてしまうという厄介な装置だ(笑)
このNMRを零細企業の浅井ゲルマニウム研究所は自前で所有していた。この装置は液体ヘリウムを多量に消費するため維持にコストがかかり、また装置自体も極めて高額であった。研究所は営業停止になったため収入が絶たれ、ハイコストのNMRは非常に厄介な分析装置だった。もともとは分子の化学構造を解析する装置であり、有機ゲルマニウム化合物の研究所である当社は合成した有機ゲルマニウム化合物をNMR解析により構造確認し、化学反応の確認に使用していた。この金食い虫を野放しにしておいてはいけない(笑)所有している以上は働いてもらわないと!
・・・ちなみに2023年現在、液体ヘリウムの高騰が更に進んでいて、維持費は洒落にならない(汗)
という訳で、佐藤克行さんに手ほどきを受けながらNMRを使ってみた。目的は秋葉部長とも話をしていたATPとアサイゲルマニウムの相互作用研究だ。ATPは1990年代末のこの頃に丁度末梢での痛みの伝達シグナルであることが示されて、痛みのアンテナとも言えるP2受容体というプリン受容体(注;プリンというのはお菓子のプリンではない)が末梢の神経細胞に存在(発現)していて、このアンテナに近隣の細胞が壊れて漏れ出てきた中身のATPがくっつくことで痛みの電気シグナルが神経細胞内に起こされるというのだ。つまりATPとアサイゲルマニウムの結合があれば、アンテナにATPが結合するのを抑制して痛みが弱まるのではないかと仮説を立てたわけだ。
実験は単純。アサイゲルマニウムは粉末の状態では巨大なポリマー(重合体)分子で安定だが、水に溶かすと単純な小分子になる(単分子あるいはモノマーという)。この時の構造はゲルマニウムに3つの水酸基(水素Hと酸素OからなるOH)とプロパン酸(炭素が3つ連なった単純な有機酸)が結合した3-トリヒドロキシゲルミルプロパン酸というもので、この分子の略名としてTHGP(英語名称の頭文字の省略形)とぼくが名付けた。以降この名が多く出てくるが、アサイゲルマニウムと同じ意味で考えてもらって構わない。溶解したTHGP(水に溶けた時のアサイゲルマニウムの単分子の略称)との状態でATPと同じ分子数(モル数)となるよう両者を重水素水に溶かし、体の中の酸性度と同等の中性(酸・アルカリの中間の酸濃度・・・ちょっと難しくてすみません、pH7程度)に調製する。これをNMR分析用のガラスチューブに約800マイクロリットル入れてNMR装置にセットする。分析状態を設定して登録し、分析開始。画面に現れるスペクトル(分析パターン)を観て、混合しないそれぞれの単独の場合の解析パターンと比較するのである。

(ぼくの書いた社内レポートより)
当時は分析装置も発達しておらず、コンピューターが未熟であったため、分析データは紙にプリントアウトしていた。THGPのスペクトル、ATPのスペクトル、そしてTHGP+ATPのスペクトル。この三枚の紙を2枚ずつ重ねて透かしてみる。スペクトルというのはところどころに山が飛び出た線のデータで、この飛び出た山をシグナルとかピークと呼ぶ。データ用紙を重ねて透かした時に重なる山と重ならない山がある。同じ位置で重なるのは同じ物質だからで、重ならないのは違う物質だからで、THGPとATPを混ぜると、そのままの同じ物質の他に今まで無かった新たな物質のピークができるのが分かる。これは今までのものとは違う新たな物が出来ていることを示すもので、THGPとATPが結合した新しい物質のシグナルが出たものだ。
こうして、構造から推察してTHGP(すなわちアサイゲルマニウム)と結合できそうな分子であるATPが実際に結合することが確かめられた。つまり、痛いという感覚を伝える物質であるATPと結合してしまうことで痛みを伝えにくくする可能性が化学的に明確化されたのだ!!
この後も、NMRは大活躍、先に記した通り生体内の様々な重要分子がTHGPと結合性を持ちそうなので、個別に調べていった。結果、今わかっているところでは、ATP、ADP、アデノシン、およびこれらと同様のプリン化合物とピリミジン化合物(たとえばGTPやUTP等)、これらに関係があるRNA、それとカテコールアミン(アドレナリン、ノルアドレナリン、ドーパミン)、システイン、グルタチオン、加えて最新で硫化水素がある。その他にも様々な糖化合物がTHGPと可逆的に結合することができる(くっついたままでなく容易に離れる)ことが示されている。
この結合性により、2022年現在で炎症の抑制、鎮痛、シミの原因となるメラニン産生の抑制、RNAウイルス(インフルエンザ)感染症の抑制が細胞や動物を用いた実験で既に証明されてきている。(こちらは北大遺伝子病制御研究所が共同研究で行って、一昨年2021年に掲載された以下の文献を参照ください)
まさにNMRさまさまである。研究所のNMRに足を向けて寝ることは出来ない(笑)なお、今もこの装置は健在で、様々な改造を受けながら現役を続けている。最初は8インチのフロッピーディスクという記憶媒体しかデータ保存できなかったのが、バージョンアップされてHDDで大量のデータを保管できるようになり、解析も多様なスペクトルデータを画面上で操作できるようになった(しかしバージョンアップされてぼくの覚えたオペレーションでは分析できなくなった)。この装置が現在でも現役で使われているのは日本中(いやもしくは世界中・・?)でただ一台、当社函館研究所となっている。貧乏で物持ちの良い会社である。維持管理している研究部化学系の歴代の研究員の皆さんに敬意を表する。
4.痛みの細胞研究
さて、NMRでの研究がデータとして得られて分子研究は成果が得られたので、次は細胞の研究だ。ぼくは文献を調べ、日本のATP受容体研究は井上秀和先生が最もこの領域に詳しく、ATPの末梢での痛覚伝達にP2X2/3受容体が関わっていることを論文発表や総説を書かれていることを知った。また、このP2X3受容体が発現(存在)している部位を研究した岩永敏彦先生が北大の獣医学部にいることを知り、北大出身の大物である弊社顧問であった梅田圭司先生に電話で相談した。
中村「痛みの受容体の研究をされた岩永敏彦先生が北大の獣医学部にいるのですが、ATP受容体の研究を教えてもらえないかと思っています」
梅田先生「よっしゃ。わかった。連絡してみるよ」
恐らく10分ほど後に梅田先生から折り返しの電話が来た。
梅田先生「中村さん、岩永先生に連絡しておいたから。会って話聞いてくれるらしいよ。それと、岩永先生はあなたと同じ大学出身(帯広畜産大)だって。あとは宜しく」
なんとも呆気なく岩永先生とつなげていただき、ぼくは電話をして会いに行くことになった。
岩永先生に会いに北大の北キャンパスに訪問した。緊張したが、先生はぼくが帯広畜産大学の後輩だということで和やかな感じで話を聞いてくださった。岩永先生は「私はP2Xの研究をしているわけではなく、解剖学の専門でタンパクの組織切片における局在を抗体を使った染色で分析しただけなんですよ。だから、研究の中心人物の井上先生を紹介しますよ。丁度、もうすぐ札幌である学会に井上先生が来られるので、その時に引き合わせます」ということで、トントン拍子に話が進んだ。
ぼくは折角の機会なので、自分の研究であるアサイゲルマニウムによる赤血球代謝への影響仮説と、胆汁色素の研究について話し、当時考えていたTHGPの脂肪酸的な作用面の仮説をお話した。それは、THGPという分子が有機酸であるプロパン酸にゲルマニウムが結合した構造であり、分子量が一般的に最も多い脂肪酸であるオレイン酸やリノール酸と近い200弱であることから、これらの脂肪酸による消化液胆汁の分泌促進作用と同じようなことが起こっているのではないかということ。すなわち脂肪酸の受容体が同じような分子量の(大きさが近い)、似た末端構造を持つ分子が来たことによる誤認識で、誤作動しているのではないかとの考察を話した。脂肪酸は小腸の上皮細胞に受容体が備わっていて、食物中の脂肪が消化管に入ってくるとこれを認識する。そして消化酵素や脂肪吸収に必要な胆汁を分泌させるためにホルモンであるコレシストキニン;CCKというタンパク質を分泌して、血液で運ばれたCCKは胆のうを収縮させることで中身の消化液を小腸内に一気に絞り出すということが知られている。これは京都大学農学部の伏木先生がセミナーで話しておられたのを聴き興味を覚えたのだった。岩永先生は面白がってくれて、「P2受容体の研究は難しいけれど、動物の胆汁分泌に対する影響なら協力できますよ」と言ってくださり、実際に検討していただくことになった。
実際にこの研究を担当してくださったのは、当時は大学院の博士課程の学生(だったと思う)の方だったが、驚いたことに、この方は名倉師匠の義妹で奥様の妹さんだった。北海道は広いが、世間は狭い!
残念ながら、アサイゲルマニウムの摂取をしてもウサギの胆汁分泌量には影響がなく、従って脂肪酸受容体誤認識仮説は儚くも敗れた。しかし、それならば分泌液量が変化せず内容物である胆汁色素や胆汁酸が分泌量として増したことになる。つまり一定量あたりの濃度が濃くなったはずだと判った。
それはさておき、後日、札幌で行われた薬理学会に参加し、岩永先生に井上秀和先生を紹介していただいた。井上先生は国立医薬品食品衛生研究所の薬理部の室長をしておられた。それまでのTHGPとATPの相互作用研究についてまとめた書類をお渡しし、考えを説明したところ、非常に面白いと評価していただいた。国衛研には多くの民間の研究者が来て研究されているので、ぼくにも是非そうされるように・・・と話していただいた。後日、アサイゲルマニウムを送り、連絡を待ったが、井上先生からの連絡はいただけなかった。会社の先輩に相談したところ、「厚生省の機関だから無理だよ。」と笑われた。つまり厚生省が告発した罪人である浅井研の研究者を厚生省の研究機関が速やかに受け入れるはずはない、というのだ。今にして思えば、そりゃそうだ!!と思える。しかし、当時の若かったぼくには理解できず、井上先生本人が良いと言ってくださったし、薬事法違反と研究の事実は別のことだと青臭いことを考えていた。連絡をいただけなかったので井上先生に電話してみたところ、「実際に痛みが止まるのが分かっているのなら、もう良いんじゃないですか?(国衛研で研究する必要はないのでは)」との曖昧な答えだった。研究者としての追求心とは関係なく、政治的な力が何かあるのかも・・・というのを直接感じた事柄だった。岩永先生には経緯について電話でお話し、取り次いでくださったことのお礼を伝えたが、井上先生はとても良い先生だし、そんなことはないのではないか、と信じられない状況だと驚かれた。THGPとATPの研究を細胞で行うには、神経細胞を培養し、電気的なシグナルを解析するシステムや、信号伝達の際の細胞の応答を蛍光分子で可視化する顕微鏡装置などが必要であり、これらを揃えるには莫大な費用がかかる。当時の営業停止処分を受けて収入の絶たれた浅井研に、これらを準備する財力は見当たらなかった。
ぼくは井上先生に会ってみた際の印象は非常によく、紳士な素敵な先生だと感じた。国の組織というのは難しいもので、井上先生は研究に興味を持ってくださったが、厚生省としてNGだったから上からの圧力で研究生を受け入れないよう指導があったのだろうと勝手に推察している(笑)これはあくまでも、ぼくの勝手な推察です!1997~2000年頃の出来事である。
2023年6月2日更新
5.痛みの動物実験
細胞実験で進めることができなくなったぼくは、秋葉部長にNMRによるアサイゲルマニウムとATPの結合確認を報告した。そして秋葉さんから「中村くんに以前ファルマシアのATPのP2受容体についての総説を書いた福山大の中村明弘先生のこと話したよね。ぼくの後輩が福山大薬学部の教授やってるから、中村先生を紹介してもらおうか」と電話ディスカッション中に言ってもらい、程なくして「紹介してくれるって言うから広島に一緒に行こうよ」と連絡いただいた。
ここで、少しばかり受容体について説明しておかなくてはならないだろう。詳しくは以下の図にある解説を参照しつつ理解してほしい。受容体というのは細胞同士が情報を連絡するのに使用するタンパク質で、細胞の表面の細胞膜脂質にタンパク質がグネグネと何度も貫通する形で埋まっている。役割としてはアンテナ(受信機?)のようなもので、特定の物質が細胞表面(図のE側)にやってきた時に情報を別の形に変換して細胞の内側(図のI側)に伝える・・・というもの。ここで出てくるP2受容体はATPが周りの細胞から届くと、例えば神経細胞では(周囲で生きている細胞が壊れているという)痛みの情報として神経細胞内にプラスの電荷を持ったカルシウムイオンを流入させ、電気信号(パルス)で脳に伝達する仕組みになっている。
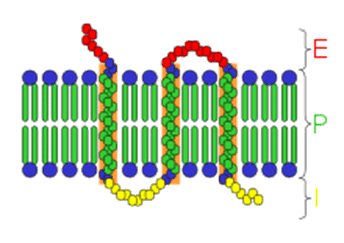
膜貫通型受容体: E=細胞外空間、P=細胞膜、I=細胞内空間
Pの部分の青い球の極性基と緑で示される脂肪酸によるリン脂質が向かい合い、
脂質二重層の細胞膜を形成し、
そこに数珠繋ぎのアミノ酸によるタンパク質が膜を貫通している
ぼくは函館から中国地方に向かい、新幹線が“こだま”しか停まらない福山駅で秋葉さんと待ち合わせ、タクシーで福山大学に向かった。福山大学では秋葉さんの東京薬科大学の頃の後輩だという日比野教授の部屋に伺い、それから中村教授の元に伺った。アサイゲルマニウムの性質について秋葉さんがご紹介し、ぼくの方からATPとの相互作用についてNMRのデータとともに紹介した。中村先生は非常に興味を持ってくださり、それというのも、先生のご出身だった京都大学薬学部の頃、一緒に研究室に所属していたメンバーがアサイゲルマニウムの鎮痛作用について研究していたことを話してくださった。1980年代に京大薬学部の佐藤公道先生の研究室で薬理作用を検討されていたことは文献で知っていたが、中村明弘先生が丁度その頃に当該研究室に所属していたわけだ。何年も経て、ぼくがATPとの作用性を見つけ、中村先生のコラムを秋葉さんが読んで、当時中村先生と同じラボで先輩か同期の学生が研究していた鎮痛作用の作用メカニズムの提案としてやってきたという不思議な縁である。浅井博士の著書でいうところの『天の配慮』であろう。⇒(まだ読んでおられない方は浅井一彦著『ゲルマニウムと私』をぜひ読んでいただきたい)
当時、中村先生の研究対象はATP受容体であるP2受容体ではなく、本来はアデノシン受容体のA1受容体であったが、我々の依頼を快く引き受けてくださり、マウスを使ったアサイゲルマニウムのATP受容体を介した鎮痛作用検討を実施してくださることになった。
しばらくの月日が流れ、中村先生から実験がポジティブな結果であったことの連絡を頂いた。先生が実施されたのはATPそのものではなく、ATPの類似化合物で、分解されにくいαβメチレンATP(以下略してメチレンATP)というP2X3の作動薬で評価した結果で、アサイゲルマニウムとともに注射すると、このメチレンATPの引き起こす痛みの耐性低下を解除するというものだった。つまり、アサイゲルマニウムは水の中でメチレンATPと結合できるので、P2X3受容体に結合して痛みのシグナルが発生するのを阻害するという結果である。ちなみに、P2受容体にはXタイプとYタイプが存在し、それぞれに10種以上のサブタイプというのが分かれていて、XやYの後に数字としてくっついている記号で表されている。いずれもATPに反応するが、タンパク質の形やATP以外に応答するシグナルが異なり、存在している細胞の種類によって異なる応答をすることが知られている。タンパク質の形が違うので、これを作動させる化合物の形も異なっていて、メチレンATPはP2X3に反応するが他のP2XやP2Y受容体は応答しない。そのため、メチレンATPの信号に対して起きる反応を抑制するのは末梢の外部からの侵襲に寄る痛みを抑制することを意味する。
さらに、この結合がアサイゲルマニウムの持つ水酸基によって起こることを確認するため、浅井ゲルマニウム研究所で合成したアサイゲルマニウムの水に溶けた構造THGPにある3つの水酸基(―OH)をATPの水酸基と反応できない3つのメチル基(-CH3)に置き換えた化合物(3-トリメチルゲルミルプロパン酸;略名TMGP)でも同様の実験を行ってもらった。その結果はTHGPでは痛みの耐性が阻害されたが、TMGPでは全く阻害されず、むしろやや耐性を下げる結果だった。つまり、アサイゲルマニウムが末梢神経の痛みを抑制するのにはTHGPの水酸基が必要であるということ。そして、火傷の時に細胞が壊れて飛び出すATPとTHGPの結合が痛みの発生を抑制するのだろうと考えられた。ぼくと秋葉さんが考えていた火傷の痛み抑制のメカニズムはこれで説明が付きそうだということになる。
このことを二度目の福山大学訪問で中村先生とディスカッションし、その後に秋葉さんと意気揚々と帰り道に語り合ったのを覚えている。秋葉さんは、「分子反応のNMRデータと動物実験のin vivoデータがあるから、あとはこれを結ぶ細胞実験の結果があれば完璧だねぇ。なんとか細胞の実験をおやりなさいよ。そしたら一流ジャーナル掲載間違いなしだろう」と言っていた。
そこで、細胞実験について井上先生に頼らずに何とかできないかと考えた。P2受容体の文献を読み漁り、P2X3受容体の強制過剰発現細胞(遺伝子を組み込んで受容体のタンパク質を多量に作らせている)があることを知った。また、神経細胞の初代培養によってもP2受容体の検討を行うことができそうだと知った。2005年の春のことだった。すでにATPについて取り組み始めて7年ほど経過していた。
6.痛みの細胞実験への挑戦
まずは、出身の大学の獣医学科の同級生と連絡し、牛の解剖の時に神経節の組織をとって送って欲しいと頼んだ(この同級生、今年2023年の春に教授として母校に赴任したようだ帯広に会いに行こう(笑))。組織学の教科書を見ながら神経細胞の初代培養の手法を真似てみたが、全く培養できる細胞は現れなかった。そんなに甘くはないと思ったが、万が一うまく行けば・・・と考えていた。しかし、やはり甘かった(笑)そこで、次に市販の末梢神経初代培養細胞であるラットDRGニューロンを購入した。しかしながら手技が悪かったのか培養容器に接着して培養できた細胞はごく僅かだった。販売元のメーカーに問い合わせたところ、振動などに弱く、培養は困難で、素人に毛が生えた程度のぼくでは難しそうだということだけが判った。
2008年になり、さらに論文を探し、文献を取り寄せては読んでいった。この間、あとの章で記すが、ぼくは大学時代の恩師である大西正男教授の誘いで社会人博士課程という仕組みでドクターコースに在籍し(2003~2006年)、岩手大学連合大学院にて博士(農学)の学位を取得していた。そこで得たノウハウを駆使し、文献検索していった。そして、ケラチノサイトにP2受容体が発現していて、ATPに反応して細胞の中にカルシウム濃度が高くなるという研究成果を発見した。神経細胞は難しかったが、皮膚の細胞ならなんとかなるだろう!と、ぼくは正常ヒト表皮ケラチノサイトを購入し、培養した。細胞の中のカルシウムを蛍光で光らせる蛍光試薬を購入し、これを細胞に取り込ませてから顕微鏡を暗闇の中で覗き、ATPをシャーレに加えたところ、見事に緑色に発光するのを観測することができた!やった、これでATPが細胞表面のP2受容体を作動させるのをTHGPが抑制するか確認できる!
早速、実施してみたところ、THGP溶液を添加した瞬間に発光が暗くなるように見えた。そこで、逆の順番でTHGPを先に添加しておいてみたところ、ATPを加えてもあまり発光が強くないことが判った。
このデータを数値化しなければデータ発表はできない。だが、研究所には細胞内の蛍光強度を精密に分析するための装置がない。
浅井ゲルマニウム研究所は、この当時営業停止からのダメージが大きく、極めて認知が低かったため、いわゆる経営状況が悪かった。収入は相当少なく、長く赤字の状態であったために研究費を十分に出すことはできない、ひたすら節約するように・・・という時期だった。もっとも今もあまり改善しているとは言い難い。細胞を使った精密研究に必要な機器は当然非常に高額である。しかし、なんとか今ある装置で行おうにもスペックが違いすぎるし用途も異なるためマッチングしない。
そんなとき、とある大手企業関連の会社が”まさに”必要としているタイプの蛍光プレートリーダーを持って営業にやってきた。そこで、ダメ元で貸出について打診してみた。
その結果、TESTデモ機があるので、二週間程度なら貸してくれるということになった。借りる日程にスケジュールが合うよう細胞を増やし、分析用の培養容器に細胞を植え付け、二週間の間にATPによる細胞応答の蛍光検出を行い、THGP添加による抑制を試しに実施してみた。これが見事に蛍光のシグナルをTHGPが減弱し、ATP受容体がATPを受けて細胞内に伝える情報(ここでのターゲットは痛みの情報)を弱められることが確認できたのだ。
ただし、この装置は手作業で反応溶液を加えて混ぜなければならず、瞬時の応答性に関しては蓋を閉める間や機械のセッティングの間は観測できない。結局は更に高スペックの同様の分析装置で試薬の自動分注装置を備えた機械で分析しなければ論文にすることは不可能だ。
2023年6月15日(第5&6話)更新 つづく
7.生体物質との反応形態の構造確認
さて、痛みの減弱されるメカニズムは発痛物質であるATPとの結合が関与していることが示されてきた。すでにNMRの分析で反応形態の推定構造は示されている。浅井ゲルマニウム研究所研究部の化学合成部門の長年の研究で、糖類との反応性が調べられ、シスジオール構造(炭素共有結合を持つ有機物質の2つの並び合うそれぞれの炭素に、平面に対して同じ向きで存在する2つの水酸基がある構造;図を参照)とTHGPが脱水して結合することが明らかにされてきた。このことは誰も疑わない程に研究を重ねてきたことだ。しかし、この頃に副社長の佐々木さんが研究部の研究を一部面倒見ていて、時折ディスカッションしていた。ある時この反応に対して一つの疑問を投げかけた。それは結合している時の構造を化学系の先輩たちが記すとき、必ずTHGPを環状の分子として書くことであった(下図左側B参照)。

Nakamura et al., Future Med. Chem., (2015) 7(10), 1233–1246より引用
THGPは先に示した通り、ゲルマニウムに3つの水酸基が結合し、さらにプロパン酸という有機酸が共有結合で結合している。このプロパン酸は炭素3つの鎖の先にカルボキシル基という=Oと-OHが結合しているのだが、錯体分子反応は酸アルカリでいうと中性で反応するので、仮にナトリウムリッチな溶液中の時にはこの-OHは-ONaとなる。このO(酸素)がゲルマニウムの方に巻き込んで、C-O-Geという結合になって、外れたナトリウムイオン;Na+をゲルマニウムの近傍に書き込むのだ(図を参照のこと)。佐々木さんが指摘したのは、何故この場合に輪っかで環状に書くのか?というものだった。
ぼくは、最初からそういうものだと聞いていたので疑問にも思わなかったが、佐々木さんは観てきたのか?とまで毒づいた(笑)それに対して、担当者だった佐藤克行さんはタジタジしながらも説明してくれたのは、最もリーズナブルな構造であり、ゲルマニウムが持っている空の電子軌道に電子が入り込み5配位になる(ゲルマニウムに結合する結合手が5本になり5つの原子とつながる)ことができ、通常の4配位よりも電子状態が変化して脱水しやすくなるということだったように思う。けれども、それは有機化学のエキスパートには容易に理解できるのかもしれないが、ぼくには少々難しく、腑に落ちる感じがなかった。単にぼくが理解力に乏しいだけだったのだが・・・。
これを切っ掛けに、この“観てきたのか?”という問いに応えたい気持ちが増した。
それからは、結合の視覚化に熱中した。というのは、分子は固体として単結晶を得られればX線構造解析によりX線の回折現象から構造確認できる。つまりTHGPとシスジオール構造を持つ分子が結合している単結晶が作れれば、この結晶を単結晶X線回折構造解析装置にかければ目に見える(視覚化)わけだ。
アサイゲルマニウムすなわちGe-132の構造もこの手法を用いて確認され、1971年に化学系の学術誌としては最高峰の米国化学会誌;JACSに掲載されて世界デビューしている。ぼくも誰からも文句を言われないためには実際に結合している姿を提示することだ!と信じて結晶作りに励んだ。
目標とするのは無論ATPとTHGPの錯体結晶である。ATPとTHGPのナトリウム塩(Ge-132を水酸化ナトリウムで中和した乾燥物)との同じ分子量(モル数ともいう)の水溶液を作り、濃縮してから容器に入れて静置して結晶化を待つ。出てくるのはドロドロとしたシロップ状のものばかりだった。文献からATPの結晶はマグネシウムとの錯体で得られていることを知り、この手法も真似た。しかし、結晶は得られなかった。
もっと強力に結合する相手分子なら錯体の結晶を得やすいのではないだろうか?と考え、ATPではなくエピネフリン(アドレナリンともいう;日本の高峰譲吉が発見したホルモン分子で極めて著名なので知っている方が多いだろう)に変えて調製してみた。しかし、この液体は結晶化を待っている間に焦げ茶・・・っぽい黒色に変色してしまう。エピネフリンのカテコール部分が非常に酸化されやすく、中性からアルカリ性では容易に溶存酸素が反応して重合体になってしまうためだ。少しずつ条件を変え、多くの水溶液を作りつづけた。そんな2010年11月のある日、冷蔵庫に入れていた調製液体の一つにキラキラと結晶が出てきていた。面倒になってTHGPのナトリウム塩ではなく、アサイゲルマニウムの粉末そのものをエピネフリンに混ぜた液体だった。エピネフリンは構造中にアミンという塩基を持っている(このためカテコールアミン類に分類される)。Ge-132は酸なので中和されて中性になるだろうと思ってやってみたのだ。結晶の出た溶液をpH測定してみたところ、やや酸性のpH4であることが判った。数多く行ううちに、面倒になり“うっかりして”アルカリ中和していないものを使ったのが結晶化の条件だったのだ!!ここにも天の配慮があったように感じる。ぼくの面倒くさがる性格・うっかり屋の側面をも、結果として成功に導いていただいたのだ。
この結晶入りの水溶液を顕微鏡で覗いてみた。今までに観たことの無い形の結晶で、恐らくアサイゲルマニウムの結晶ではないだろうと推定された(下結晶写真参照)。

Nakamura et al., Future Med. Chem., (2015) 7(10), 1233–1246のSupplemental Figureより引用
ただ、酸性物質とアルカリ性物質の反応でもあるので、まだ中和塩の結晶(つまり錯体ではない)の可能性も残っていた。
分量を増やし、単結晶X線回折が行えるサイズの結晶を作り、約0.3mm大の結晶を得た。この結晶は一度析出するとエタノールにも水にも溶けにくい性質であることが判明した。
まず、社内で確認できる方法でこの結晶を評価することにした。固体の光学的性質を確認する赤外吸収スペクトル分析法だ。結晶粉末を集めて臭化カリウムKBrと一緒にタブレット状に押し固める。これを機器にセットし赤外線領域の吸収波長を調べる。この分析では各化合物は結合の種類によって異なる赤外吸収を示すので、固有の吸収スペクトルの波長になる。つまり、Ge-132もしくはエピネフリンの固有の吸収スペクトルがあれば、どちらかの結晶体ということを示すし、どちらのものとも一致しなければ新たな反応物の結晶ということになる。結果は後者であり、Ge-132やゲルマン酸(ゲルマニウムと酸素の結合がある化合物の総称)の特徴であるGe-O-Geの800cm-の強い吸収が観られなくなっていた。このことはGe-O―Cという結合に置き換わっている可能性を強く予感させるものだった。
大きめの全長約0.2mmの単結晶を協力関係にあった東京薬科大学中央分析センターの深谷晴彦先生に分析していただき、この結晶がTHGPとエピネフリンの1:1で反応した錯体結合分子であることが証明された。そして、このページに示したようにエピネフリンの伸ばした酸素の両手とTHGPが持つGeの結合する3つの酸素のうち2つがお互いの両手を握りあったような構造が美しく立体的に重なって結晶化していることが示されたのだ。さらに、証明しようとしていたTHGPの環状化が見事に示されていて、環状化したプロパン酸の鎖は酸素の部分でGeとつながっており、結局Geに4つの酸素と元々のプロパン酸の炭素が結合した、トータル5原子が結合する5配位状態(超配位結合分子)であることが明確にされたのである(下図論文中錯体X線回折による構造図参照)。

Nakamura et al., Future Med. Chem., (2015) 7(10), 1233–1246より引用
かくしてアサイゲルマニウムの水溶分子であるTHGP(すなわち私達の身体の中で作用している分子)が、普段から身体の恒常性維持のために働いている生理活性を持つ分子群と水分子の脱水・加水による平衡反応の絶妙なバランスによって機能調整しうることが明らかになった。なお、THGPとエピネフリンの結晶が析出することのできたpH4という酸性状態の環境は、身体の中では唯一胃酸による極度の酸性化がある胃内だけである。その意味で、たとえアサイゲルマニウムを多量に摂取しても体内で何かの物質と結合することで結晶化してしまうこともないと言える。
この時は、結局アドレナリン(以降はエピネフリンではなくアドレナリンと表記する)とノルアドレナリンが同様に結晶化できた。しかし、ATPについては結晶化に至らず、この時から7~8年後になって、後輩の島田くん(現研究部部長)がシトシンというATPと同じ核酸の類縁化合物とTHGPの錯体結晶化に成功してくれた。
そこで、先に細胞実験のところで出てきたヒト表皮ケラチノサイトでアドレナリンの添加実験も行ってみたところ、同様にカルシウムイオンの流入が細胞内に生じることが確認できたので、THGPを添加してみたところこの反応が強く減弱され、その抑制効果は濃度依存的でありATPと同様であることが判明した。
8.アサイゲルマニウムの生体内分子との作用性研究論文
以上の結果、①アサイゲルマニウムの水溶単分子であるTHGPはアドレナリンと結合する反応が結晶化で明らかになったこと②その反応部位であるシスジオール(正確にはヴィシナルジオールという)構造を持つ分子であるカテコールアミン類および核酸類とTHGPの水中での結合はNMRで確認し、濃度依存性があること③この反応で細胞に対する細胞外からの細胞間情報伝達を受容体への結合機会を錯体形成が減らすことで抑制されること④ATPは痛みのシグナルになっているのでマウスの末梢神経でのATPによる痛みはTHGPで緩和されること。という①~④のストーリーでまとめて論文化し、科学ジャーナルに投稿するという段になった。
時は既に2012年・・・始めた時の1997年から15年が経過、そして福山大学の中村明弘先生がマウスの実験でATP受容体を介した鎮痛を明らかにしてくださってからでも7年が経過していた。
そして・・・中村先生は既に大学を移られ、昭和大学の教授に就任されていた。論文投稿の相談をしにアポを取り大学に伺ったが、中村先生は教育の立場に専念されて研究はすでに行っておらず、「共著にしなくて良いです」とのことで、「そもそも元のアイデアは浅井Ge研からのものであり、それを委託で受けたものだからデータは自由に使用してもらって構わない」とのことだった。折角の明快な研究成果であったのに、特許の模索とか他の分子レベル・細胞レベルの研究に時間がかかってしまったので、現状の先生の立ち位置と合わなくなってしまったわけだ。これは非常に残念に感じたが、査読論文として投稿したときに査読者(Reviewer)からの質問があったら詳しく答える事ができないし、一部再試験することも叶わない。ぼくの出した結論は投稿する研究論文にはマウスのデータを入れ込まないという判断だった。上記①から③に至る分子・細胞の研究として、基礎的な内容を固め、応用的な研究の足がかりとしてもらう論文にすることにした。
とにかく、薬事法告発前の“アサイゲルマニウムを何の作用もないニセ薬だと記した人々に対する科学的エビデンスによる反論の狼煙”であり、二度と生体にとって意味のない物質だと考えられないように状況を整えること、それがぼくの目指す最重要なことだった。
ぼくの内心は、実際は以下が強かった。
アサイゲルマニウムは、
多くの健康面での困難を抱えた人々への希望の物質であり、実際に大きな有用性のあるものであったのに、悪意のある人々と、その悪意を受け入れるしか無い社会によって抹殺されかけたことへの怒り。
人々の健康のためと思い努力して働いてきた社員たちの思いを踏みにじり、会社の収入を途絶えさせて社員への給与にも極めて大きな影響を与え、総収入の著しい減額へと導き、社会的な立場も “薬事法違反をした会社の人たち” というレッテルを貼られたことへの憤り。
そんな状況をもたらした原因となる悪意の人物の言うなりに、大した取材もせずにゴシップ記事として人々の洗脳を行う碌でなしのマスコミへの不快感。
簡単に騙されて真実から遠ざかり、メディアが言っていることを鵜呑みにする人々の情けなさへの残念感。
…こんなところだった。
この15年間・・・いやさらに今後も含め、どれだけぼくたち浅井研のメンバーの生涯収入が減らされたのだろうか。
ぼくがこの論文を世に出すのは、
①このようなネガティブな過去に一矢報いること。
②これほどまでに単純な構造であるにも関わらず多彩な生理作用に影響し、人々の健康に貢献できるものが"知られずに埋もれていて"、此処にそれが存在すると知らせること。
③この物質を世に創製し、人類救済を目指した浅井一彦先生の"VISIONを再興するための基礎とすること"。
そのためのものだった。
結局、論文をまとめ、イギリスのFuture Medicinal Chemistry誌に掲載になったのは2015年のことで、さらに2年ほど経過した後のことだった(FMC, Nakamura et al., 2015;前項7.に掲載の図はこの論文より引用)。自分の才の無さを嘆く(汗)
ぼくはこの時、目指してきたもの、自分の行うべきことと考えてきた最も大きなものを達成してしまった。そして、燃え尽き症候群になった・・・。実際に会社の後輩にも"何もする気が起きないこと、あとは好きにしてくれればいい"、という考えを伝えていた。きっと、それを聞いたみんなも困ったことだろう。棟方千恵さんに「まだ、これからですよ!」と励ましてもらった?のは妙に印象に残っている。
2023年6月23日(第7&8話)更新 第三章完結
この記事が気に入ったらサポートをしてみませんか?
