
【高校生物】代謝①「酵素とは何か?」
~プロローグ~
ブフナーは酵母を磨砕し、無細胞アルコール発酵を実現して見せた(生きた細胞の中でしか起こらないと考えられていた反応を起こして見せた)。ブフナーはそこで働いた酵素をチマーゼと命名した(実際は、チマーゼは単一の酵素ではなかった[チマーゼは酵母抽出液中のアルコール発酵に関わる一連の酵素群である。十数種類の酵素と、数種類の補酵素などが含まれる])。ブフナーの発見以降、生化学が急速に発展し、生体内で起こる反応は「神秘的で超自然的な現象」ではなくなっていった(生物だけが、本来起こり得ない反応を起こす特別な力を持っているという考えは、一見、常識的に思える。たとえば砂糖の自然な分解には数世紀かかるが、我々は日常的に砂糖を分解する)。ブフナーは、1907年ノーベル化学賞を受賞したが、1917年、第一次世界大戦において、野戦病院で負傷し、戦死した。
★テストに出やすいワード
①活性部位
②活性化エネルギー
③酵素-基質複合体
④基質特異性
⑤競争的阻害・非競争的阻害
要点:酵素は生体触媒として働く。
● 酵素は、生体内での化学反応の触媒として働くタンパク質である(酵素は生体触媒と呼ばれる)。
雑談:通常、酵素が存在することで、反応の速度が1000~100000000000000000倍に促進される。
雑談:触媒は、たとえるなら、キューピット役の友人である。AさんとBさんは、心の中で両想いである。ただ、告白には勇気がいるので、2人はくっ付かない。そこで、触媒であるCさんが、「こくっちゃえよ!」と言って2人の背中を押し、2人が違う関係へと変化するためのエネルギー的な障壁を低くする。すると、AとBはAB(生成物。カップル)となり、安定する。確かに、10年待てば、AとBは自然に反応したかもしれない。しかしそれでは高校生活は終わってしまう。触媒であるCは、その反応が起きるのを早めたのである(冗談です)。

雑談:触媒は平衡定数に値を変えることはない(平衡点を変えない)。すなわち、反応が平衡に達した時の基質と生成物の濃度のバランスは本質的に変わらない。触媒は、平衡に達する速度のみを変える。
● 酵素に関する2つのグラフは必ず理解しておく。
*どちらのグラフも、基質は酵素に比べて過剰に存在する条件で実験を行っている。
(1)横軸:時間、縦軸:生成物濃度のグラフ
「時間が経つと、基質は生成物に変わっていく」ということを表す(時間が経つと、やがて基質がなくなって、生成物がたくさんできる)。
★グラフの水平部・・・基質が消費されてしまった(実際は、水平部では、「E+S⇄ES⇄E+Pの反応が平衡に達している」のだが、入試では「基質が消費されてしまった」と答えてよい)。
下図はイメージ。
*ふつう体積一定で実験を行うので、生成物濃度は「生成物量」と考えてよい。

● 酵素量を2倍にすると、基質がすべて消費されるまでの時間が1/2倍になると考えてよい。ただし、グラフが水平になった時の高さ(生成物濃度の最大値)は変わらない。基質を増やしたわけでもないのに、酵素を増やしただけで最終的な生成物量が増加するわけない(材料[基質]の数が変わっていないのに、料理人の数が増えただけで出来る料理[生成物]の量が増えるわけない)。また、原点における傾き(すなわち初速度)が2倍になると考えてよい。
(2)横軸:基質濃度、縦軸:反応速度のグラフ
「基質濃度が高いと、反応速度は大きくなる」ということを表す(試験管の中に、はじめに基質をたくさん入れておけば、酵素がすぐに基質を見つけることができるので、反応速度[初速度]が高くなる)。
★グラフの水平部・・・すべての酵素が酵素ー基質複合体を形成している。
● 基質濃度が高ければ高いほど、酵素と基質が出会う頻度が増していく。基質濃度が大きくなれば、酵素との出会いの頻度も大きくなり、反応のスピードも大きくなる。

しかし、非常に高い基質濃度の条件では、酵素の活性部位が基質で埋まっていることが多くなり、基質が順番待ちしているような状態になってくる。最大速度の状態では、すべての酵素が酵素-基質複合体を形成しているような状態になる。それ以上高い基質濃度の条件で実験をしても、それ以上(最大速度以上)の反応速度にはならない。
雑談:46人組のアイドルの握手会に10000人並ぼうが1000000人並ぼうが、そのアイドル達が常にファンと握手をしている(すべてのアイドルがアイドル-ファン複合体を形成している)なら、それ以上ファンを増やしても、反応速度(ファンを処理する速度)は上昇しない。

*酵素量を2倍にすると、最大速度(グラフが水平になった時の高さ)は2倍になると考えてよい(たくさん酵素があれば、同時に処理できる基質が増える)。
発展:最大速度と基質濃度
最大速度となる基質の濃度では、酵素の活性中心のすぐそばに常に基質が存在していて、基質が処理されるや否や、直ちに次の基質が活性部位に入り、酵素が働きっぱなしになる。一般に、この時の基質濃度は、酵素の量が2倍になっても同じである(ふつう酵素は基質より少ない。アイドルが酵素、ファンが基質と考えると良い。酵素の周りの基質の混み具合がある「上限」に達すると、酵素は常に酵素-基質複合体を形成している状態になる(最大速度に達する)。そのような「酵素の周りの基質の混み具合の上限(最大速度を与える基質濃度)」は、酵素の数が2倍になってもほぼ変わらない。
*気にしなくてよいが、ふつう、酵素は基質より非常に少ない条件で実験する。酵素の周りには、他の酵素はいない。酵素の周りには基質ばっかりが存在する。

発展:「横軸:基質濃度、縦軸:反応速度」のグラフを描く実験
「横軸:基質濃度、縦軸:反応速度」のグラフは、様々な濃度の基質の溶液を用意し、そこに一定量の酵素を加え(酵素は基質よりも少量)、反応の初速度を測定して作成したものである(縦軸は本当は「反応の初速度」とした方がよい)。

発展:反応速度の測定
反応速度は、ふつう初速度(反応開始直後の反応速度)を測定する。酵素のゆっくりとした変性や、反応生成物による反応の阻害(負のフィードバック作用)を無視できるためである。
反応の初速度は、「横軸:時間、縦軸:生成物濃度」のグラフの、反応開始直後の時間における(原点における)接線の傾きである。
*反応速度=⊿(生成物濃度)/⊿(時間)
*最初の傾きが初速度。
*微分を習っていないという人は、「生成物が増えようとする勢い」が反応速度と思ってよい。接線の傾きが急なほど、短い時間で生成物がたくさん増えようとしている。初め(時間=0の時)の接線の傾きが初速度(反応開始時の反応速度)である。

講義動画【酵素に関するグラフ】
問題:酵素濃度、基質濃度一定で反応を開始させたところ、以下の点線のようなグラフが得られた。なお、縦軸は生成物の量、横軸は時間である。さて、他の条件は同じにして、酵素量を2倍にすると、どのようなグラフになるか。最も適切と考えられるものを選べ。

答え:②(基質の量を変えていないので、最終的に生じる生成物量は変わらない[①のようにはならない]。また、酵素量を2倍にすると、初速度、すなわち原点における接線の傾きが2倍になる。まあ、そこまで考えなくても、酵素量を上げているのだから、生成物が増える勢いが大きくなることはわかるだろう。傾きな急な②を選ぶ。)
問題:酵素濃度一定で、様々な基質濃度において反応を開始させ、それぞれ初速度を測定したところ、以下の点線のようなグラフが得られた。なお、縦軸は反応速度、横軸は基質濃度である。さて、他の条件は同じにして、酵素量を2倍にすると、どのようなグラフになるか。最も適切と考えられるものを選べ。
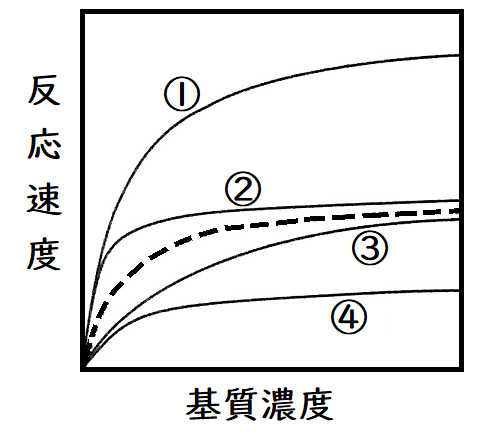
答え:①(最大速度が2倍になる。酵素量が倍になると、十分な基質濃度の条件で下図のような状態の酵素が増えるわけだから、反応速度は上がる)

(3)酵素ー基質複合体
● 酵素の活性部位が基質と結合している状態のものを酵素ー基質複合体という。

雑談:実際は、酵素と基質は、鍵穴と鍵のような、(形が固定された)かたいものではない。現在では、基質が結合すると酵素の立体構造が変化すると考えられている。下図を見よ。基質A-Bの結合が酵素のコンホメーション(三次元的立体構造)の変化をもたらし、その結果、AとBの間の結合にひずみが生じて、その切断が容易になる。

(4)酵素は活性化エネルギーを小さくする。
● 酵素は、活性化エネルギーを小さくすることで反応を進みやすくしている(あまり深く気にする必要はない)。

*高校生はあまり厳密に考えなくてよいが、物質が反応するためには、乗り越えなければいけないエネルギーの壁が存在する。酵素は、そのエネルギー的な壁を低くする。たとえば、紙(セルロース)は、CO2やH2Oになった方が安定。しかし、いきなり紙が燃えだすことはない。それは、安定な状態に移る時に、乗り越えなければならないエネルギー的な壁があるからである。たとえばマッチの火は、そのためのエネルギーを供給する。
● 以下の図で、「どこが活性化エネルギーの大きさか」よく問われる。
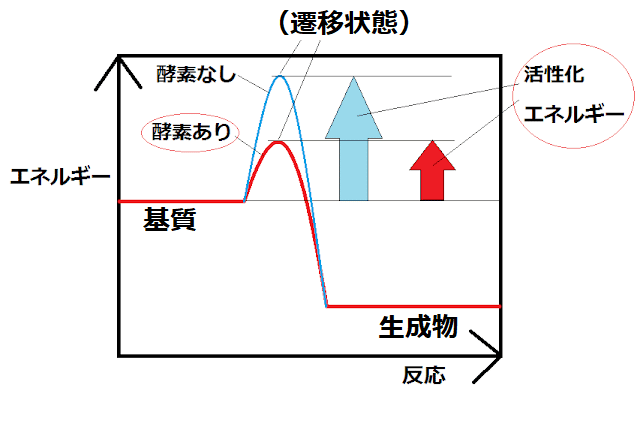
雑談:触媒は、反応物を不安定なものに変換したり、反応における特定の遷移状態(反応物から生成物に至る最も小さいエネルギー経路に存在している原子配置の中で、最も大きいエネルギーをもつ原子配列)を安定化することで活性化エネルギーを下げる。また、反応機構を完全に変えて、活性化エネルギーの小さい別の反応経路を提供することもある。
雑談:活性化エネルギーを定量的に扱うには、大学レベルの知識が必要である。化学反応の速度定数kと絶対温度Tには、以下の関係式が成立する(これをアレニウスの式という。速度定数kの温度変化を表している)。
d(ln/k)dT=E/RT²
ここで、Eが活性化エネルギー(アレニウスの活性化エネルギー)である。いろいろな温度Tで速度定数kを測定することで、活性化エネルギーEの値が得られる。Eは、原系から遷移状態を経て生成系に移る過程で、遷移状態と原系の状態とのエネルギー差に相当する。
高校生はまったく気にしなくてよい。
講義動画【酵素と活性化エネルギー】
(5)基質特異性
● 酵素は働く基質が決まっており、他の基質とは複合体を形成しない。特定の基質のみと反応する性質を基質特異性(きしつとくいせい)という。
*無機触媒は基質特異性がほぼない。
雑談:特異性のイメージは「あなただけ」。浮気な彼氏に「他の子と仲良くするなよ!」と言うと角が立つ場合がある。「あなたは特異性が低いですね。無機触媒ですか?」と言うと知的である(冗談です)。
雑談:それぞれの酵素に備わった高い基質特異性によって、多種類の代謝産物が混在する生体内で厳密に代謝を制御できる。
要点:競争的阻害剤は活性部位に結合する(最大速度は不変)。非競争的阻害剤は活性部位に結合しない(最大速度が下がる)。
● 酵素の働きを阻害する物質を阻害剤といい、競争的阻害剤と非競争的阻害剤がある。
①競争的阻害剤は、酵素の基質と結合する部位(活性部位)に結合し、酵素の反応を阻害する。
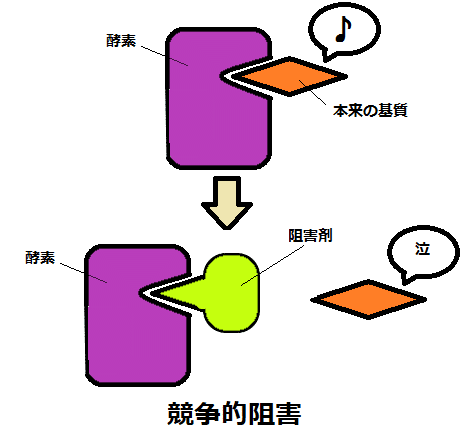
②非競争的阻害剤は活性部位以外の部位に結合することで(酵素の立体構造を変化させ、)反応を阻害する。

講義動画【酵素の阻害】
● 競争的阻害剤は、最大速度は変えない(基質濃度が十分に高い場合、酵素の活性部位は基質で満たされることが多くなり、阻害の効果はなくなっていく[競争的阻害剤は基質と活性部位をとり合うため、活性部位が基質に占められてしまうと、阻害の効果が出せない])。

● 非競争的阻害剤は、最大速度を下げる。
下図はイメージ。

雑談:競争的阻害剤は、Vmaxは変えず、Kmを上昇させる。非競争的阻害剤はVmaxを減少させるがKmは変えない。
*Km:1/2Vmaxを与える基質濃度。
(Kmについては、この講義の下の方に動画がある。受験勉強の最後に学べばよい。)
要点:酵素の主成分ははタンパク質であり、最適温度や最適pHがある。
● 酵素の主成分はタンパク質である。
⇒それゆえ、最適温度、最適pHがある。

● 高温やpHの大きな変動によってタンパク質は変性(性質が変わる)するので、ふつう、酵素は失活する(活性を失う)。
*タンパク質は高温で立体構造が崩れ(熱変性)、ふつう、低温に戻しても活性はもとには戻らない。下図は熱変性のイメージ。

雑談:一度立体構造が崩れ、変性してしまったタンパク質は、冷やしても元に戻らないことが多い。目玉焼き(生卵に含まれていたタンパク質が高温で変性し、性質が変わってしまっている)を冷蔵庫で冷やしても、生卵には戻らないだろう。

発展:タンパク質の変性
ふつう、タンパク質の変性では、一次構造(タンパク質のアミノ酸配列)は変化せず、二次構造・三次構造・四次構造が変化する。その結果、性質が変わる。変性の原因には、加熱、凍結、乾燥、高圧、超音波、紫外線、X線、極端なpHの変化などがある。
● 酸化マンガン(Ⅳ)などの無機触媒は、高温であればある程よく働く。
*酸化マンガン(Ⅳ)は過酸化水素が酸素と水に分解する反応を触媒する無機触媒。

雑談:新鮮なパイナップルはゼラチンを含むデザートに使用できない。これは、パイナップルに含まれるタンパク質分解酵素が、ゼラチン中のタンパク質を分解してしまうからである。しかし、缶詰のパイナップルは、問題なくゼラチンに加えることができる。なぜだろうか?それは、缶詰のパイナップルが加熱されているためである。
問題:酸化マンガン(Ⅳ)のように、過酸化水素を酸素と水に分解する反応を触媒する酵素を1つ選べ。
①ペプシン ②カタラーゼ ③セルラーゼ
答え:②(ペプシンは胃液に含まれるタンパク質分解酵素。セルラーゼは植物の細胞壁の主成分であるセルロースを分解する酵素。)
● 一般的な酵素の最適pHは7。
ペプシンの最適pHは2。トリプシンの最適pHは8。
(周囲の環境によって、酵素の最適pHは異なるという考え方もあるが、高校生は気にしなくてよい)
語呂「焼き鳥にペプシ(焼き鳥の や で8。焼き鳥の 鳥 でトリプシン。 に で2。ペプシでペプシン)」
*ペプシンやトリプシンはタンパク質の分解に働く酵素。

雑談:トリプシンは弱アルカリ領域(pH8.5~9)でリシンおよびアルギニン残基のカルボキシ側のペプチド結合を加水分解する。ペプシンはpH2~4でペプチド結合を加水分解するが、基質特異性は比較的甘フェニルアラニンやロイシンなどの疎水性アミノ酸残基のカルボキシ側をよく切る。
要点:働くために、補酵素を必要とする酵素「も」ある。
● 酵素の主成分はタンパク質だが、タンパク質以外の低分子有機物を必要とする酵素もある。このような低分子有機物を補酵素という。
● 補酵素をもたない酵素もある。
● 補酵素と結合しているタンパク質部分を、アポ酵素という。アポ酵素と補酵素をあわせてホロ酵素という。
雑談:アポは「離れて」、ホロは「すべて」という意味。

● ふつう補酵素は熱に強い。
● 例えばNAD+(ニコチンアミドアデニンジヌクレオチドの略)は脱水素酵素に含まれる補酵素である。
雑談:ビタミンなどが補酵素の材料になる。
● 補酵素の多くは『透析(とうせき)』という実験法によってアポ酵素と分離できる。
*透析:セロハン膜などの半透膜(低分子物質は通過できるが、高分子物質は通過できない膜)を利用して、高分子物質を含む溶液から低分子物質を分離・除去する操作。
高分子物質の例:アポ酵素(タンパク質)
低分子物質の例:補酵素
下図は透析のイメージ。

雑談:下図のように、袋の外の溶液を連続的に新しいものと交換すれば、すべての低分子量の不純物は袋の内部から除去される。

発展:補因子・補欠分子族・補酵素
以下のような区別をすることもある。研究者によっては区別しない人も多い(定義に揺れがある)。高校生はあまり気にしなくてよい。
・補因子=酵素などのタンパク質の働きに必要なタンパク質以外の低分子(金属イオンや有機低分子化合物)。補因子は以下の2つに分けられる。
(1)補欠分子族=タンパク質に特に強固に結合した補因子。
(2)補酵素=比較的弱い結合で結合しており、タンパク質から遊離しやすい補因子。
*ただし、酵素の種類によって、同じ補因子でも結合の強度が異なることがあるので、上のような分類は厳密にはできない。
要点:NADHは高エネルギー電子運搬体であり、高いエネルギーを持った電子を運搬する。
● 今は「NADHは食べ物由来の高エネルギー電子を運ぶ」くらいに捉えておけばよい。細かい知識は入試に出ない。呼吸と光合成を学んだ後に、NAD+(およびFAD)とNADP+について復習すればよい。
● 脱水素酵素(デヒドロゲナーゼ)は、基質から電子とH+を奪う(その電子とH+
は補酵素であるNAD+に渡される)。
*脱水素酵素の中には、NAD+ではなくFADをもつものもある(コハク酸脱水素酵素)。
● 脱水素酵素はNAD+という補酵素(多くの脱水素酵素の補酵素はNAD+である)を持ち、電子とH+はNAD+と結合する(NADHが生成する)。
● NADHは脱水素酵素のアポ酵素と離れ、移動できる(脱水素酵素の中には、NAD+ではなくFADを持つものもあるが、FADは脱水素酵素から取り外せない)。
● 覚えなくていいが、NADの正式名称はニコチンアミドアデニンジヌクレオチドnicotinamide adenine dinucleotideという(ニコチンアミドは窒素を含む塩基である。「ニコチンアミド アデニン ジヌクレオチド」は、ニコチンアミドが使われたヌクレオチドと、アデニンが使われたヌクレオチドが繋がったもの(ジヌクレオチド)である、という意味。ニコチンアミドはDNAやRNAには存在しない塩基である)。
● NAD+を酸化型、NADHを還元型と呼ぶことがある。
● 脱水素酵素には、誰から水素を奪うかによって、たくさんの種類がある。NAD+は各種の脱水素酵素に共通する補酵素である。
雑談:以下はNAD+とNADHの構造。覚えなくてよい。

雑談:「触媒系における補酵素の役割は現在のところ大きな論争になっている。…デヒドロゲナーゼ(脱水素酵素)が触媒作用の場所であることを示す多くの証拠が存在している。…補酵素が基質と同じ様式でデヒドロゲナーゼに結合することは疑いもない。しかし、補酵素の機能は他のどのような物質によっても代用することのできない高度に特異的な水素受容体であると考えられる。」D.E.グリーン(1937)
発展:酸化と還元
「物質AからHがはずれた(または酸素と結合した、または電子[e⁻]を失った)」=「Aは酸化された」
「物質AがHと結合した(または酸素を失った、または電子[e⁻]を受け取った)」=「Aは還元された」
とイメージしておけばよい。NAD+はHと結合して(NAD+は還元されて)NADHになる。NADHはHを放出して(NADHは酸化されて)NAD+になる。

雑談:FADも、NAD+と似た働きをするが、大きな違いは、FADはアポ酵素と強く結合していることである(たとえばコハク酸脱水素酵素からFADを取り外すことは普通出来ない。無理矢理取り外すとコハク酸脱水素酵素は働きを失う)。 簡単にアポ酵素から外れるものを補酵素と限定して言うこともあり、その場合は、アポ酵素と容易に分離できないFADは「補欠分子族」などと言う(特に区別せず、NAD+もFADも脱水素酵素の補酵素と呼ぶことが多い)。
*光合成の学習の時に出てくるNADP+も、NAD+と同様に、高エネルギーの電子を運搬する(NAD+は異化に、NADPHは同化に用いることが多い)。
<Q.なんでNADHとかNADPHとか、似たような物質があるの?…NAD +とNADP+は基本的に別々の代謝経路で使われる。NAD+は異化のための酸化剤に、NADPHは同化のための還元剤として使われる。知らなくてよいが、細胞内では、NAD+はNADHより多く存在し、NADPHはNADP+より多く存在している。このように、ふたつの高エネルギー電子運搬体を使い分けることによって、別々の反応を効率よく推進することが可能になっている。下図はイメージ。覚えなくてよい。>
NAD+「誰かの電子を受け取るよー」
NADPH「誰かに電子を渡すよー」

雑談:NADPHは、高校教科書では光合成の単元にしか顔を出さないが、実際は、生物界に広く存在し、ステロイドの生合成反応など、エネルギー的に起こりにくい多くの重要な生合成反応の推進に関わっている。
講義動画【脱水素酵素とNAD⁺】
挿絵:電子を運搬するNADH

要点:アロステリック部位をもつ酵素をアロステリック酵素という。アロステリック酵素の基質濃度-反応速度のグラフはS字形になる。
● 酵素の作用が、基質とは異なる物質(活性部位とは別に結合する物質)によって阻害または活性化されることがある。このような酵素をアロステリック酵素といい、基質とは異なる物質が結合する場所をアロステリック部位という。
雑談:アロがギリシア語でotherを、ステリックがspaceを意味する。基質の結合部位とは異なる部位に活性調節物質との結合部位をもつ酵素という意味である。
● アロステリック酵素は、ふつう複雑な四次構造を持ち、その「基質濃度ー反応速度」のグラフはS字型になる(原理は難しい。高校生はグラフがS字型になることをチェックしておけばよい)。
*アロステリック酵素は複数の活性部位を持ち、その一つに基質が結合すると、他の活性部位がより基質と結合しやすい形に変形するので、グラフがS字になる、とイメージしてよい(ヘモグロビンの酸素解離曲線を思い出すと良い。ヘモグロビンのもつ、「酸素と結合すればするほど、酸素と結合しやすくなる」という性質によって、酸素解離曲線がS字になっている)。


発展:アロステリック酵素とアロステリック部位
アロステリック酵素は、ふつう、いくつかのサブユニットからできており、各サブユニットが、活性部位と、アロステリック部位をもつ。アロステリック部位があることによって、非常に微妙な活性の調節を行うことができる。
雑談:アロステリック酵素の詳細について(高校生は知らなくてよい)
*アロステリック酵素の調節は、様々な特徴から、単なる非競争的阻害とは区別して議論されることが多い。
*アロステリック酵素の活性を調節する物質(アロステリックエフェクター)には、活性化因子も阻害因子もある。
*基質とアロステリックエフェクターは似ている必要はない。
*アロステリックエフェクターが活性部位とは異なる部位(アロステリック部位)に結合すると、活性が変化する(アロステリックエフェクターが結合することで、「基質濃度ー反応速度」のグラフのS字が微妙にゆがむ[繊細な調節が起きている]。これが、アロステリック酵素が様々な代謝経路で用いられている理由であると考えられている)。
*アロステリック酵素は、ほぼすべて四次構造を持つ。
*多くのアロステリック酵素では、1つのサブユニットの変化が他のサブユニットに影響を与える(たとえば、1つの活性部位に基質が結合すると、他のサブユニットの基質に対する親和性が増す)。このような性質がグラフをS字形にする。
*阻害因子はアロステリック部位に結合し、サブユニットの立体構造を、活性が低い型(基質と結合しにくい型)に安定化する。
*活性化因子はアロステリック部位に結合し、サブユニットの立体構造を、活性が高い型(基質と結合しやすい型)に安定化する。
*阻害因子、活性化因子は、グラフのS字を右左にゆがませる(動かす)ことができる。
*下図はアロステリック酵素のモデル。

下図は、アロステリックエフェクターによって、アロステリック酵素の立体構造が変化するイメージ。アロステリックエフェクターがどのように各サブユニットに影響を与えるかについては、色々な理論が提唱されており、酵素によってその仕組みは異なる。

雑談:高校生はあまりアロステリック酵素の細かい話は気にしなくていい。単純なモデルで説明できないアロステリック酵素も多数ある。
ただし、「ある因子が結合することで、構造変化を起こし、性質が変わる」という現象は、生物学的に重要なので、知っておくと良い(たとえばオペロン説のリプレッサー、ヘモグロビンと酸素の結合を思い出そう)。
テストでは、よく「アロステリック酵素」「アロステリック部位」の用語や、「グラフがS字になる」ことが問われる。
要点:酵素には様々な種類がある。
(教科書や問題で目にするたびに確認しよう。今はスルーしてOK。問題や、資料集に出てきたタイミングで復習すればよい。特に★の酵素が出てきたら必ずチェックする。よく問われる。)
雑談:酵素として働くタンパク質の名称の語尾は「アーゼ(-ase)」(ドイツ語読みの影響)で終わることが多い(セルラーゼ、DNAポリメラーゼなど)。酵素以外のタンパク質の名称は「イン(-in)」で終わることが多い(直前の子音によって、「シン」や「チン」になる。カドヘリン、アクチン、ミオシン、ダイニン、キネシンなど)。
雑談:酵素の語尾に-aseを付けるのは、デュクロアの提案による。また、酵素一般をエンザイムenzyme(ギリシャ語に由来。en 中に+zyme 酵母)と命名したのは、キューネである。
(酵素) : (触媒する反応)
アミラーゼ : デンプン → マルトース
雑談:アミラーゼの語源は、ラテン語の「デンプン(アミルム)」より。
マルターゼ : マルトース → グルコース
スクラーゼ: スクロース → グルコース+フルクトース
ラクターゼ : ラクトース → グルコース+ガラクトース
ペプシン(胃液に含まれる) : タンパク質 → 小さいポリペプチド
雑談:ペプシンの語源は、ギリシャ語の「料理(ペプシス)」または消化より。
<Q.どうしてペプシンは細胞内のタンパク質を分解してしまわないの?…ペプシンは、ペプシノーゲン(不活性な状態)として分泌されるから。>
雑談:ペプシンはペプシノーゲン(不活性な状態)として分泌される。そして、胃の中の塩酸によって、ペプシノーゲンの活性部位が表面に露出し、ペプシノーゲンの活性部位を覆っていた小ペプチドが切断される→ペプシノーゲンはペプシンに変換される。少量のペプシノーゲンが塩酸によって活性化されてペプシンになると、そのペプシンが残ったペプシノーゲンを切断し、活性部位を露出させる(活性化させる)。これは正のフィードバックである。
雑談:食物中のタンパク質は立体的に安定な構造をもっているため、消化酵素がタンパク質中のペプチド鎖に到達しにくい。胃酸の強い酸性は、タンパク質を変性させ、ペプチド鎖を露出させる。
トリプシン(すい液に含まれる) : 小さいポリペプチド → さらに小さいポリペプチド
(トリプシンは、動物の細胞接着に関係するカドヘリンなどのタンパク質を壊す実験などで登場する。また、DNAを抽出する実験の時に、タンパク質を分解する酵素として用いる。)
キモトリプシン(すい液に含まれる) : 小さいポリペプチド → さらに小さいポリペプチド
雑学:ペプチダーゼは、さらに小さくなったポリペプチドを、アミノ酸の形にまで分解する(ペプチダーゼのうち、アミノポリペプチダーゼとジペプチダーゼは、残存する大きなポリペプチドをトリペプチドとジペプチド、アミノ酸に分解する。分解産物は、小腸上皮細胞に吸収される。そして、小腸上皮細胞の細胞質に存在するペプチダーゼによって、数分以内にほぼ全てのトリペプチドとジペプチドが単一のアミノ酸へと消化され、小腸上皮細胞の反対側の膜を通って血管に入る)。
リパーゼ : 脂肪 → モノグリセリド+脂肪酸

*胆汁の中にはリパーゼは含まれないが(リパーゼはすい液などに含まれる)、胆汁は乳化によって(脂肪粒子の大きさを小さくさせることで)リパーゼが脂肪に働きかけやすいようにして、脂肪の分解を助けている。
腸管にある、脂肪の吸収に重要な働きをもつリンパ管を乳び管という。
雑談:脂肪酸とモノグリセリドは、上皮細胞内でトリグリセリドとなり、タンパク質やリン脂質などとともにカイロミクロンという粒子を形成する。カイロミクロンはエキソサイトーシスで上皮細胞から放出され、乳び管に入り、リンパ液によって運ばれる。下図はイメージ(血管は描いていない。小腸の内側にはひだがあり、そのひだには多数の柔毛がある。微柔毛は、細胞表面に存在する多数の微細な突起である。小腸の折りたたみ、柔毛、微柔毛をすべて合わせた表面積は、300m²にもなる。表面積を増加させることで、栄養の吸収率を増加させている)。


雑談:高校では柔毛、微柔毛と書くが、一般には、絨毛、微絨毛と書く。
★ペクチナーゼ : ペクチンを分解
(プロトプラストをつくる際に用いる。)
★セルラーゼ: セルロースを分解
(プロトプラストをつくる際に用いる。)
雑談:ジーンズの綿繊維は主にセルロースでできている。セルラーゼを作用させることで、まるで長年はき込んだかのような色褪せた感じを出すことができるようになった(かつては石臼などを使うしか方法がなかった)。
ATPアーゼ : ATP → ADP+リン酸
(ナトリウムポンプの本体は、ナトリウム-カリウム-ATPアーゼという酵素。)
★ATP合成酵素 : ADP+リン酸 → ATP
(酸化的リン酸化[呼吸]と、光リン酸化[光合成]において、ATPを合成する反応を触媒する。呼吸と光合成の単元で登場する。)
トロンビン : フィブリノーゲン → フィブリン
(血液凝固に関与。)
★制限酵素 : DNAを特定の塩基配列で切断する。ヌクレオチド鎖の、糖とリン酸の間を切断する。
(遺伝子組換えに用いる。細菌はウイルスのDNAを切断するために持っている。)
★脱水素酵素(デヒドロゲナーゼ): 有機酸から水素を奪う。
(発酵・呼吸などに関与。)
カタラーゼ : 過酸化水素 → 水+酸素
(呼吸の副産物である危険な過酸化水素を分解する。)
講義動画【カタラーゼ】
★ニトロゲナーゼ : 窒素+水素→ アンモニア
(窒素固定に関与。窒素固定細菌がもつ。多量のATPを使う。)
雑談:ニトロゲナーゼは、鉄-硫黄クラスターをもつ鉄タンパク質と、モリブデン-鉄タンパク質より成る。いずれも酸素によって不活性化される。
ニトロゲナーゼは還元型フェレドキシンより電子を受け取る。その電子は元をたどればNADH(またはNADPH)に由来する。そして、ATPを分解しながら(N2の還元には少なくとも16分子のATPが必要)、N2とH+を還元し、NH3とH2にする(分子状窒素が固定されNH3が生じるとともに、水素ガスが発生する[2H+をH2に還元するために2個の電子が使われ、N2を2分子のNH3に還元するために6個の電子が使われる])。
なお、いくつかの根粒菌は、生じたH2をヒドロゲナーゼ(水素分子の出入りを伴う酸化還元反応を触媒する酵素の総称)で開裂し、N2還元用に電子を生産し、窒素固定効率を上げている。
下図はニトロゲナーゼの働きのイメージ。

ルシフェラーゼ : ルシフェリン+酸素 → 酸化ルシフェリン
(ホタルの発光に関与。名前だけ知っておけばよい。堕天使ルシファーが語源。)
硝酸還元酵素 : 硝酸イオンを還元して亜硝酸イオンにする。
(窒素同化の際、植物の体内で行われる反応。)
亜硝酸還元酵素 : 亜硝酸イオンを還元してアンモ二ウムイオンにする。
(窒素同化の際、植物の体内で行われる反応。)
★脱炭酸酵素(デカルボキシラーゼ): 有機酸から二酸化炭素を発生させる。クエン酸回路で働く。
炭酸脱水酵素 : 炭酸 ⇄ 二酸化炭素+水
(赤血球内などにある。二酸化炭素の運搬に関わる。)
★アミノ基転移酵素: アミノ酸が持つアミノ基を有機酸に移す。
(窒素同化に関与。)
クレアチンキナーゼ : クレアチンリン酸のリン酸をADPに移す。
(筋収縮に関与。出題頻度は低い。)
★DNAポリメラーゼ: DNAを鋳型にDNAを複製
(DNA合成期に働く。好熱細菌のDNAポリメラーゼは熱に強く、PCRで使われる。「ポリ」は「たくさん」という意味。ヌクレオチドをたくさんつなげてDNAを合成する。)
★RNAポリメラーゼ: DNAを鋳型にRNAを合成
(転写に働く。)
★DNAリガーゼ : DNA同士を結合
(遺伝子組換えに用いる。)
アミノアシルtRNA合成酵素 : アミノ酸とtRNAを結合
逆転写酵素 : RNAを鋳型にDNAを合成
(この現象を逆転写という。)
グルタミン合成酵素 : グルタミン酸とアンモニアからグルタミンを合成
(窒素同化に関与。)
グルタミン酸合成酵素 : グルタミンとケトグルタル酸からグルタミン酸を合成
(窒素同化に関与。)
発展:ミカエリス・メンテン式
(以下のミカエリス・メンテン式については、難しいので、すべての単元を学習した後、余裕があったら学べばよい。)
● S(基質)⇄P(生成物)を酵素Eが触媒する単純な例を考える。
● EとSを混合して反応を開始すると、以下のような反応が進行し、Pが生成し始める。この時、Pの濃度はまだ低いので、逆反応(E+P→EP)はほとんど起こらない。
E+S ⇄ ES → E+P
● (ESの形成と分解が同じ速度で起こっていて)ESの濃度が一定となる状態(定常状態)を仮定する(定常状態は細胞内の代謝でよく見られる)ことで、反応の初速度vと基質濃度[S]関し、以下の式①が得られる。
これをミカエリス・メンテンの式という。Vmaxは最大速度([S]が無限の時の初速度の値。酵素が基質で飽和された溶液中での初速度)である。
*初速度を解析することで、酵素のゆっくりとした変性や、反応生成物によるフィードバック阻害の効果を無視できる。
式①

● Km(ミカエリス定数)は、最大速度の半分を与える基質濃度を表している。
● 上の①式を、縦軸にv、横軸に[S]をとって描いても、グラフの曲線はVmaxに漸近的に近づくので、Vmaxを求めることは難しい。
下図はイメージ。

そこで、式①を以下のように変形する。

縦軸に1/v、横軸に1/[S]をとると、直線の式が得られる(グラフにすると下図のようになる)。直線と縦軸との交点は1/Vmaxであり、横軸との交点はー1/Kmになっているので、解析が容易になる。

● KmはESの安定性の尺度である(Kmは酵素の性質をあらわす。Kmが小さいほど、基質との親和性が高いと考えてよい)。
講義動画【Vmaxの測定】
講義動画【Kmの導入】
講義動画【ミカエリス・メンテン式①】
講義動画【ミカエリス・メンテン式②】
まだわかっていないこと
● まだ見つかっていないタンパク質の機能があるだろうか。
● アミノ酸配列(一次構造)から、そのタンパク質の立体構造とはたらきを予想することができれば、有用なタンパク質を設計し、合成することができる(望み通りの触媒作用をもつ酵素を自由に設計することができるとしたら、それは夢のような話である)。しかし、その予想はまだうまくできない。多くの研究者が熱心に突破口を探しているが、「タンパク質がどう折りたたまれるか、どう機能するか」を予想することは非常に難しい。
● アロステリック酵素について、そのはたらきと調節機構は完全には解明されていない。
● 多くの酵素について、触媒作用の機序・機能・性質が完全には明らかになっていない。
