
最初に生体分子の「かたち」を紹介します
実に1年以上ぶりの投稿になります笑(定期読者はいないと思うので更新具合はあまり関係ないかな?)
忘れていたわけではなく,1年ほど前から仕事が軌道に乗って忙しくなったのが一番の理由です.ということにしておきましょう笑
ところで,突然ですが,私は構造生物学者です.
構造生物学とは,生体分子の「かたち」を見ながら生命現象を解き明かす学問です.
多少まどろっこしいかもしれませんが,これから構造について紹介します.
細胞内での生命維持活動の大部分を担っているタンパク質は数百万種類以上あると言われています.それらのタンパク質は原則として「いち分子いち機能(「いち」は漢数字の一)」です.つまり,あるタンパク質は,ある特定の機能を持っていることになります(例外はある).
ある特定のアミノ酸配列が折りたたまれることで特定のタンパク質として特定の機能を持つことになります.言葉にするとややこしいですね笑
「特定の配列 → 特定のタンパク質 → 特定の機能」
配列とは一次構造(線形)なので決まった形を取っていないことを前提に用いる言葉ではありますが,敢えて形を示すとこんな感じでしょうか.

これがタンパク質となるために折りたたまれて三次構造(高次構造)を取ると以下のようになります(一例です.PDB ID: 5H7K)

ここでは見やすくするために,二次構造のαヘリックス構造を水色,βシート構造を赤,二次構造を取っていないループ領域をマゼンタで示しています.
もう一つ,このタンパク質以外に濃紺で示した低分子がくっついているのに気づくかもしれません.
特定の構造をとることにより特定の機能を持った結果,上図のタンパク質の場合,低分子が結合しています.この低分子はGDP(グアノシン二リン酸)といいますが,これは高エネルギーリン酸結合を形成するGTP(グアノシン三リン酸)からγ位のリン酸1個が失われた後の状態です.
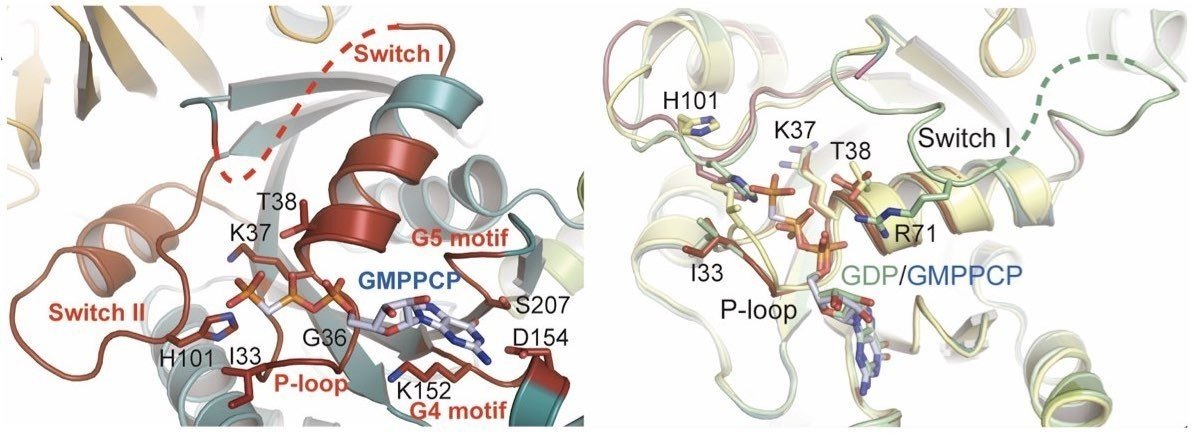
低分子に限らずタンパク質でも核酸でも,とにかく,そのタンパク質と結合するためには,そのタンパク質に他の分子が結合できるスペースやポケット,溝があれば良いというものではありません.下図は上のタンパク質のGTP結合サイトの詳細を示しています.詳しく語るつもりはないですが,GTPやGDPを正しく認識するアミノ酸残基を含め結合サイトの周辺環境(下図左の濃赤色で示した部分)が非常に精巧に整っています.引用論文のリンクは以下に記しています.
おそらく高校生物では,ATPがエネルギー通貨だと習うと思うんですけど,GTPも同様にエネルギー通貨です.細胞内でATPが用いられる領域,GTPが用いられる領域というのが区別されていることもよく知られている事実です.
このATPとGTP,見た目がかなり似ています.実際ATPとGTPの塩基は両方ともプリン環を持っていますし,両方とも三リン酸なので,端から見てるとほんの少しの違いしかありません.ただ,塩基対でA-T(U)は水素結合が2本,G-Cは水素結合が3本であることが知られ,そこが一番の違いになっています(下図の各分子の右上:ATPはNH2とN,GTPはOとNHとNH2)

しかし,この,ほんの少しの違いすらを正確に認識して,今回の例ではGTPは受け入れるのにATPは受け入れないという原子レベルでの取捨選択を正確に行っているのがタンパク質というわけです.
もし私たちが,ATPやGTPのように少しの違いしかない分子構造が描かれたカードを用いて神経衰弱をしたら,何でこの2つに違いがあるのかで言い争いになるかもしれませんね笑
今回紹介したGTP結合サイトのような結合ポケットは,タンパク質が機能するのに非常に重要であるため,大学や製薬業界では,病原性細菌やウイルス由来の生体分子の機能を阻害し,生命維持活動に大打撃を与える(成長阻害または致死を誘導する)ことができると期待して,薬剤・阻害剤のターゲットスポットとして用いることも視野に入れています.
実際に,先に示したGTP結合サイトでは,本論文の著者ら(実は筆頭は私ですが)は,GTPアナログ(GTPに似て非なるもの)としてGMPPCPを用いています.GTP=GMPPOPなので,GMPPCPとは,β位とγ位のリン酸結合の間の酸素原子(O)を炭素原子(C)に置換した分子になります.
GTPは常温で不安定でGDPに分解されやすいことが知られているため,それを防ぐためにGMPPCPを用いていますが,このアナログこそGTP加水分解を起こさせない阻害剤に外なりません.さすがに薬剤としては用いることはできませんが笑(GTPは全生物におけるエネルギー通貨ですので,GTPアナログを投与したその先の未来は想像に難くないというか…)
確かに,創薬ターゲットとして分子の「かたち」を見る,用いることは非常に重要で,現在の一つのステータスであることに変わりありません.しかし,それ以上に,我々の目では到底見ることができないナノ・ピコの世界で繰り広げられる『私,失敗しないので』が引き出す魅力に惹かれるばかりです.
実は,細胞内での反応系では全体的な流れで失敗することは多く知られていますが,失敗したときに補正・修正・リセット・分解する能力が非常に高いのもタンパク質の見所です.おそらく,それが可能なのが「一分子一機能」というルールなのかもしれません.
さて,今回のブログで説明のために用いた構造は,高好熱性古細菌 Pyrococcus horikoshii 由来の翻訳伸因子 Elongation Factor 2(EF-2)のGDP型(実際にはDomain I-IIの断片構造)(PDB ID: 5H7K)です.見出しの画像はEF-2の全体構造にGMPPCPとリボソームタンパク質の一部が結合した構造(PDB ID: 5H7L)です.2018年4月にNucreic Acids Researchに掲載された私の論文(上にリンク有り,オープンアクセスなので誰でも無料で読めます)を基に書いてみました.
因みに,構造はProtein Data Bank(PDB)というデータベース(大阪大学蛋白質研究所が管理している日本版(PDBj)もあるけど中身は同じ)から誰でも自由に取得できます.最近では論文に掲載する構造はPDBへの登録が義務づけられています.下のスナップショットにも「主に研究者向け」とは書いてありますが,構造に興味をもっていただける限り訪問者に区別をつけることはないでしょう.
いつか,近いうちに,非研究者(一般の方や学生)でも名前は知ってるタンパク質の形を見たいときのメソッドをまとめて公開するつもりです.研究ポジションの方々は他に沢山あると思うので笑(自分が出張ると怒られそう)

次回は,この流れで,薬と分子構造について書いてみようかなと思っています.
(久しぶりにブログを書くと気分転換になりますね.こんなご時世ですし)
この記事が気に入ったらサポートをしてみませんか?
