土の元素移動は+とーが決める
前回「最小律」に関わるお話で、土壌の元素の動き方が植物の吸収メカニズムに関わるという話をしました。
では、土の中で元素の移動の度合いを決めるのは一体何なのか。
その一つは+(プラス)とー(マイナス)、つまり電荷が関わっています。
今回はイオンのお話です。
農家の皆さんに身近な電荷:CEC
農家の方なら、一回は土壌診断を出されたことはありませんか?
もし、やったことのない方と非農家さんは診断項目を調べてみてください。
もし、やったことある方は診断項目を思い出してください。
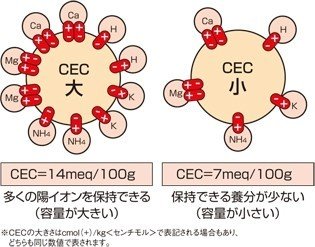
CEC
という項目がありませんか?
CECとは英語で『Cation Exchange Capacity』日本語では『陽イオン交換容量』といいます。
簡単な説明では『土壌が栄養を保持する能力』
正確には『土壌が陽イオンを保持する能力』です。
土が陽(+)イオンを保持するということは、
『土は負(ー)電荷を帯びている』
プラス(+)はマイナス(ー)を引きつけますから、こうなります。
ちなみにAEC(陰イオン交換容量)というのもあります。
しかし、AECは日本の農地で問題になることはほとんどありません。
よって、土は基本的に負電荷を帯びているのです。
さらに土壌診断項目を眺めながら、次にいきましょう。
交換性塩基(陽イオン)の含量はイオン交換反応が決める
と一概に言えませんが、概ね決めます。
土壌診断されたことある方は自分の交換性塩基含量の結果をみてください。
CaO>MgO>K2O
の順になっていませんか?
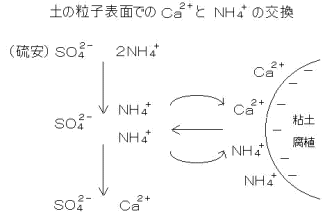
交換性塩基含量というのは『土にくっついている交換性塩基』を表します。
日本の農地はほとんどの場合、こうなっていることが多いです。
交換性塩基と呼ばれる『Ca(カルシウム)』、『Mg(マグネシウム)』、『K(カリウム)』はいずれも陽イオンです。
そのため、土にくっつける元素です。
では、本題のCaO>MgO>K2Oの順になる理由です。
それにはイオン交換反応というものが主に関わっています。
これは土にくっついていた陽イオンが、別のところからきた陽イオンと交換する反応です。
土にくっついていた陽イオンは、外からきた陽イオンと常に交換するのかというとそんなことはありません。
ここには『選択性』というものが関わってきます。
これは、陽イオンとは相対的に
『土にくっつきやすい陽イオン』と『土にくっつきにくい陽イオン』
があるということです。
土へのくっつきやすさは元素の価数とイオン半径が決める
土のイオン交換反応には重要な原則が二つあります。
(1)価数が大きいイオンほど強く土にくっつく
(2)イオン半径が小さい(=原子番号が大きい)ほど土にくっつく
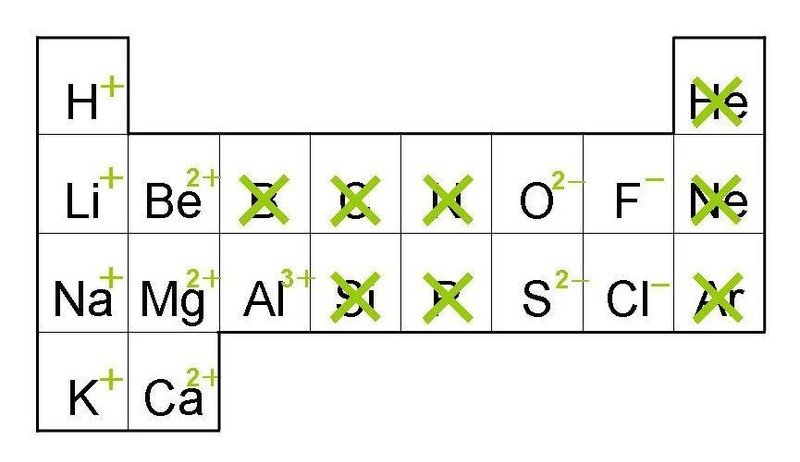
価数とはイオンの+が何個あるかです。
例えば、CaイオンはCa2+なので2価の陽イオン、KイオンはK+なので1価の陽イオンです。
イオン半径と書きましたが覚えなくてもいいです。原子番号が大きいほど土にくっつくということです。
『スイヘーリーベーぼくのふね』の周期表を思い出してください。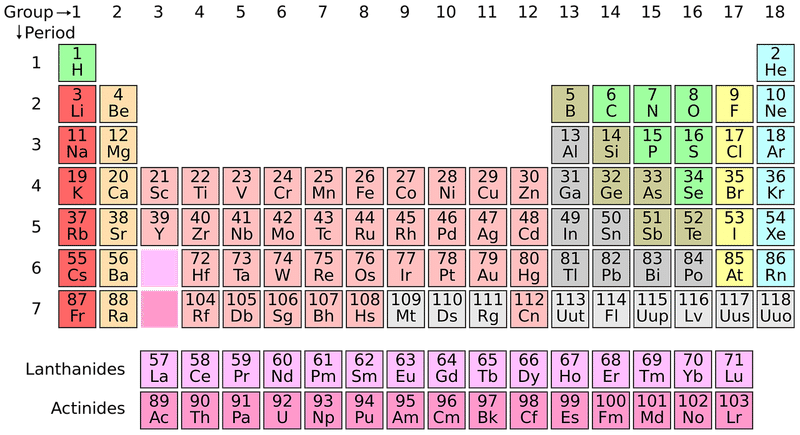
同じ2価の陽イオンであるCaとMgであれば、Caの方が原子番号が大きいです。
交換性塩基含量を考えていきましょう。
CaとMgは2価のため、1価であるKよりも土にくっつく
CaはMgより原子番号が大きいため、Caがより土にくっつく
そのため、土壌の交換性塩基含量はCaO>MgO>K2Oになります。
結びに
(1)土はマイナスの電荷を帯びている
(2)土と陽イオンの間にはイオン交換反応が起こる
(3)イオン交換反応の選択性は、陽イオンの原子番号と価数できまる
+とーという電荷が土における元素の移動の基本原則の1つです。
また、理系の方は『イオン交換樹脂』を思い出した方もいるかと思います。
それはそのはずで、1845年に土でイオン交換の現象が見つかったことが、イオン交換樹脂の開発に繋がっているからです。
前回に比べると、少し難しめの話でした。
長文にお付き合いいただきありがとうございました。
わからない点があればご質問にお答えいたします。Twitterでもどうぞ。
この記事が気に入ったらサポートをしてみませんか?