Off Flavor入門〜⑧動きやすい電子と空軌道
前回からの続き
前回は化学反応の基礎の基礎として、求核剤と求電子剤の説明をしました。求核剤から求電子剤の空軌道へ電子が受け渡されることで反応が起こるということでした。今回は電子が移動する条件をもう少し詳しく見ていきたいと思います。
反応が起こる条件
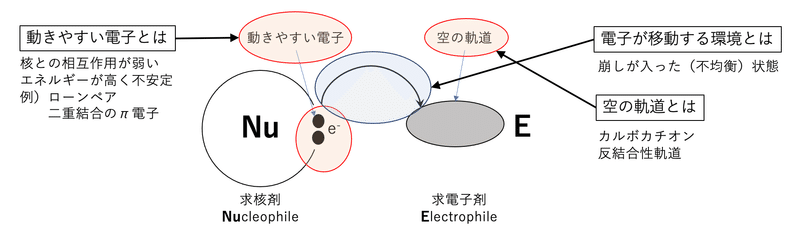
前回の求核剤と求電子剤の図に少し書き足したものです。求核剤から求電子剤への電子の授受はどのような条件で起こるのでしょうか。
求核剤になりうる動きやすい電子
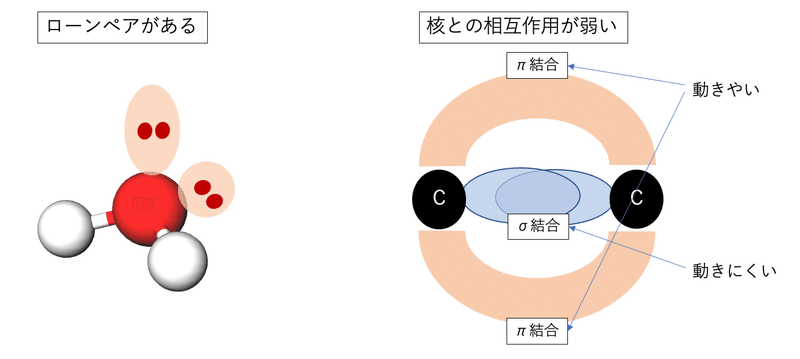
動く側の電子に着目すると動きやすいことが必要です。核としっかり相互作用している電子は安定で動きにくいので、核との相互作用が弱い電子が動くことになります。つまりエネルギーの高い軌道に入っている電子です。具体例をいうと、非共有電子対と言われるローンペアや二重結合のπ電子はよく動いて反応に関係してきます。
ローンペア
非共有電子対、孤立電子対、ローンペアといろいろな言い方がありますが、要するにローンペアとは1つの核としか相互作用していないものを指します。結合性軌道が2つの核と相互作用しているのと対照的です。エネルギー図のイメージは下記のとおり。
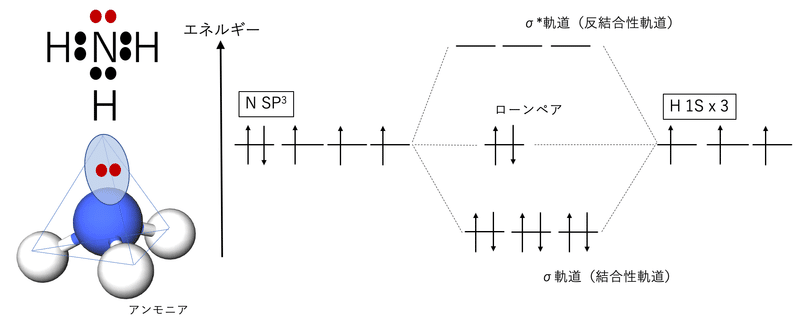
分子軌道というのは、相互作用することで2つの軌道の符号がプラス同士で増幅し合ったり、プラスマイナスで打ち消しあったりするわけです。つまりσ結合の場合は符号がプラス同士ならσ軌道となり元々の軌道よりエネルギーが低くなります。プラスとマイナスだとσ*軌道となってエネルギーが高くなって反結合性軌道になります。ローンペアは2つの核との相互作用がないので元々のエネルギーを維持します。他の結合性軌道のエネルギーが下がっている状況だと、相対的にローンペアのエネルギーが高くなるというわけです。エネルギーが高いので動きやすいです。つまり他にエネルギーが低い軌道があればそちらに移動してより安定になろうとします。
π結合と非局在化電子
正面からがっちり向き合うσ結合と違って、π結合はσ軌道を避けるように横から結合するので核との相互作用が弱く、電子が動きやすいです。
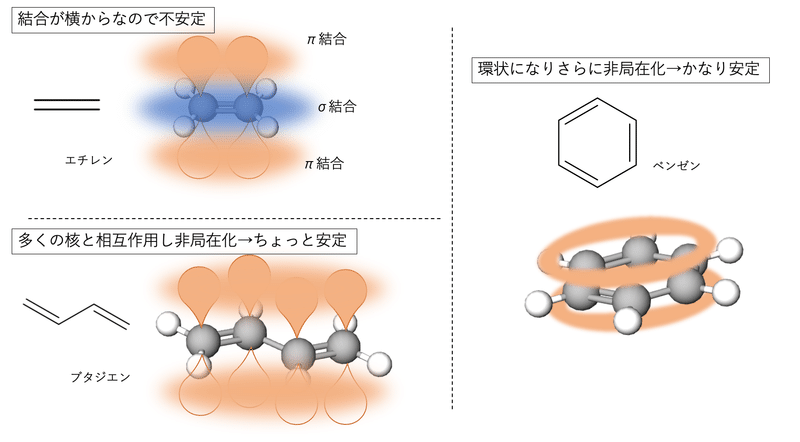
ちなみにπ結合が単結合を挟んで連なると電子の非局在化が進んで、安定します。これを共役(π共役)といいます。ベンゼンのような環状のπ共役になるとかなり安定になるので、単純に電子が他の分子に移動する化学反応は起こりにくくなります。
求電子剤になりうる空軌道
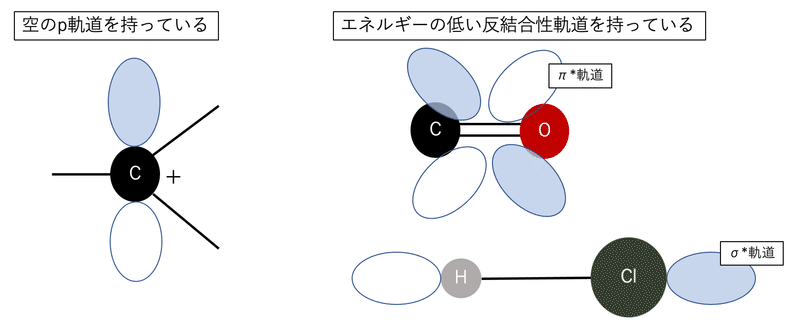
求電子剤になりうるものは空の軌道を持っています。例えばカルボカチオン。これはオクテット則を満たしておらず、p軌道が一つ空のままになっているので分かりやすいですね。軌道というと結合に関係する軌道しか意識されないことが多いですが、反結合性軌道もエネルギーが低ければ求電子剤になりえます。
カルボカチオン
カルボカチオンは化学反応に頻繁に登場します。炭素は4つの手を持っていて通常は結合が4つできるのですが、カルボカチオンは1つ空いた状態です。結合性軌道が一つ空いている状態なので、この軌道にはすかさず求核剤が電子をねじ込んできます。なのでカルボカチオンはもっぱら反応の中間体として登場します。
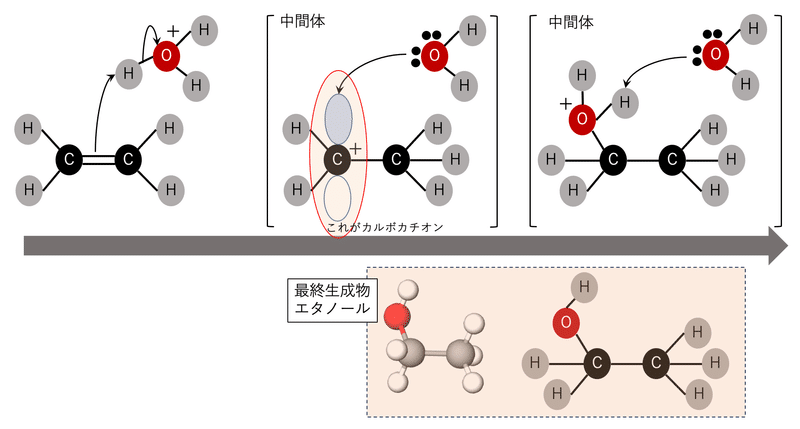
上の図はエチレンと水が反応して、エタノールを生成する反応です。炭素-炭素二重結合のπ電子がヒドロニウムイオンの水素原子を攻撃して、カルボカチオン中間体ができることで反応が前に進む様子が分かると思います。ちなみに実際のビールの中でエチレンからエタノールができる反応は起こらないと思います。こういうのは実験室の中で条件を整えて起こす反応ですね。
エネルギーの低い反結合性軌道
カルボカチオンのように結合性軌道がぱっくり空いて待ち受けている例は稀で、受け手となる軌道は反結合性軌道であることが多いです。反結合性軌道の中でもエネルギーの低い軌道が反応に関係しやすいです。この辺の詳細は次回フロンティア軌道理論で説明しようと思います。
不均衡な状態
電子が移動する環境を考えると、正電荷と負電荷が引き合うクーロン力の影響と、誘起効果のような不均衡があると動きやすい環境になります。
カルボニル化合物が反応の宝庫だということは官能基のときに触れましたが、電子配置を見ると分かりやすいです。
カルボニル化合物の電子の位置
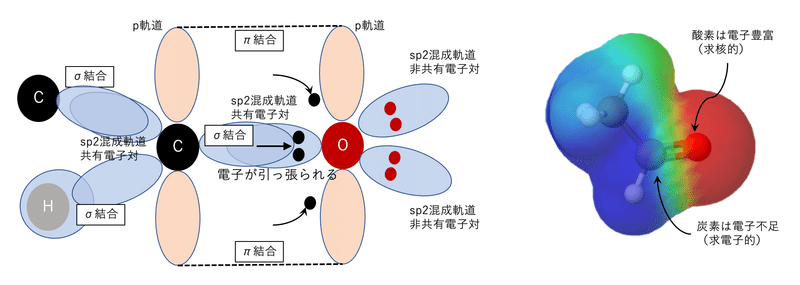
炭素‐酸素二重結合(C=O)のところで電気陰性度の高い酸素が炭素側から電子を引っ張っていて、酸素は電子が豊富で求核的になっており、逆に炭素は原子不足で求電子的になっています。ここに求核剤が炭素を攻撃すると容易に反応が起こることは想像に難くないと思います。
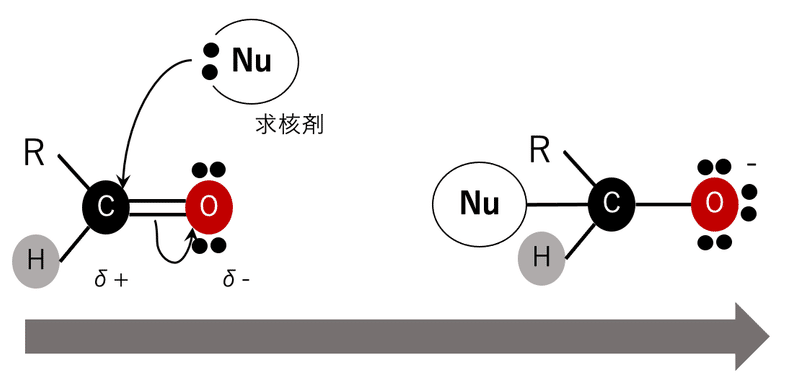
カルボニル化合物への求核攻撃は上の図のように起こります。ちなみに反応前はsp2混成で平面ですが、反応後はsp3混成軌道になり正四面体になります。この後、マイナスに荷電した酸素原子が電子を放出したり、炭素原子に結合している脱離基が抜けて再び炭素-酸素二重結合ができたりします。
誘起効果
不均衡を作る例としてもう一つ誘起効果を挙げます。軌道と軌道が正面から相互作用するσ結合において、電気陰性度の違いから一方の原子に電子が引っ張られて、炭素がやや正(または負)に帯電することを誘起効果といいます。

電子が電気陰性度が高い側に引っ張られてアンバランスになるという点では、カルボニル化合物と同じです。電荷を帯びた炭素が攻撃対象になります。
鉄壁のディフェンスラインを崩せ
またまた識者に怒られそうな無茶な例えをすると、電子が引っ張られるというのは、イメージ的には鉄壁のディフェンスラインに崩しが入る感じです。サッカー、ラグビー、バスケなどでディフェンスの統制がとれている状態だとなかなか破れません。そこに足の速い選手がかき回したり、ボールを大きく動かしたりすると、ディフェンスラインが崩れてギャップができることがありますよね。
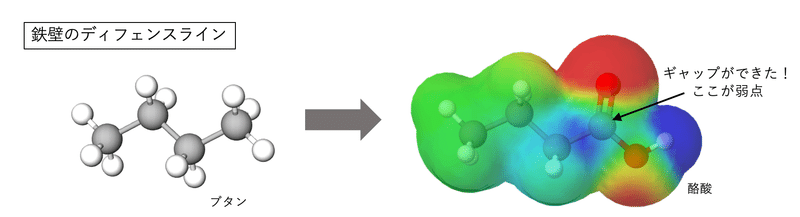
アルカンは反応しづらい安定な化合物だと言いましたが、それは統制がとれたラインディフェンスみたいだから。外から求核攻撃しようにも電子が均等に配置されているので入り込む隙がないわけです。
次回へと続く
今回は求核剤と求電子剤を深堀りして、動きやすい電子や空の軌道についてお話しました。反応を起こりやすくする環境としては、クーロン力や誘起効果があると説明しましたが、実はこれだけでは不十分です。そこで次回はフロンティア軌道理論と軌道の相互作用について触りだけ説明したいと思います。
お読みくださりありがとうございます。この記事を読んで面白かったと思った方、なんだか喉が乾いてビールが飲みたくなった方、よろしけばこちらへどうぞ。
新しいビールの紹介です。国際コンペティションで7つの受賞歴を持つKriek in the Barrelが今年も登場です。毎年楽しみにしている皆さん、お待たせしました。まだ飲んだことがない方もぜひ!

そして定番品リブランディングのお知らせです。「Far Yeast 東京シリーズ」「Far Yeast 源流シリーズ」を終売し、Far Yeastシリーズとしてリブランディングします。発売は6月とまだ少し先ですが、楽しみにお待ち下さい。

この記事が気に入ったらサポートをしてみませんか?
