第2章 微生物叢と妊娠合併症1
SBSK自然分娩推進協会では、ご希望の方にメルマガを配信しています。
今回は、メルマガ50号(2022.06.01)の配信内容です。
しばらく休んでいたThe human microbiome in early lifeの迷訳?を続けます。理解を助けるために再度Chapter2の初めから載せますので、重複しますがご了承下さい。
前回のお話はこちら↓↓↓
助産師の皆さんに役立つ内容に、と考えて書いていますが、すでにご存じの内容もありましょうし、難しいと感じる部分もあるかもしれません。分かりにくいところは飛ばしてもらってよいと思います。
よろしくお願いします。
SECTION⒈ Pregnancy and fetal life
Chapter 1. The microbiome in a healthy pregnancy(終了)
Chapter 2. The microbiome and pregnancy complications
要約:
妊娠中は正常な妊娠、発達、分娩と健康な児を確保するために、解剖、免疫、細菌叢といった複雑な変化が起こる。その複雑さ故にヒトの妊娠は全妊娠の最大60-70%が早産に終わる。
妊娠合併症は珍しくなく、合併症は母体と胎児の健康に深刻な脅威をもたらす可能性がある。妊娠中に変化する微生物因子もまた、その合併症に寄与するというエビデンスがある。
この章では、妊娠糖尿病、高血圧症、感染症、貧血などの合併症、および早期破水、早産、死産などの胎児や胎盤の合併症について説明し、これらの妊娠合併症における食物由来の病原体、膣内微生物組成、ならびに胃腸内微生物叢の役割を探索する。
はじめに:
妊娠には多くの解剖学的および生理学的変化が伴う。それらが受精卵を着床させ、主要組織適合性遺伝子複合体(MHC)の働きを逃れた(ミスマッチ)胎児を成長させ、タイムリーな分娩を保証する。血漿量が増加し、心拍出量、および酸素要求量の増加が見られ、腎および消化管機能の変化も起こる。血小板数の減少、鉄必要量の増加、免疫細胞の存在および機能変化は妊娠の血液学的変化の一部である。
妊婦は広範な内分泌変化も受ける。すなわち甲状腺ホルモンT4およびT3の増加、副腎ステロイドの増加、下垂体におけるプロラクチンおよびオキシトキシン産生、膵臓によるインスリン分泌の増加、および肝臓によるトリグリセライド合成の増加などである。
これらのプロセスはすべて慎重に調節されており、妊娠ホルモンであるヒト絨毛性ゴナドトロピン(hCG)、プロゲステロン、およびエストロゲンがこれらのプロセスの重要な役割を果たす。したがって生物学的に言えば、妊娠は成功した結果を得るために多くのプロセスの統合を伴う非常に複雑なプロセスである。したがって、妊娠中の合併症が妊娠の47%に発生することは驚くには当たらない。アメリカでは2008年に妊娠の16%以上が流産であった。何十年にもわたって医療は向上しているものと我々は信じてきたけれども、実は胎児喪失に終わる妊娠の割合は減少せず、むしろ1990年の15%から2008年の17%に増加している。流産の数を減らそうとするならば、妊娠の結果に寄与する要因をもっと理解する必要があることは明白である。
この章では、正常な妊娠生理に起こるホルモンの免疫学的側面に触れる。次に、妊娠中に見られる最も一般的な合併症について議論し、最後に母親または子供に影響を与えこれら合併症の発生に寄与する要因を検討する。中でも特にマイクロバイオームの潜在的な役割に注意を払う。
1.正常妊娠の生理学
すでに述べたように、多くの生理学的変化が正常妊娠には必要である。最初のステップは妊卵の着床である。これには受容器としての子宮を必要とし、子宮は高レベルの炎症誘導作用のあるヘルパーT1(Th-1)細胞と内膜のサイトカインにより調節される。
着床すると、胎盤栄養芽細胞はヒト絨毛性ゴナドトロピン(hCG)を産生し始め、その血中レベルは妊娠10週頃にピークに達し、その後ベースライン値に戻る。hCGは胎盤の成長と血管新生に重要な役割を果たすが、海馬、視床下部、脳幹の受容体を介して吐き気を引き起こす役割も担っている。さらにhCGは、胎盤におけるマクロファージ活性を低下させることによって免疫を直接コントロールし、母体免疫系による胎児胎盤系の組織破壊を防いでいる。
またhCGは、排卵後の黄体細胞によるプロゲステロン産生を刺激する。プロゲステロンの生合成はエストロゲンによって刺激されるが、これも黄体において最初に産生される。プロゲステロンとエストロゲンの産生部位は、妊娠9週以降は胎盤に移行する。したがって、それらの血中レベルは、第1三半期中に漸次上昇し始め、第3三半期(後期)にピークに達する(図2.1)。
プロゲステロンは、胚着床のために子宮内膜の準備として不可欠だが、妊娠中も妊娠生理学的に貢献し続けている。プロゲステロンとエストロゲンの両方が、胎盤の血管新生、子宮動脈血管拡張、母体血圧低下、胎盤細胞の増殖および分化の調節において重要な役割を果たしている。
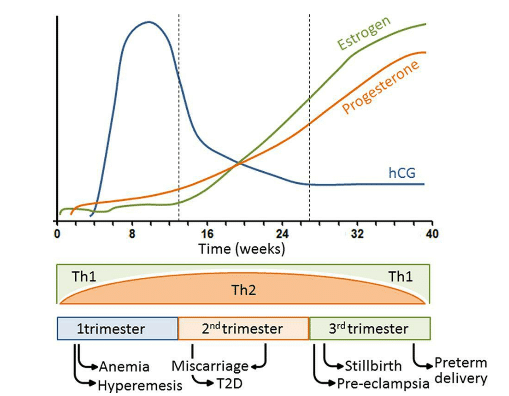
ヒト絨毛性ゴナドトロピン(hCG)レベルは、第1三半期に上昇しその後低下する。対照的に、プロゲステロンおよびエストロゲンレベルは妊娠中に上昇し続ける。妊娠の第1段階は、胎児母体境界面におけるTh1炎症誘発性プロファイルと関連しているが、成長中の胎児を母親の免疫学的攻撃から保護するために、Th2免疫プロファイルへのシフトが起こる。その後分娩に向けて炎症過程が再び必要とされ、Th1システムが再び観察される。よって妊娠期間中は様々な合併症が発生する素地がある。
2.妊娠中の性ホルモンの免疫学的役割
受精卵の着床は、受精卵が内膜に侵入することであり、炎症誘導環境が必要である。早期に侵入する免疫細胞の大部分(70%以上)はナチュラルキラー(NK)細胞とマクロファージ(M)で、これらの細胞は、栄養芽細胞の周囲組織への侵入や血管新生のための炎症誘導環境を作り出す。その他にも、着床部位にはIL6、IL8、TNFαなどの炎症誘導性のサイトカインが特徴的にみられる。これらはTh1細胞により産生される(が第1三半期の胎盤にみられる先天性リンパ様細胞によっても作られる)。
妊娠後半になると逆にNK細胞数が減少し、マクロファージは炎症型(M1)から創傷治癒型(M2)に交代する。M2マクロファージは抗炎症性サイトカインIL10を供給する。これらの細胞は、特殊な酵素を産生し制御性T細胞(Tregs)を増加させる。
父親の抗原による母体免疫系の活性化は有害であるため、妊娠を成功させるためには、主要組織適合性遺伝子複合体(MHC)からの攻撃を逃れたミスマッチ胎児に対する免疫寛容は不可欠である。この一部は、炎症性Th1から免疫寛容性のTh2プロファイルへの変更による(図2.1)。
妊娠中の免疫プロファイルの変化の大部分は、性ホルモンによって調節される。hCGは制御性T細胞(Tregs)の早期誘導を促進し、炎症誘導性サイトカインを減少させる。同様に、母親の免疫系による胎児拒絶を防ぐために、免疫系の抑制はプロゲステロンによって、また抗炎症作用はエストロゲンによって行われる。
分娩は炎症シグナルを必要とするので妊娠末期に向かって、胎児 - 母体境界面の免疫パターンは再び免疫活性化へシフトする。ヒト以外の哺乳類では、分娩という用語は分娩前のプロゲステロンレベルに低下することを意味するが、ヒトではそれほど明白ではない。にもかかわらず、炎症仲介物質による子宮頸部の軟化は、分娩の条件として確立されている。
まとめると、ヒトの妊娠中の免疫系は妊娠期間とともに3段階に変化する。
即ち、妊娠初期における炎症誘導型のTh1パターン、これにはNK細胞、マクロファージ、Th1細胞から誘発されるIL6、IL8、TNFαなどが関与する。
その後の長い期間は炎症抑制型のTh2パターンである。hCGやプロゲステロン、エストロゲンによってサイトカインやマクロファージの数や質が変化し炎症抑制型環境に移行する。
妊娠末期になると再びTh1炎症誘導型に再変化して分娩が始まる。
続きはこちら↓↓↓

この記事が気に入ったらサポートをしてみませんか?
