高校無機化学#10(16族)~硫黄①~
①硫黄単体
同素体を持つのは、「S, C, O, P」であり、前回はOについて考えた。今回はSの同素体について見ていこう。

Sの同素体は、単斜硫黄、斜方硫黄、ゴム状硫黄の三種。斜方硫黄と単斜硫黄は分子式、分子構造は同じであるが、結晶構造に違いがあるため区別されている。
単斜硫黄、斜方硫黄の分子構造は、下の図を参照してほしい。

この形は、よく「王冠型」と表現される。
最も重要なのが、それぞれの安定性について。(上の表の一番右の欄)

上のフローチャートを見てみると、常温では斜方硫黄が安定、高温では単斜硫黄が安定、その後加熱を続けると液体となり、液体硫黄を急冷するとゴム状硫黄が生成し、ゴム状イオンを室温で放置すると斜方硫黄に戻っていくことが分かる。
この流れを理解していこう。

斜方硫黄を加熱すると単斜硫黄に変化するのは、前述の通り、結晶構造の違いによって安定性にも違いがあるからである。そのまま加熱すると、S₈のフォーメーションが切断されてバラバラになる。これが、液体硫黄である。液体硫黄を急冷すると、徐々に冷やすのとは異なり、最も安定なS₈のフォーメーションに戻る時間がないため、無定型となる。これが、ゴム状硫黄である。ここで、電子式を書いてみればわかると思うが、ゴム状硫黄は、非共有電子対の反発が非常に大きく、硫黄原子間の結合がプチプチと切れていって、常温で放置すると最終的には、斜方硫黄のフォーメーションに戻ることとなる。
ここからは、Sが作る化合物について考える。
②H₂S
(製法)
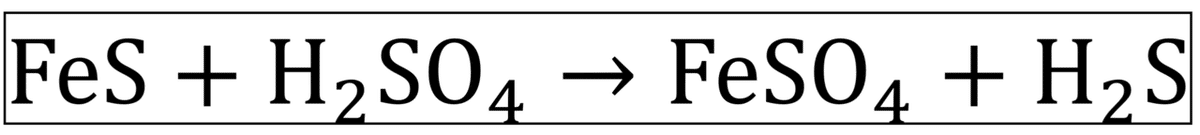
硫化鉄(Ⅱ)に希硫酸を加える弱酸遊離反応により生成する。この反応は揮発生産遊離反応ではないので、強酸として、濃硫酸ではなく希硫酸を使っている。ちなみに、希硫酸ではなくても強酸なら何でもよいのだが、硝酸は酸化剤として働きH₂S(還元剤)と反応する、塩酸は揮発して生成するH₂Sに混ざってしまうという理由があり、希硫酸がよく使われる。
(性質)
H₂Sは腐卵臭のする、有毒気体である。
また、H₂Sの構造式は、次のようである。

HとSの電気陰性度があまり違いがないため、H₂Sは弱い極性分子となり、水への溶解量が少なくなる。また、H-S結合の極性も小さいため、H+が電離しにくく弱酸となる。
H₂Sは二価の弱酸であり、

上のように電離する。これは、無機の定性分析や、化学平衡の問題でもよく出題される反応である。
また、H₂Sは還元剤として働き、半反応式は(作り方については、補足・半反応式の作り方参照)次のようになる。
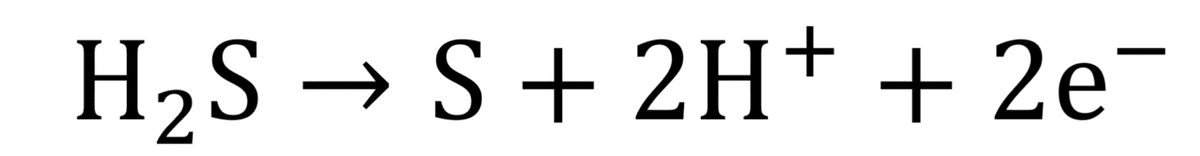
このとき、H₂Sは酸性より、液性もOKである。
H₂Sの検出には、SO₂と反応させてS粒子の白煙が生じることを利用する。(酸化還元反応)

次回になるが、SO₂はH₂Sに対して、酸化剤として働くため、この反応式は次のようにして得られる。

硫黄は、重要な化合物が多いので、1つずつ丁寧に見ていこう。ありがとうございました。
この記事が参加している募集
この記事が気に入ったらサポートをしてみませんか?