
3-2. 分子
こんにちは、おのれーです。
前回はイオン同士の結びつきについてを学んでいきましたが、今度は3回に渡って、原子同士の結びつきについて見ていきたいと思います。
■原子は寂しがりやな粒子!
原子は、もともと安定な閉殻構造をもっている貴ガス(希ガス)を除いて、安定で幸せな状態を求めています。
安定な構造になるためには、電子をもらったり、放出したりしなくてはいけないので、原子は他の原子と協力しなければいけません。なので、多くの原子は、あわよくば協力してくれる相手を求めて、エネルギーをたくわえています。
原子が単独で存在しないことを、初めて提唱したのは、19世紀初頭のイタリアの科学者、アボガドロです。
アボガドロは、ドルトンが原子説をまとめた後、「水素や酸素など気体の物質は、バラバラの原子として存在するのではなく、いくつかの原子が結びついた状態で存在している」と考えました。
この原子と原子が結びついた粒のことを分子といいます。これは、"モールス"という「かたまり、量」という意味の言葉が語源です。現在では、いろいろな実験によって、分子が実在することが確かめられています。

一般に、非金属の元素(酸素、窒素など)どうしでは、原子どうしが共有結合により、分子をつくることが知られています。
■分子はどのようにしてできるのか?
では、分子はどのようにしてできるのでしょうか?
ここでは、水素原子2つが結びついて水素分子H2をつくるときを例にして、考えていきたいと思います。
水素原子Hは、原子番号が1であり、原子核のまわりを1個の電子がまわっている原子です。この1個の電子が入っている電子殻であるK殻は、最大収容電子数が2個であり、2個電子が収容されている状態が最も安定な閉殻構造です。したがって、水素原子は「あと1個電子が欲しい」と思っています。

「電子が欲しい」と思っている原子どうしが出会ったとき、何が起こるのでしょうか。互いに「欲しい!「欲しい!」と叫びまくって、電子の奪い合いになるのでしょうか。
それが、ならないのです。
なんと、「お互い足りないんだったら、一緒に自分が持ってる電子を使わない?」と声を掛け合い、互いの電子の通り道をつなげて、2つの原子がもっている電子を一緒に使い始めます。
※動いているイメージ動画は下の「3_2_14.mp4」をダウンロードしてご覧ください。
なんだか、感動的ですよね。人間もこんな風に、困ったときは互いに助け合いながら生きていけたら、争いなんて怒らないのに・・・と思ってしまいます。原子を見習いたいものです。
このように、「電子を欲しい」と思っている原子(価電子数の多い、非金属の原子)どうしが、互いの電子を一緒に使うようにするためにくっついてできる結合を共有結合といいます。また、2つの原子が一緒に共有して使っている電子のペアを共有電子対とよんでいます。共有結合をつくると、各原子は、貴ガス原子と同じ電子配置になっていて、安定です。

先程もいったように、原子は互いの幸せを追求するので、片方の原子だけが幸せになることはありません。よく『ドラえもん』で、ジャイアンがのび太君に「おい、のび太~!俺のものは俺のもの、お前のものも俺のものだ!」といってのび太君のものを奪う場面が出てきますが、原子の世界には基本的にはジャイアンはいないと思ってください。

■電子の共有方法にもいろいろある!
分子がどのようにしてできるのかは、何となくわかりましたが?
では、水素分子H2以外の分子は、どのようにしてできるのでしょうか?ここではいくつが具体例をあげて確認していきたいと思います。
(1) 水分子 H2O
水分子は水素原子2個と酸素原子1個からできている分子です。
水素原子は先ほど出てきたように、「1個だけ電子が欲しい!」と思っている原子ですが、酸素はちょっとだけ欲張りで「電子を2個欲しい!」と思っている原子です。
したがって、水素原子1個だけでは酸素原子の欲望を満たすことはできません。水素原子は「あと一人、一緒に電子使いたい人いる~?」とばかりに、もう1個仲間を連れてきて、酸素原子の欲望に応えます。
このように水分子は、水素原子2個の持っている電子それぞれ1個と、酸素原子が持っている電子2個、計4個の電子を共有してできています。

また、水素分子H2や水分子H2Oのように、各原子間で1個ずつ電子を出し合って共有電子対をつくっているとき、共有結合の中でも特に「単結合」という名称でよばれたりもします。
ちなみにかなり余談ですが、私が化学を大学で専攻しようと思ったきっかけは「水の研究がしたい」という思いでした。結局大学では水質の研究をされていた教授が定年退職されてしまったので、次に興味のあった神経化学を専攻したのですが(これはこれで非常に面白かったです)、今でも水分子を見ると興奮してしまうくらい水という物質が好きなので、以前同僚が「先生、水分子好きでしたよね」と水分子のストラップをプレゼントしてくれました。いや、本当にかわいい。その節はありがとうございました。

(2) 二酸化炭素分子
二酸化炭素分子は酸素原子2個と炭素原子1個からできている分子です。
酸素原子は先ほど出てきたように、「電子を2個欲しい!」と思っている原子ですが、炭素原子はさらに欲張りで、「電子を4個欲しい!!」と思っている原子です。
したがって、酸素原子1個だけでは炭素原子の欲望を満たすことはできません。酸素原子はもう1個仲間を連れてきて、炭素原子の欲望に応えます。
このように二酸化炭素分子は、酸素原子2個が持っている電子それぞれ2個ずつと、炭素原子が持っている電子4個、計8個の電子を共有してできています。

また二酸化炭素分子で見られるように、各原子間で2個ずつ電子を出し合って共有電子対をつくっているとき、共有結合の中でも特に「二重結合」という名称でよばれたりもします。
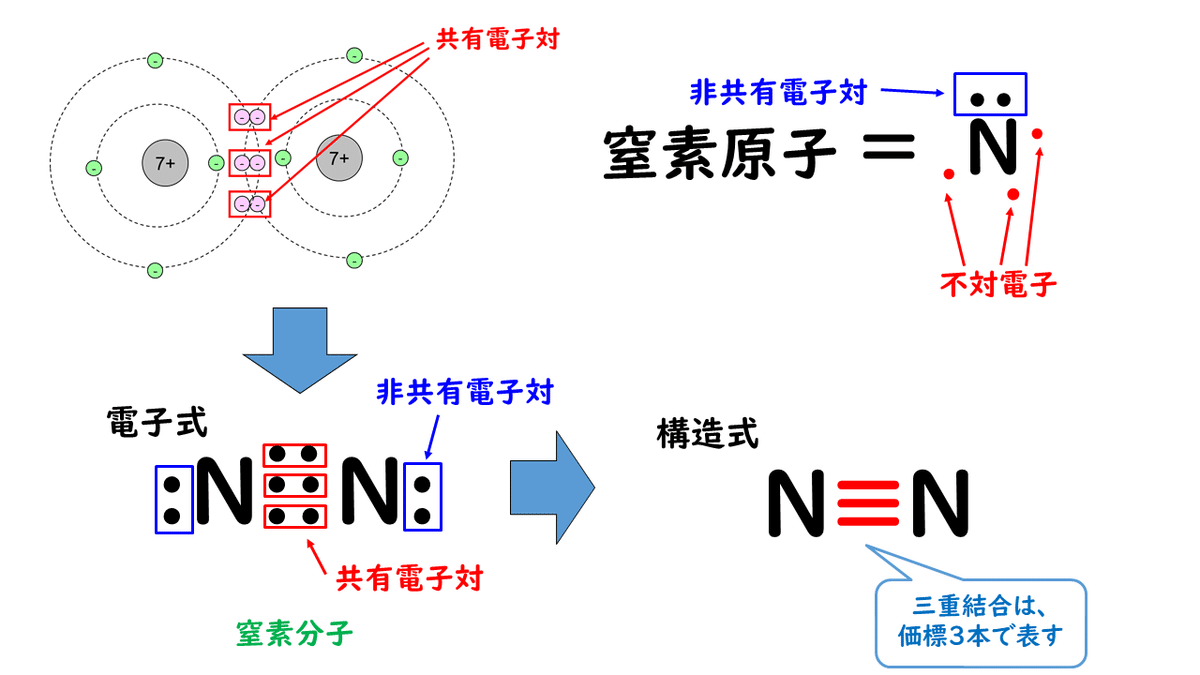
(3) 窒素分子
窒素分子は窒素原子2個からできている分子です。
窒素原子は割と欲張りで、「電子を3個欲しい!」と思っている原子です
したがって、窒素分子は、窒素原子2個が持っている電子それぞれ3個ずつ、計6個の電子を共有してできています。

また窒素分子で見られるように、各原子間で3個ずつ電子を出し合って共有電子対をつくっているとき、共有結合の中でも特に「三重結合」という名称でよばれたりもします。
■価電子に注目をして分子をつくってみる!
ここで、もう少し丁寧に共有結合について考えていきたいと思います。
先ほどから書いているように、共有結合とは、原子間で価電子を共有してできる結合です。なので、原子がいくつ価電子を持っているかで、他の原子とどのように結合するかが決まってきます。
ただし、いちいちあのアーチェリーの的のようなグルグルした電子配置を描いて考えるのは大変なので、共有結合を考えるときには、価電子だけに注目をした「電子式」というものを使って考えることがあります。
電子式とは、元素記号のまわりに、最外殻電子を点で表したものです。
点の位置は、必要に応じて変えて表しても良いのですが、基本的に次のような約束があります。
・元素記号の上下左右の4か所に、それぞれ2個ずつ電子「・」を描くことができる。
・電子4個までは、上下左右に1個ずつ書いていき、5個目以降は、上下左右にすでに描いてある電子「・」と対になるように、「・」を描き入れる。

このとき、上下左右の部屋に、すでに2つの電子が対(ペア)になって入っている場合、その電子のペアのことを非共有電子対といいます。また、上下左右の部屋に、1つしか電子が入っていない場合、この孤独な電子のことを不対電子といいます。この不対電子が相手を見つけ、相手の電子と共有電子対をつくることで、分子はつくられます。
とりあえず、「電子は孤独を嫌い、ペアになりたがる」ということをおさえておくとよいでしょう。貴ガス原子は、最外殻電子が8個なので、上下左右の部屋すべてでペアがつくられているので、それ以上相手を求めようとはしないのですね。
ちなみに、1つの共有電子対(:)は、1本の線(-)で表すことができます。この共有電子対を表す線のことを価標とよび、価標を使って分子の構造を表した式を構造式とよんでいます(詳しくは後述)。
では、先ほど見てきた分子たちについて、電子式と構造式を使って、その構造を考えてみましょう。
(1) 水素分子H2
水素原子は1個あたり、不対電子1個を持っています。水素原子2個の間で、不対電子を1個ずつ出し合い、共有電子対をつくっています。

(2) 水分子
水素原子は1個あたり、不対電子1個を持っています。また酸素原子は1個あたり、不対電子2個を持っています。水素原子と酸素原子の間で、不対電子を1個ずつ出し合い、共有電子対をつくることができますが、水素原子1個では足りないので、酸素原子1個あたり水素原子2個と共有結合しています。

(3) 二酸化炭素分子
炭素原子は1個あたり、不対電子4個を持っています。また酸素原子は1個あたり、不対電子2個を持っています。炭素原子と酸素原子の間で、不対電子を2個ずつ出し合い、共有電子対をつくることができますが、酸素原子1個では足りないので、炭素原子1個あたり酸素原子2個と共有結合しています。

(4) 窒素分子
窒素原子は1個あたり、不対電子3個を持っています。窒素原子2個の間で、不対電子を3個ずつ出し合い、共有電子対をつくっています。
■原子には手が生えている?!
と、見出しには書きましたが、実際に原子に手が生えているわけではありません。
ただ、いちいち電子式を書いて分子をつくっていくのも面倒だったりもするので、この「原子の手」の考え方を利用できるようにしておくと、大変便利です。
「原子の手」とは、相手の原子と共有することができる電子、つまりまだペアをつくっていない不対電子の数を指し、「原子価」とよばれています。原子価は、共有結合をつくるときに1個の原子から出ている価標の数とも考えることができます。
原子価(不対電子数) = 8(K殻は2) - 価電子数
代表的な原子の原子価は以下の通りです。

この考え方を使って、先ほどの分子をつくってみると、以下のようになります。「化学」の分野に入り、有機化合物を学ぶ際、「原子の手」の考え方は大変重要になってきますので、パズルだと思って楽しみながら練習してみて下さい。

今日はここまでです。
最後にワンポイントチェック
1.共有結合とはどのような結合か?
2.不対電子、非共有電子対、共有電子対とは何か?
3.電子式と構造式で水素分子、水分子、二酸化炭素分子、窒素分子を書き表すことができるか?
次回は、具体的に分子でできている物質について見ていきます。お楽しみに!
3-1. イオン結合とイオン結晶 | 3-3. 分子間力と分子結晶→
この記事が気に入ったらサポートをしてみませんか?
