
3-1. イオン結合とイオン結晶
こんにちは、おのれーです。
今日から第3章のスタートです。
3章では、原子やイオンなど、物質をつくっている小さな粒子どうしが、どのように結び付いて私たちの目に見えるようなかたまりをつくりだしているのかを見ていきます。
第1回の今回は、イオンに注目をしていきます。
■電子の貸し借りから始まる恋物語
1-5. イオンの生成で学んだように、イオンとは「原子が電子をやり取りすることで電荷を帯びるようになった粒子」のことをいいます。
なぜ原子が、電子をやりとりするんだったっけ??
と思った人のために、ここで少しだけ復習です。
原子は、最外殻電子が8個の「閉殻構造」をとるときがもっとも安定であり、すべての原子の憧れの的です。その構造を元からもっているのが貴ガス(希ガス)の原子です。

したがって、最外殻にある価電子とよばれる、化学反応や結合に関わる電子が少ない場合は、電子(-)を放出して内側の電子殻が最外殻となるような閉殻構造をとり、陽イオンとなります。逆に、価電子が多い場合は、電子をさらにもらってきて閉殻構造をとり、陰イオンとなります。
このとき、2つの原子間で電子がやりとりされると、近いところに陽イオン(+)と陰イオン(-)が存在することになります。さらに、プラスとマイナスの電気は仲が良いですから、陽イオンと陰イオンは互いに引かれ合い、結合をつくります。まるで、物の貸し借りをしているうちに恋が芽生えて付き合い始めてしまった恋人同士のようですね。

このとき、陽イオンと陰イオンの間にはたらく引力を静電気力、またはクーロン力といいます。よく"クローン力"と答える人がいるのですが、それは遺伝子工学の話なので気をつけて下さい。ちなみに、静電気力は、下敷きで髪の毛をこすって持ち上げると、髪の毛が下敷きについていって逆立つ、あれだと思ってください。
また、陽イオンと陰イオンが静電気力(クーロン力)によって引き付けられることで形成された結合を、イオン結合とよんでいます。
■食塩はおびただしい数のイオンでできている!
イオン結合は、陽イオンと陰イオン、それぞれ1つずつを結び付けるだけではありません。何個も繰り返しイオン結合によって陽イオンと陰イオンが結びつけられ、規則正しい配列で並んでできる物質もあります。
このような、イオン結合によってできている結晶(固体)を、イオン結晶といいます。
ちなみに、海水には、塩化ナトリウムNaClや塩化マグネシウムMgCl2などのイオン結晶がたくさん溶け込んでいます。代表格である塩化ナトリウムは、ナトリウムイオンNa+と塩化物イオンCl-が1:1の割合で何度も何度も繰り返し結び付いてできた物質です。

私たちの食卓で普段使われている食塩は、実はNa+とCl-が数えきれないほど結び付いてようやくできたものだったのですね。でも、食べても静電気でパチパチいわないのは、陽イオンと陰イオンの持つ電荷の数がそろっているからです。
■イオン結晶はツンデレ?
では、イオン結晶はどのような特徴がある物質なのでしょうか? いくつか性質を見ていきましょう。
(1) 融点が高い
イオン結合はプラスとマイナスの電気が引き合ってできる結合なので、比較的強い結合です。なので、結合を切って、固体が液体の状態に変わるためには、たくさんのエネルギーが必要です。したがって、融点は比較的高い温度になります。
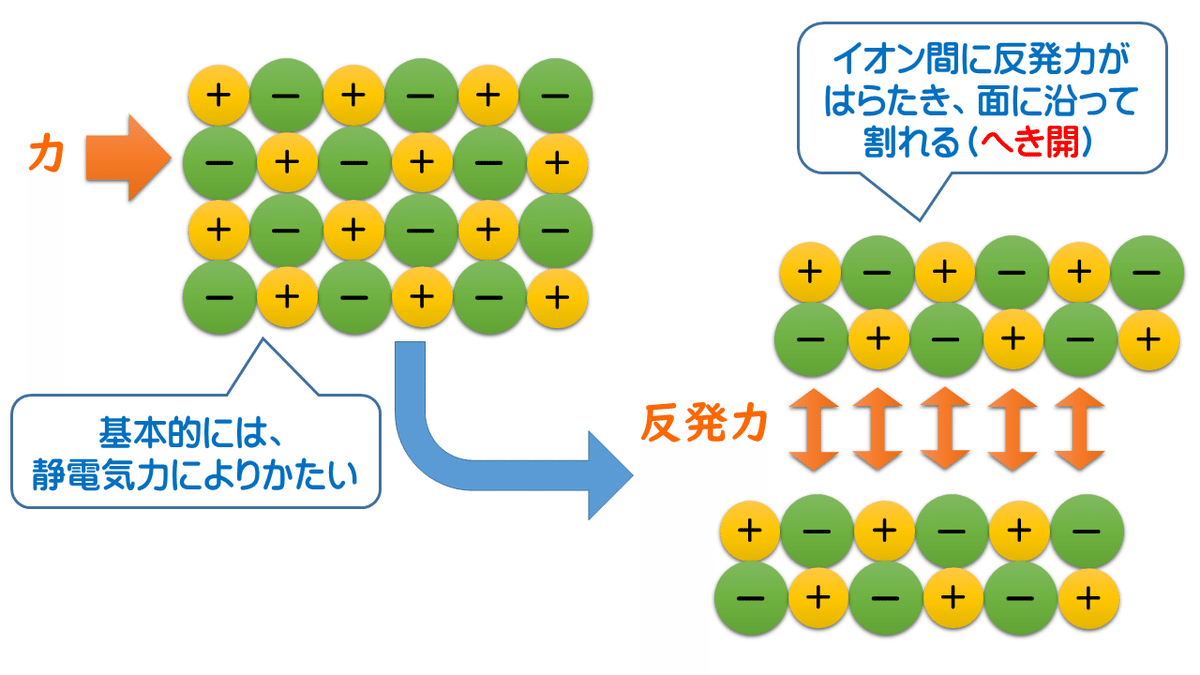
(2) かたいが、もろい
上に書いたように、イオン結合は強い結合なので、結晶の硬さも比較的硬いです。しかし、横から力を加えることで、陽イオンと陰イオンの配列がずれてしまうと、それまで+と-で引かれ合っていたところが、+と+、-と-が隣り合うことで反発力がはたらくようになり、結晶はかんたんに割れてしまいます。これをへき開といっています。
「かたいが、もろい」って初めて見ると訳がわからない性質ですが、イオン結晶は、強情だけど、つけこまれるとすぐにもろくも割れてしまう実は弱い奴なのです。
(3) とけると、電気を通す
電流の正体は電子の流れです。要は電荷をもつ粒子が動かなければ、電気を通すことはできないと考えてよいでしょう。
イオン結晶は、固体の状態だと陽イオンと陰イオンがガッチリ結び付いていて動くことができず、電気を通すことができません。
しかし、温度を高くして固体から液体の状態に融解したり、水に溶かして水溶液の状態にすると、陽イオンと陰イオンはバラバラになり、動き回ることができるようになるので、電気を通すことができます。

このように、イオン結晶は一見すると強くて動じない印象を持ちますが、実際はもろかったり、条件を変えることで性質が変わるなど、ツンデレな面を持ち合わせている物質です。
■イオン結晶の化学式はどうやって書くの?
イオン結晶は、たくさんの陽イオンと陰イオンが結びついてできており、何個ずつ結びついているかはものによります。
なので、イオン結晶を表す化学式は、陽イオンと陰イオンがどのくらいの割合で結びついているか、その割合を最も簡単な整数比で表した式、組成式で表します。
組成式を書くときには、
① 構成する陽イオンを左に、陰イオンを右に、電荷を取った(右上の数字と符号を除いた状態で)書きます。
② +と-の電荷が等しくなるように、陽イオンと陰イオンの個数を合わせます。
③ それぞれの個数を元素記号の右下に書きます(1は省略)。
という手順で書いてください。
なお、多原子イオンが複数あるときは、多原子イオンを( )でくくって、その個数を右下に書くようにします。1個だけのときは、( )でくくる必要はありません。
もし、数合わせが難しいと感じた人は、「組成式カード」を使って練習してみましょう。

なお、組成式はよく出てくるし、暗記事項を減らすためにも、作り方をマスターしておくことがとても重要です。下の表も参考にしながら、練習してみてください!

今回はここまでです。
最後にワンポイントチェック
1.イオン結合はどのようにしてできるか?
2.イオン結晶はどのようにしてできるか?
3.イオン結晶の特徴にはどのようなものがあるか?
4.与えられた陽イオンと陰イオンのイオン式から、組成式を組み立ててつくることができるか?
次回は原子間の結合について見ていきます。お楽しみに!
この記事が気に入ったらサポートをしてみませんか?
