
7-2. 酸化数
こんにちは、おのれーです。
前回は、「酸化」と「還元」を酸素原子のやり取りだけでなく、水素原子や電子のやり取りでも見てみるということを確認していきました。
今日は、電子のやり取りがさらに分かりやすくなる「酸化数」というものの考え方について見ていきたいと思います。
■電子のやり取りがちょっとわかりにくいとき、どうする?
前回、反応の前後で、電子を失っていたら「酸化された」、電子を受け取っていたら「還元された」と判断するということを確認しました。
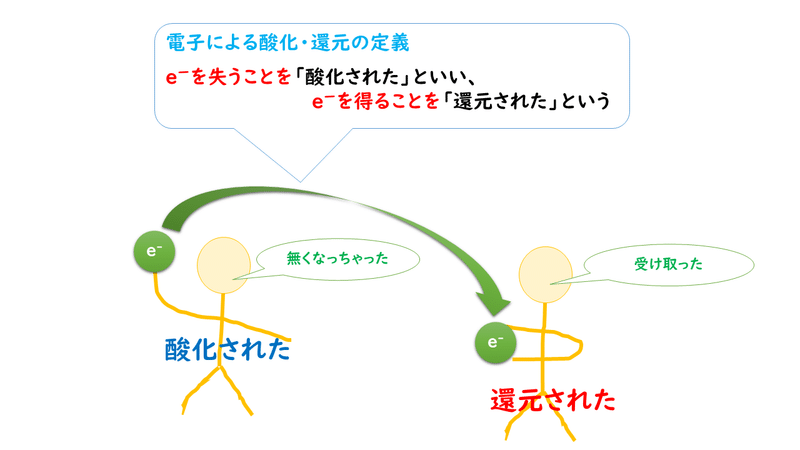
しかし、反応式をパッと見ただけでは、なかなか電子のやり取りがどうなっているのか、わかりづらいこともあると思います。
そこで、いろいろな反応において、原子やイオンの電子の授受を明確にするため、酸化数という数値を用いて考えることがあります。
酸化数とは、化合物やイオンを構成している原子が、電気的に中性な原子と比べて、電子を何個失った(どれだけ酸化された)状態にあるか、あるいは電子を何個余分に受け取った(どれだけ還元された)状態にあるかを示す数値です。
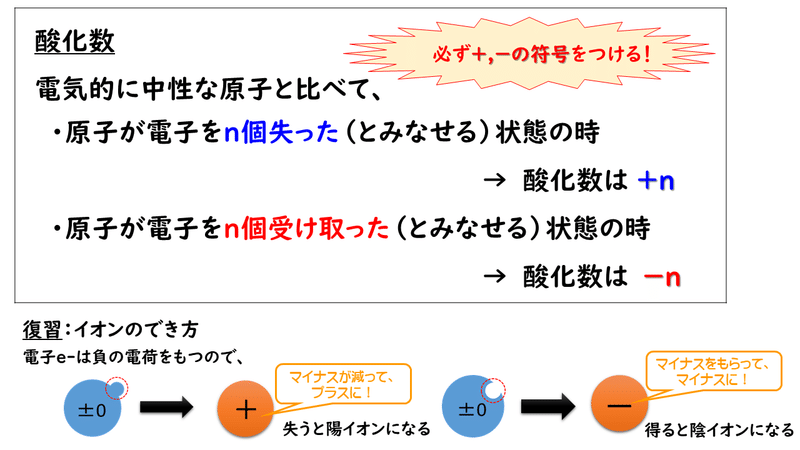
このとき、電子はマイナスの電荷をもった粒子ですから、失うとプラスになり、もらうとマイナスになるというところは注意してください。
したがって、電子を失う(酸化される)ほど、その原子の酸化数は大きくなり、電子を多く受け取る(還元される)ほど、その原子の酸化数は小さくなります。
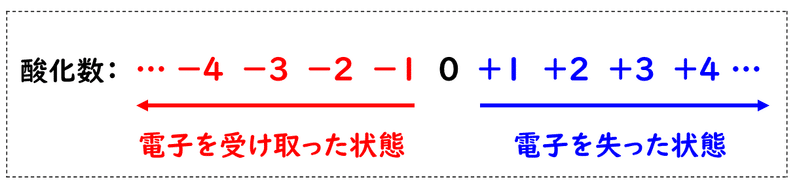
気を付けて欲しいのは、酸化数がプラスのときでも、数字の前に「+」の符号をつけることです。忘れる人が多いので注意しましょう。ちなみに、「0」は「±0」とは書かなくて大丈夫です。また、酸化数はローマ数字を用いて、「+Ⅰ」「-Ⅱ」のように表すこともありますが、どちらでもかまいません。
なお、原子は最外殻電子数が8個が安定な構造ですので、8個以上の電子をもらってきたり、放出したりすることはありません。例えば、価電子数が1の原子なら、電子をもらってくるにしても7個までしかもらえず、酸化数は「-7」が最小になります。価電子数が7の原子なら、電子は7個までしか放出することができませんから、「+7」が最大になります。このように、酸化数の大きさは、最小値が「価電子数-8」、最大値が「価電子数」になります。
■酸化数ってどうやって求めるの?
「電子のやり取り」というと、電子を失えば陽イオンになり、もらえば陰イオンになりますので、イオンを連想する人が多いのではないかなと思います。
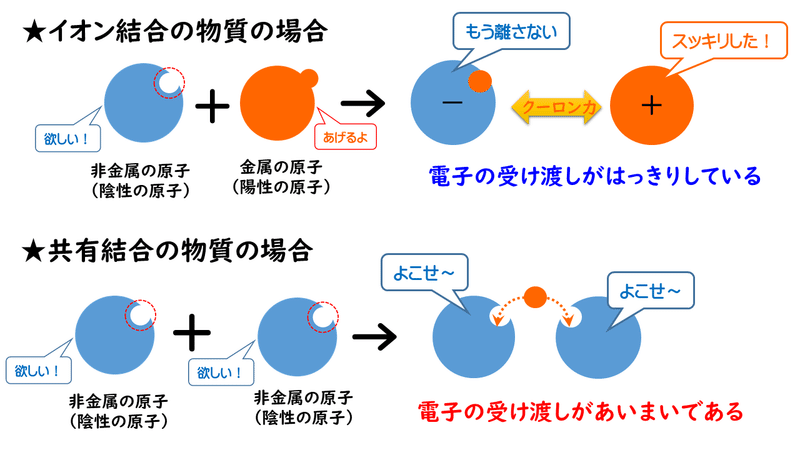
イオン結合は陽イオンと陰イオンがクーロン力(静電気力)によって互いに引き合ってできる結合ですから、原子間での電子の受け渡しがはっきりしています。したがって、「電子のやりとり」は、イオン結合の物質の場合は分かりやすいことが多いです。
しかし、イオン結合でできた物質ではなくても、酸化還元反応に関係している物質もあります。それは、共有結合でできている物質(分子など)です。
共有結合では、電子を原子間で共有しているので、受け渡しがあいまいです。
ただ、3-3. 分子間力と分子結晶 で確認したように、分子をつくっている原子にも共有電子対を引きつける強さの違いがあります(電気陰性度)。例えば、水素原子Hとフッ素原子Fでは、電気陰性度の大きさはH<Fなので、共有電子対はFの方に引きつけられています。
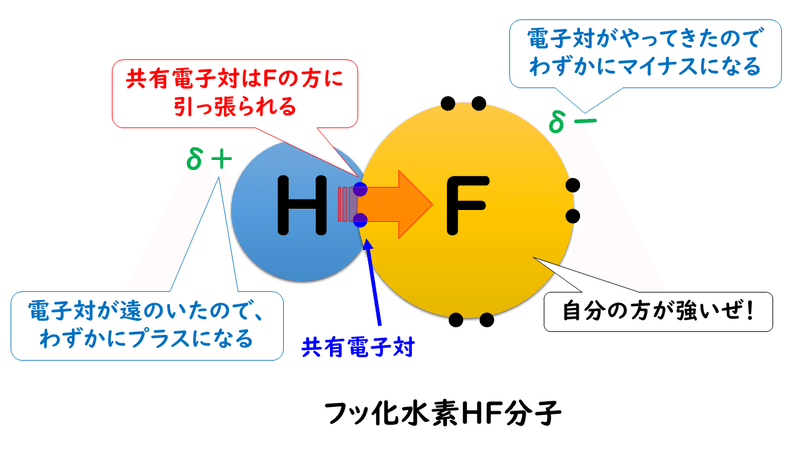
このとき、Hはもともと持っていた1つの電子さえも、Fに引っ張られてしまうので、酸化数は「+1」になります。逆にFはHの持っている電子を1個、自分の方に引きつけているので、酸化数は「-1」になります。
このように、「電子を共有している」といっても、実際には、どちらかの原子に電子が引きつけられていたりすることもあります。
ただ、共有結合でできている物質については、電子式を書いて、電気陰性度の大きさを考えて酸化数を決めなければいけないので、少しわかりづらいことも出てきます。
そこで、そのような場合でも電子のやり取りがはっきり分かるように、酸化数は次のような規則に従って決めています。
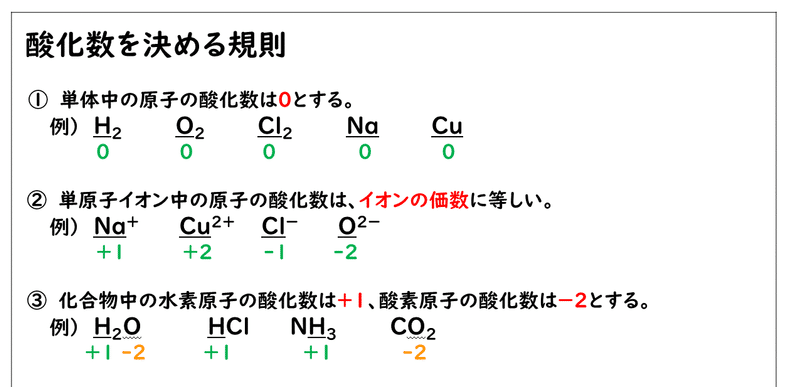

基本的には、この原則にしたがって計算していけば、酸化数を求めることができます。
それでは、問題を解いてみましょう。

■酸化数の変化で、酸化還元反応を斬る!
同じ原子であっても、その原子が含まれている化合物によって、相手の原子との結びつき方が違うことがあります。他の原子との結びつき方が異なると、酸化数も異なります。なので、化学反応をして、物質が別の物質に変化した時、反応の前後で、物質中の原子の酸化数が、増えたり減ったりすることがあります。
たとえば、銅の酸化反応について見てみましょう。
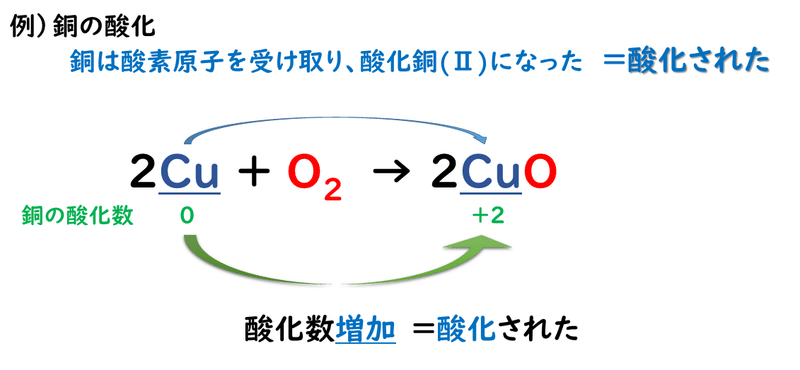
このように、化学変化の前後で、ある原子の酸化数が増加した時、その原子は「酸化された」という。
また、炭素による酸化銅(Ⅱ)の還元反応についても考えてみましょう。
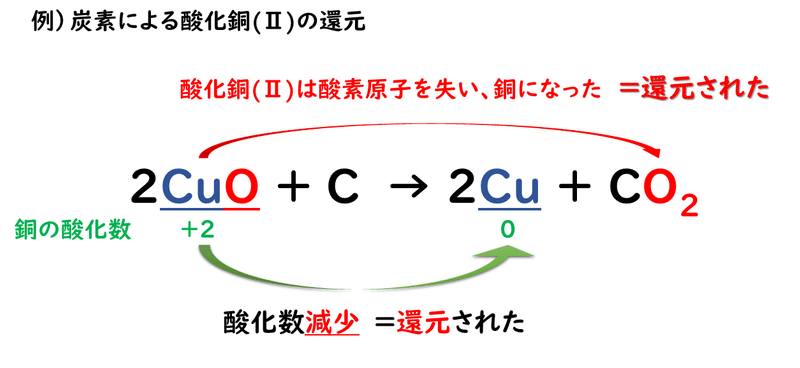
このように、化学変化の前後で、ある原子の酸化数が減少した時、その原子は「還元された」といいいます。
なお、反応の前後で、酸化数が増えも減りもしなかった原子は、酸化も還元もされなかったことになるので注意しましょう。
ではここで、問題を解いてみましょう。
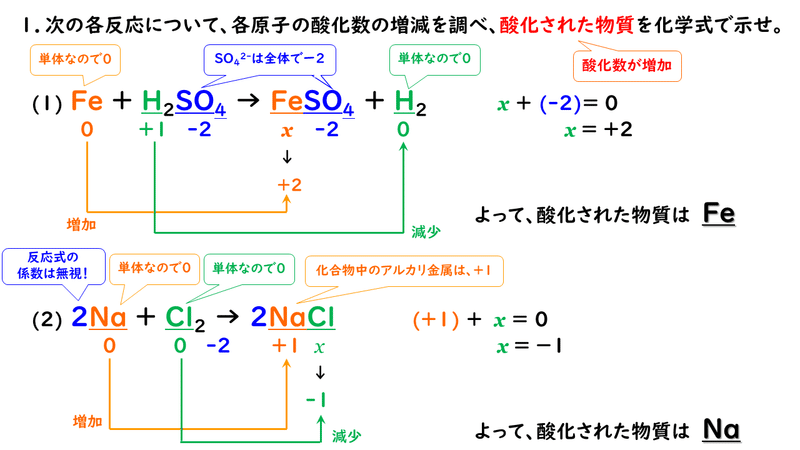
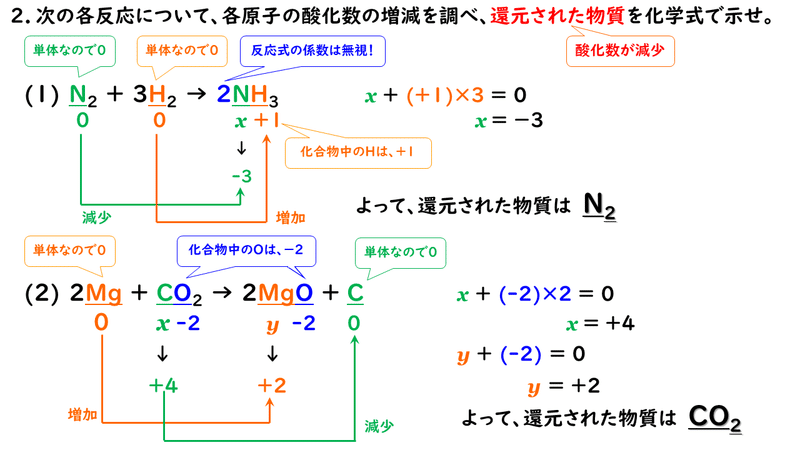
ちなみに、反応物もしくは生成物に単体がある場合は、必ず酸化還元反応です。単体中の原子の酸化数は0、つまり電子を全くやり取りしていない状態ですが、単体→化合物や、化合物→単体に変化したときに必ず酸化数も変化するからです。覚えておくと、「次の反応の中から酸化還元反応を選べ」のような問題を解く時に時間の短縮につながります。
■まとめ
これまでの酸化・還元の定義をまとめると次のようになります。
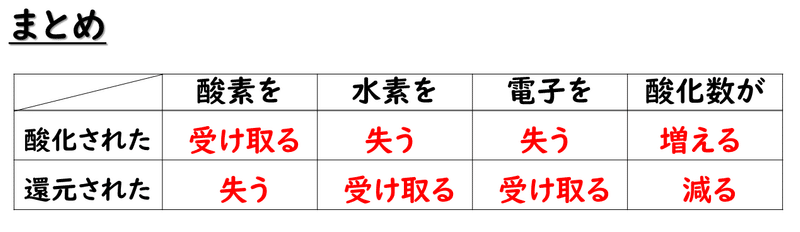
「酸素と化合」することが「酸化」ですから、「酸素を受け取る」ことが「酸化」というのは分かりやすいかと思います。まずはそれだけ覚えておいて、水素と電子は"その逆"と覚えておくと便利でしょう。
今回はここまでです。お疲れさまでした!
この記事が気に入ったらサポートをしてみませんか?
